Tạp chí da liễu – Để tải bài viết Tổng quan về chẩn đoán điều trị mụn trứng cá dành cho phụ nữ file PDF xin vui lòng click vào link ở đây.
Tác giả: A.U. Tan, MD, B.J. Schlosser, MD, PhD, A.S. Paller, MD
Đại học Northwestern, khoa da liễu, Chicago, IL
Nhóm Biên Tập và phiên dịch Circadia Việt Nam . CT.TNHH Everlasting Beauty Care
Tóm tắt
Bài đánh giá này tập trung về việc lựa chọn cách điều trị mụn trứng cá cho bệnh nhân nữ. Mụn trứng cá có thể bắt đầu ở tuổi vị thành niên sau đó tồn tại hoặc khởi phát ở tuổi trưởng thành. Mụn trứng cá tác động đến tâm lý – xã hội và ảnh hưởng đến cuộc sống của người bị mụn. Điều trị mụn trứng cá đặc biệt có những thách thức vì phải biết được những điều kiện tiên quyết của từng người bị mụn, như thời kỳ mang thai và cho con bú. Phương pháp điều trị có nhiều cách khác nhau và phương pháp điều trị này được điều chỉnh riêng cho từng đối tượng. Chúng tôi xem xét các liệu pháp thông thường với mức độ minh chứng cao, các phương pháp điều trị bổ sung với sự hỗ trợ từ các nghiên cứu tập trung và các trường hợp báo cáo, các liệu pháp bổ sung hoặc thay thế, và các tác nhân mới đang được phát triển để điều trị cho người bị mụn trứng cá.
Giới thiệu
Mụn trứng cá (AV) là một bệnh của da từ lông tơ tiết bã nhờn gây ra các tổn thương không kích thích (ngòi trứng cá nổi lên trên mặt như mụn bọc hoặc không), gây ra các tổn thương cho da (sẩn, mụn mủ và nốt sần) và để lại các mức độ sẹo khác nhau. AV là một tình trạng cực kỳ phổ biến với tỷ lệ để lại sẹo suốt đời khoảng 85% và chủ yếu xảy ra ở tuổi vị thành niên (Bhate và Williams, 2013). AV có thể tồn tại ở người trưởng thành, với tỷ lệ phổ biến mụn trứng cá là 50,9% ở phụ nữ từ 20 đến 29 tuổi so với 26,3% ở phụ nữ từ 40 đến 49 tuổi (Collier et al., 2008). Bệnh nhân nữ chiếm 2/3 số lần đến gặp bác sĩ da liễu vì mụn trứng cá, và 1/3 số lần khám da liễu là do phụ nữ trên 25 tuổi (Yentzer và cộng sự, 2010).
Mụn trứng cá dẫn đến bệnh tật đáng kể có liên quan đến chứng dư sẹo, sẹo rỗ và rối loạn tâm lý như trầm cảm và lo lắng, tự ti, dẫn đến tác động tiêu cực và ảnh hưởng nhiều đến chất lượng cuộc sống (Cunliffe, 1986; Ramos-e-Silva và cộng sự, 2015; Shuster và cộng sự, 1978). Trong một nghiên cứu dịch tễ học của Yentzer et al. (2010), 8,8% bệnh nhân bị mụn trứng cá cho biết đối với phụ nữ bị trầm cảm thường xuyên gấp đôi nam giới (10,6% so với 5,3%), nhưng điều này không liên quan đến mức độ nghiêm trọng của mụn trứng cá.
Cơ chế gây bệnh
Bốn quá trình gây bệnh chính dẫn đến hình thành các tổn thương do mụn trứng cá: thay đổi quá trình sừng hóa nang lông dẫn đến hình thành mụn trứng cá; tăng và thay đổi trao đổi bã nhờn dưới sự kiểm soát của androgen; sự xâm chiếm nang trứng của vi khuẩn Propionibacterium acnes; và phức tạp trong các cơ chế vận động liên quan đến cả miễn dịch bẩm sinh và khả năng miễn dịch (Williams và cộng sự, 2012; Zaenglein và cộng sự, 2016). Di truyền (nghiên cứu song sinh Bataille và cộng sự, 2002, tiền sử gia đình bị mụn trứng cá nặng Wei và cộng sự, 2010), chế độ ăn uống (chỉ số đường huyết Ismail và cộng sự, 2012; Kwon và cộng sự, 2012; Smith và cộng sự, 2007a, 2007b , 2008), bao gồm sô cô la (Grant và Anderson, 1965; Magin và cộng sự, 2005) và tiêu thụ sữa (Adebamowo và cộng sự, 2006, 2008; Di Landro và cộng sự, 2012); và các yếu tố môi trường (hút thuốc lá Klaz và cộng sự, 2006; Schafer và cộng sự, 2001, mỹ phẩm gây tắc nghẽn Plewig và cộng sự, 1970, phơi nhiễm nghề nghiệp Tucker, 1983) cũng góp phần vào cơ chế bệnh sinh của mụn.
Giới thiệu lâm sàng
Mụn ở phụ nữ có thể gặp ở mọi lứa tuổi và mức độ nặng nhẹ khác nhau. Bệnh nhân nữ có thể thường xuyên phát triển các tổn thương ở 1/3 dưới của khuôn mặt, đặc biệt là ở cằm và đường viền hàm (Kamangar và Shinkai, 2012). Tuy nhiên, một nghiên cứu dịch tễ học gần đây hơn của Dreno et al. (2015) gợi ý rằng sự phân bố nội tiết tố này có thể không phải là biểu hiện lâm sàng phổ biến nhất của mụn trứng cá ở phụ nữ trưởng thành.
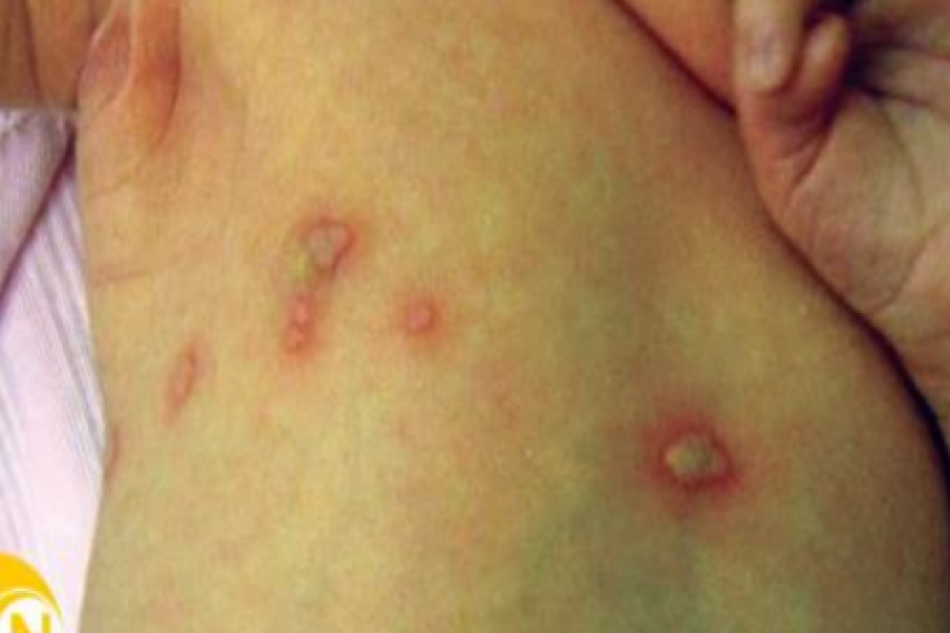
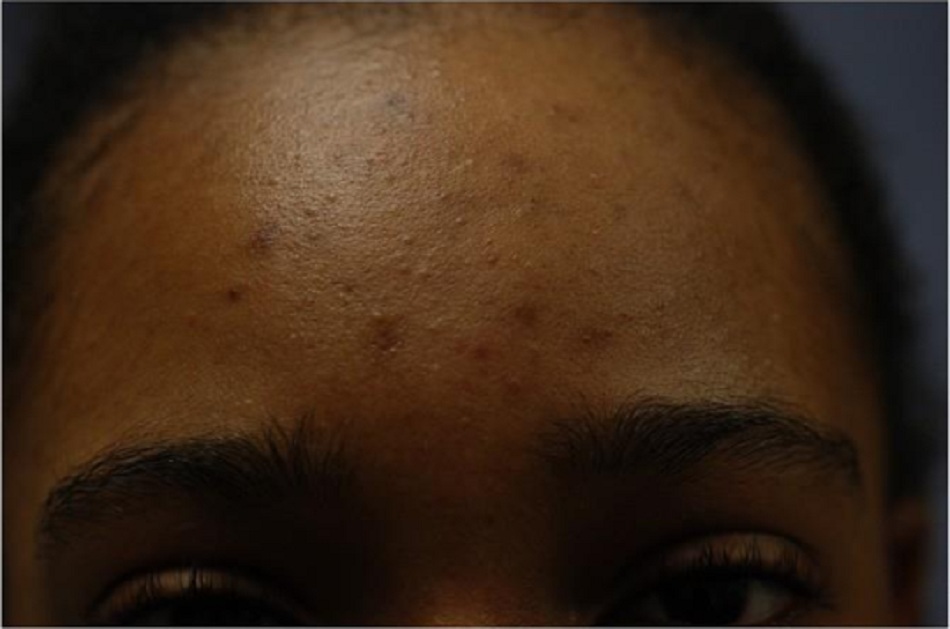
Các tổn thương do mụn bao gồm từ mụn thịt (Hình 1) đến sẩn và mụn mủ (Hình 2), u nang và / hoặc nốt sần (Hình 3). Trong một nghiên cứu về mụn trứng cá ở tuổi vị thành niên, 85% bệnh nhân chủ yếu là mụn trứng cá (Capitanio và cộng sự, 2010) với hai loại phụ được xác định là mụn dai dẳng và khởi phát muộn (Ramos-e-Silva và cộng sự, 2015). Mụn trứng cá dai dẳng, được gọi là mụn trứng cá tồn tại sau tuổi vị thành niên đến tuổi trưởng thành, chiếm 80% trường hợp ở bệnh nhân nữ trưởng thành (Holzmann và Shakery, 2014).
Cơ chế gây bệnh của mụn trứng cá ở phụ nữ đặc biệt phức tạp. Nội tiết tố androgen đóng một vai trò quan trọng (Harper, 2008; Lucky và cộng sự, 1994, 1997), bằng chứng là phản ứng của mụn trứng cá ở phụ nữ đối với các phương pháp điều trị nội tiết tố, đặc biệt là trong bối cảnh rối loạn hyperandrogenism như hội chứng buồng trứng đa nang (PCOS) và việc sử dụng các liệu pháp dựa trên hormone như thuốc tránh thai và thuốc chống thuốc điều trị androgen ở phụ nữ có mức androgen bình thường (Lolis và cộng sự, 2009). Ngoài ra, sự thiếu hụt mụn trứng cá ở phụ nữ không nhạy cảm với androgen (Imperato-McGinley và cộng sự, 1993; Thiboutot, 2004) và mức độ tăng của dehydroepiandrosterone sulfate liên quan đến sự khởi đầu của mụn trứng cá ở trẻ em gái tiền sử gia đình và một số bệnh nhân bị PCOS cũng đóng một vai trò quan trọng (Lucky et al., 1994; Chen et al., 2011). Androgen kích thích sản xuất bã nhờn thông qua các thụ thể androgen trên tuyến bã nhờn.
Mụn trứng cá khởi phát muộn được gọi là mụn trứng cá bắt đầu sau 25 tuổi (Holzmann và Shakery, 2014; Ramos-e-Silva và cộng sự, 2015). Những phụ nữ có các dấu hiệu của chứng hyperagenism như hiếm kinh hoặc kinh nguyệt không đều và những người có mụn trứng cá khởi phát muộn nên được đánh giá thêm về chứng rối loạn nội tiết tiềm ẩn như PCOS.
Cho đến nay, không có hệ thống phân loại được thống nhất trên toàn cầu cho mụn trứng cá và các hệ thống phân loại được sử dụng trong các thử nghiệm lâm sàng rất khác nhau (Zaenglein và cộng sự, 2016). Hệ thống phân loại mụn phải tính đến loại và mức độ nghiêm trọng của mụn, số lượng tổn thương, vị trí giải phẫu và mức độ của mụn, chất lượng cuộc sống của bệnh nhân và các chỉ số tâm lý xã hội khác, và sẹo (Zaenglein và cộng sự, 2016). Tan et al. (2013) đã đánh giá 18 thang điểm phân loại mụn trứng cá toàn cầu với các phương pháp phân loại từ mô tả văn bản, điểm cho số lượng và loại tổn thương, mức độ nghiêm trọng, điểm cho mụn trứng cá đối với mụn trứng cá đang phát triển đến việc sử dụng các bức ảnh chuẩn hóa.
Có hai nhóm thang phân loại bao gồm những thang đo sử dụng các thước đo định lượng như số lượng tổn thương và phạm vi số và những thang đo dựa trên mô tả định tính. Các thang đo định lượng bao gồm các thang đo xác định số lượng và loại tổn thương mụn nguyên phát (Del Rosso và cộng sự, 2007; Hayashi và cộng sự, 2008; Plewig và Kligman, 1975) và các thang chỉ định trọng số cho các loại tổn thương để tạo ra chỉ số mức độ nghiêm trọng ( Doshi và cộng sự, 1997; Liden và cộng sự, 1980; Michaelsson và cộng sự, 1977). Các thang đo định tính sử dụng các tính từ như ít, một số và nhiều để định lượng tổn thương. Cũng có những thang đo chỉ sử dụng các mẫu ảnh có mức độ nghiêm trọng khác nhau (Burke và Cunliffe, 1984; O’Brien và cộng sự, 1998).
Cân nhắc đánh giá
Việc đánh giá bất kỳ bệnh nhân nào bị mụn trứng cá nên bao gồm tiền sử bệnh và khám sức khỏe kỹ lưỡng. Thuốc và việc sử dụng thuốc giảm đau, tiền sử xã hội bao gồm sử dụng thuốc lá và ma túy bất hợp pháp, lịch sử kinh nguyệt (ví dụ: tuổi mãn kinh, kinh nguyệt đều đặn, tiền sử vô sinh) và các phương pháp điều trị mụn trứng cá trước đây / hiện tại phải được làm sáng tỏ (Kamangar và Shinkai, 2012). Cần tiến hành đánh giá đầy đủ các hệ thống để tìm kiếm các triệu chứng của bệnh tiết quá mức hormone androgen (hyperandrogenism) hoặc các rối loạn nội tiết khác.
Các dấu hiệu và triệu chứng của chứng hyperandrogenism bao gồm mụn trứng cá, lông rậm, tăng tiết bã nhờn, rụng tóc nội tiết tố nam, không có kinh nguyệt, chu kỳ kinh nguyệt không đều, chậm kinh, sự phát triển các đặc điểm thể chất nam giới, âm vật to, vô sinh, buồng trứng đa nang, tăng khối lượng cơ và giảm kích thước bầu ngực (Harper, 2008; Lolis et al., 2009). Trong số này, lông mọc quá nhiều trên cơ thể là biểu hiện phổ biến nhất của chứng rậm lông và 70% phụ nữ có chứng rậm lông (Lucky, 1995). Rậm lông có liên quan nhiều đến nồng độ testosterone tự do trong huyết thanh. Do việc triệt lông có thể che khuất sự nhận biết của bác sĩ lâm sàng về chứng rậm lông, bệnh nhân nên được hỏi về bản chất và tần suất của các biện pháp triệt lông cũng như vị trí lông mọc quá mức. nếu bệnh nhân có các dấu hiệu hoặc triệu chứng của bệnh hyperandrogenism, nên bắt đầu kiểm tra kỹ lưỡng về nội tiết.
Chẩn đoán phân biệt mụn trứng cá ở bệnh nhân nữ trưởng thành được trình bày trong Bảng 1, cùng với các đặc điểm phân biệt. Ngoài ra, cần đánh giá các nguyên nhân cơ bản gây ra mụn trứng cá bao gồm cả chứng hyperandrogenism. Nguyên nhân gây ra mụn trứng cá do thuốc được trình bày chi tiết trong Bảng 2.
Thử nghiệm thêm
Thử nghiệm vi sinh
P.acnes được cho là tác nhân gây bệnh quan trọng trong việc phát triển mụn trứng cá. Việc nuôi cấy thường không được thực hiện trừ khi viêm nang lông do vi khuẩn gram âm hoặc viêm nang lông do vi khuẩn Staphylococcus aureus được xem xét trong chẩn đoán phân biệt (Zaenglein và cộng sự, 2016).
Viêm nang lông do vi khuẩn gram âm biểu hiện dưới dạng mụn mủ mọc đơn hình ở phân bố quanh miệng, râu và cổ và điển hình khi sử dụng tetracycline đường uống kéo dài (Zaenglein và cộng sự, 2016). Viêm nang lông do vi khuẩn gram âm như Klebsiella và Serratia gây ra và được điều trị bằng isotretinoin. Liệu pháp điều hướng vi khuẩn có thể được xem xét dựa trên bối cảnh lâm sàng và đặc điểm của từng bệnh nhân.
Bảng 1. Chẩn đoán phân biệt mụn trứng cá
| Bệnh lý/Tình trạng | Đặc điểm nhận biết |
| Mụn trứng cá sẹo lồi nuchae | Thường thấy ở những bệnh nhân da đen; tổn thương khu trú ở cổ sau; ban đầu là sẩn và mụn mủ, có thể tiến triển thành sẹo lồi |
| Mụn bọc | Thứ cấp cho các mâu thuẫn hệ thống, mang tính thời sự thuốc corticosteroid, thuốc nhuộm cản quang và các sản phẩm mỹ phẩm; có thể khởi phát đột ngột và tương quan với sự phơi nhiễm; cải thiện khi ngừng tiếp xúc (Xem Bảng 2 để biết các tác nhân gây mụn trứng cá do thuốc) |
| Chloracne | Mụn bọc, mụn mủ và u nang khu trú ở vùng sau nhĩ, nách và bẹn; tiền sử tiếp xúc với hydrocacbon thơm halogen hóa; bệnh nhân có thể có các biểu hiện toàn thân khác |
| Favre-Racouchot | Các mụn thịt mở và đóng trên vùng quanh mắt và mạch vành khu vực; không có trong các tổn thương bắt đầu; bệnh nhân thường lớn tuổi hơn với tiền sử không thể tiếp xúc với ánh nắng mặt trời |
| Viêm nang lông do vi khuẩn (không phải gram âm). Viêm nang lông do vi khuẩn gram âm | Sẩn và mụn mủ có dạng nang; thường ảnh hưởng đến thân và tứ chi Thường xảy ra ở những bệnh nhân bị mụn trứng cá đã dùng thuốc kháng sinh dài ngày; mụn mủ và nốt sần; cũng có thể xảy ra ở bệnh nhân HIV +, và sau khi tiếp xúc với bồn tắm nước nóng; Có thể nuôi cấy tổn thương nếu tổn thương dạng mụn trứng cá không đáp ứng với phác đồ kháng sinh điển hình. |
| Lupus miliaris disseminatus faciei | Sẩn mịn màu vàng / nâu / đỏ ở da quanh mắt và mí mắt; sinh thiết cho thấy u hạt biểu mô trường hợp |
| Milia | Nang sừng trắng; thương tổn thường dai dẳng; noninflammatory. |
| Viêm da quanh miệng | Các nốt sẩn và mụn mủ ở vùng xung quanh phân bố; thường trầm trọng hơn khi sử dụng corticosteroid tại chỗ |
| Viêm da mặt | Khởi phát nhanh chóng ban đỏ, áp xe, u nang, và có thể có xoang, không có mụn thịt. |
| Rosacea | Đa dạng mẫu mã; ban đỏ nền với các sẩn bắt đầu và mụn mủ thường xếp chồng lên nhau; các yếu tố môi trường thường có thể kích hoạt. |
| Syringoma | Các sẩn không bắt đầu thường khu trú ở mí mắt và má ác; kết quả xét nghiệm sinh thiết da cho thấy nang giãn nở có hình dạng nòng nọc. |
| Adenoma sebaceum | Sẩn sáp nhỏ trên má giữa, mũi, và trán; nhiều tổn thương liên quan đến bệnh xơ cứng củ; kết quả xét nghiệm sinh thiết da cho thấy sự giãn nở và giãn nở mạch máu (angio fi bromas) ở da. Angio fi bromas ở mặt cũng là một đặc điểm của đa u nội tiết loại I và hiếm khi là hội chứng Birt-Hogg-Dubé. |
Nhóm công tác năm 2016 của Học viện Da liễu Hoa Kỳ (AAD) về quản lý mụn trứng cá chỉ đề xuất xét nghiệm vi sinh đối với những người có biểu hiện tổn thương giống mụn trứng cá gợi ý viêm nang lông gram âm chứ không phải các trường hợp khác (Zaenglein và cộng sự, 2016) .
Kiểm tra nội tiết
Vai trò của nội tiết tố androgen trong mụn trứng cá đã được xác định rõ ràng. Xét nghiệm nội tiết chỉ cần thiết ở những bệnh nhân có các dấu hiệu hoặc triệu chứng khác của bệnh hyperandrogenism. Nguyên nhân phổ biến nhất của sự gia tăng nội tiết tố androgen ở phụ nữ trưởng thành là PCOS (Lucky, 1983). Về mặt lâm sàng, hyperandrogenism có thể biểu hiện bằng sự phát triển /lông rậm không mong muốn, tăng tiết bã nhờn, mụn trứng cá và / hoặc rụng tóc (Azziz và cộng sự, 2009). Sự phát triển các đặc điểm thể chất nam giới không đáng kể gợi ý các rối loạn về kháng insulin nghiêm trọng, các khối u tiết androgen, và lạm dụng chất androgen (Azziz và cộng sự, 2009). Bảng kiểm tra thử nghiệm để sàng lọc PCOS bao gồm testosterone toàn phần và miễn phí, dehydroepiandrosterone sulfate, androstenedione, luteinizing hor- mone và hormone kích thích nang trứng (Azziz và cộng sự, 2009; Lawrence và cộng sự, 1981; Lucky, 1983; Lucky và cộng sự, 1983, 1997; Seira fi và cộng sự, 2007; Timpatanapong và Rojanasakul, 1997). Chẩn đoán phân biệt của PCOS bao gồm bệnh tuyến giáp, thừa prolactin, tăng sản thượng thận bẩm sinh không phân loại và các rối loạn nội tiết hiếm gặp khác (Zaenglein và cộng sự, 2016).
Bảng 2. Tác nhân gây ra mụn trứng cá do sử dụng thuốc
| Hạng mục | Ví dụ |
| Hormones | Corticosteroid và corticotropin Nội tiết tố androgen và thuốc steroid đồng hóa Thuốc tránh thai nội tiết |
| Thuốc trị liệu thần kinh | Tricyclic thuốc chống trầm cảm
Lithium Thuốc chống động kinh Aripiprazole Các chất ứng chế tái hấp thu serotonin có chọn lọc |
| Vitamins | Vitamins B1, B6, and B12 |
| Thuốc kìm tế bào | Dactinomycin (actinomycin D) |
| Các phân tử điều hòa miễn dịch | Cyclosporine
Sirolimus |
| Thuốc chống lao | Isoniazid Rifampin
Ethionamide |
| Halogens | Iodine
Bromine Chlorine |
| Các liệu pháp nhắm tới mục tiêu | Ức chế thụ thể, yếu tố tăng trưởng biểu bì Thuốc ức ch tyrosine kinase đa mục tiêu Chất ức chế tăng trưởng nội mô mạch máu Chất ức chế Proteasome
Thuốc ức chế yếu tố hoại tử khối u alfa Chất ức chế Histone deacetylase |
Điều trị mụn trứng cá
Bảng 3 cho thấy các phương pháp điều trị khác nhau cho bệnh nhân mụn trứng cá, cùng với sức mạnh của các khuyến cáo từ nhóm làm việc AAD nhưng đã sửa đổi để bao gồm xếp hạng mang thai và cho con bú. Bài viết tổng quan này tập trung vào các liệu pháp điều trị tại chỗ, điều trị kháng sinh dùng để uống, isotretinoin, và các liệu pháp mới đang được phát triển. Chúng tôi nhấn mạnh việc giới hạn thời gian điều trị của thuốc kháng sinh dùng để uống ở người lớn bị mụn trứng cá và kê đơn điều trị đồng thời và / hoặc điều trị duy trì với liệu pháp tại chỗ. Một cuộc thảo luận đầy đủ hơn về việc sử dụng các tác nhân nội tiết tố có thể được tìm thấy trong một bài báo của Trivedi et al. (2017) có tựa đề “Đánh giá các liệu pháp điều trị dựa trên hormone cho mụn trứng cá trưởng thành ở phụ nữ,” cũng được xuất bản trên tạp chí Quốc tế Tạp chí Da liễu Phụ nữ. Bảng 4 cho thấy AAD hoạt động thuật toán điều trị của nhóm để quản lý AV ở thanh thiếu niên và thanh niên, thuật toán này yêu cầu điều chỉnh trên cơ sở các yếu tố nguy cơ của bệnh nhân, loại và vị trí tổn thương mụn trứng cá và tuổi tác.
Việc điều trị mụn trứng cá rất khó khăn và thường là mãn tính, với tỷ lệ thất bại cao và nhiều lựa chọn. Mối quan hệ điều trị tốt với bệnh nhân là điều quan trọng để thiết lập cũng như đặt ra các mục tiêu điều trị thực tế.
Những phụ nữ đã được kê đơn thuốc tránh thai và có thêm các dấu hiệu thừa androgen nên được thực hiện xét nghiệm tương tự, mặc dù thuốc tránh thai đường uống có thể có lợi cho những phụ nữ mắc chứng hyperandrogenism trên lâm sàng và phòng thí nghiệm cũng như ở những phụ nữ không có những liên kết này (Zaenglein et al. , 2016). Bác sĩ nội tiết nên đánh giá những bệnh nhân có nồng độ hormone bất thường. Nhóm làm việc của AAD chỉ đề xuất các đánh giá trong phòng thí nghiệm đối với những bệnh nhân bị mụn trứng cá và có thêm dấu hiệu thừa androgen (Zaenglein và cộng sự, 2016).
Bảng 3. Nhóm cộng tác AAD 2016 sức mạnh của các khuyến nghị đối với việc quản lý và điều trị bệnh nhân bị mụn trứng cá
| Giới thiệu | Sức mạnh của việc giới thiệub | Mức độ chứng minhc | Đánh giá thai kỳ của hệ thống phân loại FDAd | Đánh giá tiết sữa | |
| Hệ thống phân loại
AAP |
LactMedd | ||||
| Liệu pháp tại chỗ | |||||
| Benzoyl peroxide | A | I, II | C | Không được đánh giá | Nguy cơ thấp |
| Thuốc kháng sinh bôi trực tiếp (VD: clindamycin và erythromycin) | A | I, II | B | Tương thích | Có thể chấp nhận được |
| Kết hợp thuốc kháng sinh bôi trực tiếp và benzoyl peroxide | A | I | |||
| Thuốc bôi retinoid trực tiếp (VD: tretinoin, adapalene, và tazarotene) | A | I, II | Tretinoin – C
Adapalene – C Tazarotene – X |
Không được đánh giá | Nguy cơ thấp |
| Kết hợp thuốc retinoid bôi trực tiếp và benzoyl peroxide/thuốc kháng sinh tại chỗ | A | I, II | |||
| Azelaic acid | A | I | B | Không được đánh giá | Nguy cơ thấp |
| Dapsone | A | I, II | C | Tương thích | Tránh ở bệnh nhân G6PD, trẻ sơ sinh/sinh non |
| Salicylic acid
Thuốc kháng sinh dùng để uống |
B | II | C | Không được đánh giá | Không được đánh giá |
| Tetracyclines (VD: tetracycline, doxycycline, và | A | I, II | D | Tương thích | Sử dụng ít chập nhận được |
| minocycline)
Macrolides (VD: azithromycin và erythromycin) |
A | I | B | Tương thích | Có thể chấp nhận được |
| Trimethoprim (có hoặc không có sulfamethoxazole) | B | II | C | Tương thích | Tránh cho trẻ sơ sinh bị vàng da, ốm yếu, sinh non |
| Giới hạn thời gian điều trị và đồng thời/duy trì điều trị trực tiêp | A | I, II | |||
| Tác nhân của nội tiết tố | |||||
| Phối hợp thuốc tránh thai | A | I | X | Tương thích | Tránh b4 tuần sau sinh |
| Spironolactone | B | II, III | C | Tương thích | Có thể chấp nhận được |
| Flutamide | C | III | D | Không được đánh giá | Không được đánh giá |
| Thuốc uống corticosteroid | B | II | C | Tương thích | Có thể chấp nhận được |
| Isotretinoin | |||||
| Liều lượng thông thường | A | I, II | X | Không được đánh giá | Không có đề xuất đưa ra Điều |
| trị liều thấp cho mụn trứng cá vừa phải | A | I, II | X | Không được đánh giá | Không có đề xuất đưa ra |
| Quan sát | B | II | |||
| Sử dụng biện pháp tránh thai và đăng ký iPledge | A | II | |||
| Liệu pháp mới | |||||
| Minocycline bọt | |||||
| Chất giải phóng nitric oxide trực tiêp Cortexolone 17a-propionate | |||||
AAD, học viện da liễu Hoa Kỳ; AAP, học viện nhi khoa Hoa Kỳ; FDA, U.S. Cục quản lý dược phẩm và thực thẩm Hoa Kỳ; cơ sở dữ liệu về LactMed, thuốc và cho con bú.
a Chỉnh sửa từ Zaenglein et al., 2016, Table 3, bao gồm các thời kỳ mang thai và cho con bú (Lowenstein, 2006).
b Các khuyến nghị lâm sàng từ AAD được phát triển dựa trên các bằng chứng tốt nhất hiện có, đã được nêu tra trong hướng dẫn này. Mức độ của khuyến nghị được xếp hạng như sau: A. Khuyến nghị dựa trên bằng chứng định hướng của bệnh nhân, chất lượng tốt và nhất quán; B. Khuyến nghị dựa trên bằng chứng định hướng của bệnh nhân không nhất quán hoặc chất lượng hạn chế; C. Tuyên dương dựa trên sự đồng thuận, ý kiến, nghiên cứu điển hình, hoặc bằng chứng định hướng bệnh tật.
c Các bằng chứng được đánh giá theo thang điểm 3 trên cơ sở chất lượng của phương pháp luận, và trọng tâm tổng thể của nghiên cứu sau: I bằng chứng chất lượng tốt nhất, hướng đến bệnh nhân, II bằng chứng hướng đến bệnh nhân chất lượng hạn chế, III Các bằng chứng khác bao gồm: hướng dẫn đồng thuận, ý kiến, nghiên cứu điển hình, hoặc bằng chứng định hướng bệnh tật.
d Do thư viên y khoa quốc gia Hoa Kỳ xuất bản.
Đánh giá thường xuyên (tức là 8-12 tuần một lần) là quan trọng để cho phép theo dõi thích hợp, quản lý các tác dụng ngoại ý và đánh giá việc tuân thủ thuốc (Kamangar và Shinkai, 2012). Tư vấn cho bệnh nhân là rất quan trọng, đặc biệt là để thiết lập một khóa học thời gian cho thuốc phù hợp và thảo luận về các phương thức điều trị trong tương lai trong trường hợp điều trị thất bại hoặc không dung nạp.
Điều trị mụn trứng cá ở phụ nữ
Các nguyên lý trung tâm của việc quản lý mụn trứng cá như được trình bày trong Bảng 4 nên được tuân thủ khi điều trị cho bệnh nhân nữ. Tuy nhiên, có những cân nhắc bổ sung cần được ghi nhớ trong quá trình điều trị. Phụ nữ trên 25 tuổi có xu hướng thất bại trong điều trị cao (Kamangar và Shinkai, 2012). Khoảng 80% phụ nữ thất bại trong nhiều đợt điều trị bằng thuốc kháng sinh toàn thân và khoảng 30% đến 40% thất bại sau một đợt dùng isotretinoin (Blasiak và cộng sự, 2013; Goulden và cộng sự, 1997a, b; Rademaker, 2016). Nghi ngờ về một rối loạn nội tiết tiềm ẩn tăng cao nếu tái phát mụn xuất hiện ngay sau khi điều trị bằng isotretinoin (Lowenstein, 2006).
Điều trị mụn trứng cá trong thời kỳ mang thai và cho con bú
Phụ nữ có khả năng sinh đẻ cũng nên được hỏi về kế hoạch sinh sản của họ, và điều trị phải được điều chỉnh sao cho an toàn, cho dù bệnh nhân đang tích cực cố gắng thụ thai, đang mang thai hay đang cho con bú (Bảng 3). Trong số những thay đổi sinh lý của thai kỳ là sự gia tăng nồng độ androgen trong huyết thanh (Bozzo và cộng sự, 2011), dẫn đến tăng hoạt động của tuyến bã nhờn và mụn trứng cá thường nặng hơn. Thông tin được công bố về tác dụng của thuốc trị mụn đối với thai nhi đang phát triển hoặc trẻ đang bú mẹ là rất hạn chế (Kong và Tey, 2013). Mang thai và cho con bú thường là một phần của tiêu chuẩn loại trừ trong các thử nghiệm lâm sàng; do đó, thông tin có sẵn về khả năng gây quái thai liên quan đến thuốc và ảnh hưởng đến tiết sữa thường được lấy từ các báo cáo trường hợp và nghiên cứu trên động vật.
Bảng 4. Thuật toán điều trị của Nhóm làm việc năm 2016 của Học viện Da liễu Hoa Kỳ để quản lý thanh thiếu niên và thanh niên bị mụn trứng cá
| Nhẹ | Vừa phải | Mạnh | |
| Điều trị lần đầu | BP hoặc retinoid trực tiếp
-hoặc- Liệu pháp kết hợp trực tiếp b (BP + kháng sinh hoặc retinoid + BP hoặc retinoid + BP + kháng sinh) |
Liệu pháp kết hợp trực tiếp b
(BP + kháng sinh hoặc retinoid + BP hoặc retinoid + BP + kháng sinh) – hoặc – Kháng sinh uống + retinoid trực tiếp + BP |
Oral antibiotic + Liệu pháp kết hợp tại chỗ b
(BP + kháng sinh hoặc retinoid + BP hoặc retinoid + BP + kháng sinh) – hoặc – Isotretinoin uống |
| Điều trị thay thế | Thêm retinoid hoặc BP tại chỗ (nếu chưa sẵn sàng)
– hoặc – Cân nhắc retinoid thay thế – hoặc – Cân nhắc sử dụng dapsone tại chỗ |
Kháng sinh uống + retinoid trực tiếp + BP + kháng sinh bôi trực tiếp. Cân nhắc liệu pháp kết hợp thay thế
– hoặc – Cân nhắc thay đổi thuốc kháng sinh uống – hoặc – Kết hợp thuốc tránh thai hoặc spironolactone dạng uống (cho nữ) – hoặc – Cân nhắc uống isotretinoin |
Cân nhắc thay đổi thuốc kháng sinh uống
– hoặc – Kết hợp thuốc tránh thai hoặc spironolactone dạng uống (cho nữ) – hoặc – Cân nhắc uống isotretinoin |
BP, benzoyl peroxide.
a Modified từ Zaenglein et al., 2016, Hình 1.
b Thuốc có thể được kê đơn dưới dạng sản phẩm kết hợp được chế tạo hoặc thành phần riêng biệt
Phân loại thuốc dành cho thai kỳ được sử dụng rộng rãi nhất là hệ thống đánh giá của Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA), phân loại thuốc thành các loại nguy cơ (Bảng 5). Tuy nhiên, hệ thống phân loại này đã bị chỉ trích vì tập trung nhiều vào dữ liệu động vật và thường xuyên phân loại các loại thuốc mới là loại B (an toàn trong thai kỳ; Kong và Tey, 2013) cũng như sự đơn giản quá mức và thiếu thông tin về mức độ nghiêm trọng và bản chất của các phản ứng phụ có thể xảy ra đối với thai nhi (Ủy ban các vấn đề công cộng của Hiệp hội Teratology, 2007). Gần đây hơn, FDA đã phát hành Quy tắc Ghi nhãn Mang thai và Cho con bú, có hiệu lực vào ngày 30 tháng 6 năm 2015.
Bảng 5. Tóm tắt các danh mục của Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ về việc sử dụng thuốc trong thai kỳ
| Mô tả danh mục | |
|
A |
Các nghiên cứu có kiểm soát cho thấy không có rủi ro. Các nghiên cứu đầy đủ, có kiểm soát ở phụ nữ mang thai đã không chứng minh được nguy cơ đối với thai nhi trong bất kỳ ba tháng nào của thai kỳ. |
| B | Không có bằng chứng về rủi ro ở người. Các nghiên cứu đầy đủ, được kiểmsoát tốt ở phụ nữ mang thai không cho thấy tăng nguy cơ bất thường thai nhi mặc dù có các tác dụng phụ ở động vật.
-hoặc- Trong trường hợp không có các nghiên cứu đầy đủ trên người, các nghiên cứu trên động vật cho thấy không có nguy cơ đối với thai nhi. Khả năng gây hại cho thai nhi là xa nhưng vẫn có khả năng xảy ra |
| C | Không thể loại trừ rủi ro. Các nghiên cứu trên người được kiểm soát tốt và đầy đủ còn thiếu và các nghiên cứu trên động vật đã cho thấy có nguy cơ đối với thai nhi hoặc cũng đang thiếu. Có khả năng gây hại cho thai nhi nếu thuốc được sử dụng trong thời kỳ mang thai nhưng lợi ích tiềm ẩn có thể lớn hơn nguy cơ tiềm ẩn |
| D | Bằng chứng tích cực về rủi ro. Các nghiên cứu trên người hoặc dữ liệu điều tra hoặc sau tiếp thị đã chứng minh nguy cơ thai nhi. Tuy nhiên, lợi ích tiềm tàng từ việc sử dụng thuốc có thể nhiều hơn nguy cơ tiềm ẩn. Ví dụ: thuốc có thể được chấp nhận nếu cần trong tình huống đe dọa tính mạng hoặc bệnh nghiêm trọng mà thuốc an toàn hơn không thể được sử dụng hoặc không hiệu quả. |
| X | Chống chỉ định trong thai kỳ. Các nghiên cứu trên động vật hoặc con người hoặccác báo cáo điều tra hoặc sau tiếp thị đã chứng minh bằng chứng tích cực về các bất thường của thai nhi hoặc nguy cơ rõ ràng vượt trội hơn bất kỳ lợi ích nào có thể có cho bệnh nhân |
| N | Không có danh mục mang thai nào được chỉ định |
Thay đổi đáng chú ý nhất là việc bãi bỏ các danh mục ghi nhãn mang thai cho dược phẩm (A, B, C, D và X), được thay thế bằng các bản tóm tắt tường thuật cụ thể cho từng loại thuốc bao gồm “rủi ro khi sử dụng thuốc trong thời kỳ mang thai và cho con bú , thảo luận về dữ liệu hỗ trợ bản tóm tắt đó, và thông tin liên quan để giúp các nhà cung cấp dịch vụ chăm sóc sức khỏe đưa ra quyết định kê đơn và tư vấn cho phụ nữ về việc sử dụng thuốc trong thời kỳ mang thai và cho con bú ”(Danesh và Murase, 2015).
Các hệ thống phân loại nguy cơ được sử dụng phổ biến nhất đối với việc tiết sữa là của Học viện Nhi khoa Hoa Kỳ (AAP), Hale (2010), và Cơ sở dữ liệu về thuốc và cho con bú (LactMed) gần đây do Thư viện Y khoa Quốc gia Hoa Kỳ sản xuất. Đối với mục đích của đánh giá này, hệ thống đánh giá AAP và LactMed sẽ được thảo luận.
Hệ thống AAP phân loại thuốc thành ba loại: những loại thuốc nên được sử dụng một cách thận trọng; những tác dụng chưa biết nhưng có thể đáng quan tâm; và những loại nói chung tương thích với việc cho con bú (Ủy ban về Thuốc của Học viện Nhi khoa Hoa Kỳ, 2001). Hệ thống LactMed là cơ sở dữ liệu được đánh giá ngang hàng cung cấp thông tin toàn diện về các loại thuốc có thể được sử dụng cho các bà mẹ cho con bú bao gồm nồng độ thuốc trong huyết thanh, tác dụng phụ đối với trẻ sơ sinh và các loại thuốc thay thế cần xem xét (Thư viện Y khoa Quốc gia Hoa Kỳ, 2017).
Do thiếu dữ liệu, thiếu phân loại thuốc duy nhất cho phụ nữ mang thai hoặc cho con bú, và nguy cơ sinh quái thai nghiêm trọng, các bác sĩ lâm sàng có xu hướng áp dụng một cách tiếp cận thận trọng để điều trị mụn trứng cá ở nhóm phụ nữ này. Ngoài ra, các bác sĩ chính và bác sĩ da liễu có quan điểm phổ biến rằng mụn trứng cá là một vấn đề thẩm mỹ, điều này khiến các bác sĩ lâm sàng lựa chọn các phương pháp điều trị kém hiệu quả hơn hoặc thậm chí ngừng điều trị trong thời kỳ mang thai và cho con bú (Kong và Tey, 2013).
Liệu pháp bôi trực tiếp
Các liệu pháp tại chỗ được coi là một trong những phương pháp điều trị chính cho những bệnh nhân bị mụn trứng cá nhẹ đến trung bình (Nast và cộng sự, 2012). Các thuốc bôi này có sẵn không kê đơn và theo toa. Gần đây, một số kết hợp trị liệu tại chỗ đã được phát triển để điều trị cho bệnh nhân bị mụn trứng cá.
Sự hấp thụ của các liệu pháp điều trị bôi trực tiếp bị ảnh hưởng bởi nhiều yếu tố, bao gồm lượng chất bôi, diện tích bề mặt bôi thuốc, thời gian bôi thuốc, tần suất bôi thuốc, bôi lên da bị rạn / mòn, lựa chọn phương tiện sử dụng, và độ dày của lớp sừng (Meredith và Ormerod, 2013).
Nói chung, thuốc bôi ngoài da được coi là an toàn hơn thuốc uống để sử dụng cho phụ nữ có thai hoặc đang cho con bú vì tính khả dụng toàn thân của thuốc thấp hơn. Một số loại thuốc bôi thậm chí không có phân loại dành cho thai kỳ vì sự hấp thụ toàn thân thường được coi là tối thiểu trừ khi sử dụng trên diện rộng, chuyên sâu hoặc kéo dài (Meredith và Ormerod, 2013).
Các phương pháp điều trị bôi trực tiếp thường được sử dụng cho bệnh nhân bị mụn trứng cá bao gồm benzoyl peroxide (BP), axit salicylic (SA), thuốc kháng sinh, thuốc kháng sinh kết hợp với BP, thuốc retinoid, retinoid với BP, retinoid với thuốc kháng sinh, axit azelaic và tác nhân sulfone (Zaenglein và cộng sự, 2016).
Benzoyl peroxide (BP)
Benzoyl peroxide thường được sử dụng để điều trị cho bệnh nhân bị mụn trứng cá và có sẵn ở nhiều mức độ mạnh (2,5-10%) và công thức (kem, gel, rửa, tạo bọt, gel nước, để lại và rửa sạch). Benzoyl peroxide là một chất làm tan mụn, tiêu sừng, chống tích tụ có đặc tính kháng khuẩn. Benzoyl peroxide diệt khuẩn chủ yếu chống lại P. acnes bằng cách tạo ra các gốc oxy phản ứng và chưa phát triển tính kháng (Tanghetti, 2008). Việc bổ sung HA vào liệu pháp kháng sinh giúp nâng cao kết quả và có thể làm gia tăng sự phát triển tính kháng kháng sinh (Zaenglein và cộng sự, 2016). HA tại chỗ ở các công thức khác nhau có thể được sử dụng 1 đến 3 lần mỗi ngày.
Việc sử dụng Benzoyl peroxide bị giới hạn bởi kích ứng phụ thuộc vào nồng độ, nhuộm và tẩy trắng vải, và dị ứng tiếp xúc không phổ biến (Zaenglein và cộng sự, 2016). Nồng độ thấp hơn (2,5-5%), gốc nước và chất tẩy rửa có thể được dung nạp tốt hơn ở bệnh nhân da nhạy cảm hơn (Mills et al., 1986; Zaenglein et al., 2016). Một số bác sĩ lâm sàng không muốn kê đơn HA đồng thời với tretinoin tại chỗ do tin rằng HA có thể gây ra quá trình oxy hóa và thoái hóa phân tử tretinoin và do đó làm giảm hiệu quả của nó. Tuy nhiên, sự thoái hóa tretinoin do HA không áp dụng cho tất cả các công thức tretinoin bôi trực tiếp và nhiều nghiên cứu cho thấy sự ổn định của nồng độ tretinoin và tính an toàn khi sử dụng gel tretinoin vi lượng (0.05%) kết hợp với BP (Del Rosso và cộng sự, 2010; Gupta và cộng sự, 2015; Pariser và cộng sự, 2010; Torok và Pillai, 2011).
Salicylic acid (SA)
SA là một chất làm tan mụn có bán không cần kê đơn với nồng độ 0,5 đến 2% và ở cả chế phẩm rửa mặt và bôi ngoài. SA thường được bệnh nhân dung nạp tốt, nhưng khả năng gây mụn trứng cá của nó còn hạn chế (Shalita, 1981, 1989). BP và SA là phương pháp điều trị mụn không kê đơn, tại chỗ, được sử dụng rộng rãi nhất và thường được sử dụng kết hợp. SA có thể được áp dụng 1 đến 3 lần mỗi ngày khi dung nạp. SA có xếp hạng an toàn của FDA là C.
Thuốc kháng sinh bôi trực tiếp
Thuốc kháng sinh tại chỗ được cho là tích tụ trong nang trứng và có thể hoạt động thông qua cả tác dụng kháng vi khuẩn trong cơ thể và kháng thể (Mills và cộng sự, 2002). Do tình trạng kháng thuốc kháng sinh ngày càng gia tăng, không nên dùng đơn trị liệu bằng thuốc kháng sinh tại chỗ trong điều trị mụn trứng cá. Thuốc kháng sinh tại chỗ tốt nhất được sử dụng kết hợp với BP (Zaenglein và cộng sự, 2016). Thuốc kháng sinh tại chỗ chính là clindamycin và erythromycin.
Clindamycin bôi trực tiếp
Clindamycin có sẵn ở dạng gel, kem dưỡng da, thuốc bôi hoặc dung dịch bôi ngoài da và đã được FDA chỉ định loại B. Dung dịch hoặc gel clindamycin 1% hiện là loại thuốc kháng sinh tại chỗ được ưa chuộng (Padilla et al., 1981). Liều lượng được đề nghị là thoa một lớp mỏng mỗi ngày một lần.
Erythromycin bôi trực tiếp
Erythromycin có sẵn dưới dạng gel, dung dịch, thuốc mỡ, thuốc bôi hoặc loãng. Công thức erythromycin uống và bôi tại chỗ đều được xếp vào loại FDA B. Erythromycin bôi trực tiếp ít gây mụn hơn clindamycin vì kháng P. acnes (Becker et al., 1981; Kuhlman và Callen, 1986; Leyden et cộng sự, 1987; Mills và cộng sự, 2002; Shahlita và cộng sự, 1984). Các tác nhân phối hợp fixed ổn định có sẵn với erythromycin 3% cộng với HA 5%, clindamycin 1% cộng với HA 5%, và clindamycin 1% cộng với HA 3,75% (Lookbill và cộng sự, 1997; Pariser và cộng sự, 2014; Tschen và cộng sự. al., 2001). Các tác nhân phối hợp có thể tăng cường sự tuân thủ với các phác đồ điều trị (Zaenglein và cộng sự, 2016). Erythromycin tại chỗ thường được dùng 1 đến 2 lần mỗi ngày.
Thuốc retinoid bôi trực tiếp
Thuốc retinoid tại chỗ là thuốc kê đơn dẫn xuất vitamin A (Bradford và Montes, 1974; Krishnan, 1976; Lucky et al., 1998; Shalita et al., 1999). Thuốc retinoid tại chỗ thường được sử dụng để điều trị đầu tiên cho những bệnh nhân bị mụn trứng cá nhẹ đến trung bình, đặc biệt là khi mụn trứng cá chủ yếu là mụn trứng cá. Liệu pháp retinoid có tác dụng làm tan mụn và giải quyết tổn thương microcomedone tiền thân. Thuốc retinoid cũng có tác dụng chống tái phát và hoạt động kết hợp với các chất bôi ngoài da khác cho tất cả các dạng mụn trứng cá (Zaenglein et al., 2016). Phương pháp điều trị retinoid bôi trực tiếp là phương pháp chính trong việc duy trì độ thanh thải sau khi ngừng điều trị bằng đường uống (Zaenglein và cộng sự, 2016). Liều khuyến cáo là thoa một lớp mỏng mỗi ngày một lần.
Ba loại thuốc retinoid bôi trực tiếp được sử dụng trong điều trị bệnh nhân bị mụn trứng cá: tretinoin (0,025-0,1% trong các loại kem, gel hoặc gel microsphere), adapalene (0,1% kem, gel hoặc lotion và 0,3% gel), và tazarotene (0,05%, 0,1% kem, gel hoặc bọt). Việc sử dụng retinoid bị hạn chế bởi các tác dụng phụ bao gồm khô, bong tróc da, ban đỏ và kích ứng, có thể giảm nhẹ bằng cách giảm lượng sử dụng, tần suất sử dụng và / hoặc sử dụng đồng thời các chất làm mềm (Pedace và Stoughton, 1971). Nói chung, liệu pháp được bắt đầu tốt nhất cách ngày và sau đó tăng lên hàng ngày khi dung nạp được. Số lượng thích hợp để sử dụng (ví dụ, cỡ hạt đậu) cũng rất quan trọng, cũng như đảm bảo phân phối đều với một lớp mỏng và tránh các vùng nhạy cảm (ví dụ: mí mắt, vùng quanh miệng, nếp nhăn mũi và màng nhầy). Với bất kỳ phương pháp điều trị retinoid bôi trực tiếp nào, nồng độ cao hơn sẽ ngon hơn nhưng có tác dụng phụ lớn hơn (Christiansen et al., 1974; Cunliffe et al., 1997; Krishnan, 1976). Ngoài ra, các loại thuốc retinoid bôi ngoài da làm tăng nguy cơ nhạy cảm với ánh sáng, vì vậy nên sử dụng đồng thời kem chống nắng.
Các công thức chung của tretinoin thường không ổn định và nên được áp dụng vào buổi tối. Dùng chung HA với tretinoin cũng dẫn đến oxy hóa và làm mất hoạt tính của tretinoin; do đó, các tác nhân này nên được áp dụng vào các thời điểm khác nhau (tức là HA vào buổi sáng, tretinoin vào ban đêm). Sự hình thành tretinoin vi mô cũng như adapalene và tazarotene không có những hạn chế tương tự.
Các chất kết hợp có sẵn chứa retinoid bao gồm adapalene 0,1% cộng với BP 2,5% và adapalene 0,3% cộng với gel BP 2,5%, được chấp thuận sử dụng cho bệnh nhân trên 9 tuổi. Ngoài ra, clindamycin phosphate 1,2% cộng với gel tretinoin 0,025% được chấp thuận cho bệnh nhân trên 12 tuổi (Dreno và cộng sự, 2014; Zouboulis và cộng sự, 2000).
Có nhiều báo cáo xác thực về tính an toàn của thuốc bôi retinoid ở phụ nữ mang thai hoặc cho con bú. Các trường hợp biệt lập đã được báo cáo về dị tật bẩm sinh liên quan đến thời gian sử dụng các tác nhân này (Autret và cộng sự, 1997; Lipson và cộng sự, 1993; Loureiro và cộng sự, 2005; Navarre- Belhassen và cộng sự, 1998; Panchaud và cộng sự, 2012; Selcen và cộng sự, 2000). Tuy nhiên, một nghiên cứu tiền cứu quan sát lớn trên 235 phụ nữ tiếp xúc với retinoid tại chỗ trong tam cá nguyệt đầu tiên của họ được so sánh với 444 phụ nữ trong nhóm đối chứng và không có sự khác biệt có ý nghĩa thống kê về tỷ lệ sảy thai tự nhiên và dị tật bẩm sinh nhẹ hoặc nặng. phát hiện (Panchaud và cộng sự, 2012). Chưa có sự đồng thuận chính thức về tính an toàn của thuốc bôi retinoid trong thai kỳ (van Hoogdalem, 1998). Ngoài ra, các nhà sản xuất khuyên rằng không nên sử dụng các tác nhân này trong thời kỳ mang thai. Tretinoin và adapalene được FDA xếp vào loại C dành cho thai kỳ nhưng tazarotene là loại X. Bệnh nhân nên được tư vấn về những nguy cơ mang thai này khi bắt đầu điều trị bằng retinoid nếu họ muốn mang thai.
Azelaic acid
Axit azelaic hoạt động như một chất làm tan mụn, kháng khuẩn và chống tiêu chảy (Strauss và cộng sự, 2007) và là một axit dicarboxylic tự nhiên được tìm thấy trong ngũ cốc nguyên hạt như lúa mì, lúa mạch đen và lúa mạch (Frampton và Wagstaff, Năm 2004). Axit azelaic nên được sử dụng thận trọng cho những bệnh nhân có làn da nhạy cảm do các tác dụng phụ bao gồm mẩn đỏ, bỏng rát và kích ứng.
Azelaic acid cũng nên được sử dụng thận trọng ở những bệnh nhân có loại da Fitzpatrick IV trở lên vì tác dụng làm sáng da tiềm ẩn của nó (Cunliffe và Holland, 1989; Katsambas và cộng sự, 1989; Kircik, 2011). Tuy nhiên, do tác dụng phụ này, axit azelaic là một chất hữu ích trong điều trị mụn trứng cá vì nó hỗ trợ trong việc điều trị chứng rối loạn sắc tố sau mụn.
Khuyến cáo về liều lượng là thoa một lượng mỏng lên vùng bị ảnh hưởng hai lần mỗi ngày. Axit azelaic được FDA phân loại là loại B dành cho thai kỳ vì các nghiên cứu trên động vật cho thấy không có khả năng gây quái thai, nhưng dữ liệu trên người không có sẵn.
Dapsone
Dapsone là một tác nhân sulfone có sẵn dưới dạng gel 5% và được sử dụng như một tác nhân hai lần mỗi ngày hoặc gel 7,5% được sử dụng một lần mỗi ngày. Dữ liệu chỉ cho thấy khả năng giảm nhẹ đến trung bình trong việc giảm các tổn thương do mụn trứng cá (Draelos và cộng sự, 2007; Lucky và cộng sự, 2007). Dapsone có cơ chế chưa được hiểu rõ trong việc điều trị bệnh nhân bị mụn trứng cá và khả năng tiêu diệt P. acnes của nó đã được nghiên cứu rất kém (Zaenglein và cộng sự, 2016). Tương tự như các phương pháp điều trị kháng sinh tại chỗ khác, dapsone được cho là hoạt động như một chất chống tích tụ. Liều lượng khuyến nghị là thoa một lớp mỏng hai lần mỗi ngày.
Dapsone nên sử dụng thận trọng khi kết hợp với BP vì việc sử dụng chung có thể gây ra màu da cam nâu có thể đảo ngược, có thể bị cọ hoặc rửa sạch. Sự hấp thu toàn thân của dapsone bôi trực tiếp được cho là rất ít nên không cần thử nghiệm glucose-6-phosphate dehydrogenase ban đầu. Dapsone tại chỗ được xếp vào FDA thai kỳ loại C.
Các chất bôi khác
Các thuốc bôi sau đây thiếu dữ liệu dựa trên bằng chứng về việc sử dụng chúng cho bệnh nhân bị mụn trứng cá nhưng đã được chứng minh là có hiệu quả trong thực hành lâm sàng: natri sulfacetamide (Lebrun, 2004; Tarimci và cộng sự, 1997; Thiboutot, 2000), lưu huỳnh (Elstein, 1981), resorcinol (Elstein, 1981), nhôm clorua (Hjorth và cộng sự, 1985; Hurley và Shelley, 1978), kẽm bôi (Bojar và cộng sự, 1994; Cochran và cộng sự, 1985), và niacinamide (Khodaeiani và cộng sự, 2013; Shalita và cộng sự, 1995).
Thuốc kháng sinh dùng để uống.
Thuốc kháng sinh đường uống thường được kê đơn như liệu pháp thứ hai cho những bệnh nhân bị mụn trứng cá nhẹ đến trung bình không được kiểm soát đầy đủ chỉ bằng các thuốc bôi ngoài da và là phương pháp điều trị mụn trứng cá chính ở những bệnh nhân bị mụn trứng cá ở giai đoạn trung bình đến nặng. Thuốc kháng sinh dùng để uống nên được sử dụng kết hợp với retinoid bôi trực tiếp và HA nếu được dung nạp (Gold et al., 2010; Tan et al., 2014; (Zaenglein et al., 2013). Do tình trạng kháng thuốc kháng sinh ngày càng gia tăng, việc đơn trị liệu với các loại thuốc uống bổ sung sinh học thực sự không được khuyến khích (Moon et al., 2012; Zaenglein et al., 2016). Trung tâm Kiểm soát và Dự báo Dịch bệnh đã nhấn mạnh việc quản lý kháng sinh và hạn chế sử dụng kháng sinh trong thời gian ngắn nhất có thể, lý tưởng là 3-4 tháng (Zaenglein và cộng sự, 2016), để giảm nguy cơ kháng thuốc. Sử dụng đồng thời và tiếp tục với sự kết hợp retinoid hoặc retinoid / BP có thể giúp cai sữa kháng sinh toàn thân (Gold và cộng sự, 2010; Leyden và cộng sự, 2006; Poulin và cộng sự, 2011; Tan và cộng sự, 2012; Thiboutot và cộng sự, 2006).
Hạn chế sử dụng kháng sinh toàn thân cũng có thể làm giảm nguy cơ mắc bệnh đường ruột (đối với tetracyclines; Margolis và cộng sự, 2010), viêm họng (đối với tetracyclines; Margolis và cộng sự, 2012), C. dif cile infecon (Bartlett và cộng sự ., 1978; Carroll và Bartlett, 2011), và viêm âm hộ do nấm candida; tuy nhiên, các nghiên cứu đã chỉ ra rằng các mối liên quan này còn hạn chế. Penicillin, erythromycin và cephalosporin được cho là có tác dụng an toàn tốt nhất khi mang thai (Hernandez-Diaz và cộng sự, 2000).
Đáng lưu ý, có ít bằng chứng về việc sử dụng các thuốc kháng sinh và tác động tiềm tàng đến hiệu quả của thuốc uống tránh thai (Hoffmann và cộng sự, 2015). Mặc dù một nghiên cứu dịch tễ học lớn được thực hiện ở Hoa Kỳ cho thấy không có mối liên hệ nào giữa việc sử dụng kháng sinh đồng thời và nguy cơ mang thai ngoài ý muốn ở những người sử dụng thuốc viên tránh thai (Guengerich, 1990), các nghiên cứu khác đã chỉ ra mối quan hệ tiềm tàng (Back et al ., 1980; Bainton, 1986; Fazio, 1991; Skolnick và cộng sự, 1976).
Có ba loại tác nhân kháng sinh bao gồm những loại có khả năng làm giảm hiệu quả của OCP (rifampin), những loại có liên quan đến thất bại OCP trong ba trường hợp được báo cáo trở lên (ampicillin, amoxicillin, metronidazole và tetracycline), và những có liên quan đến thất bại OCP trong ít nhất một báo cáo trường hợp (cephalexin, clindamycin, dapsone, erythromycin, griseofulvin, isonia-zid, phenoxymethylpenicillin, talampicillin, và trimethoprim; Miller và cộng sự, 1994). Một cách tiếp cận thận trọng là khuyến cáo sử dụng hình thức tránh thai thứ hai trong khi dùng thuốc kháng sinh dùng để uống (Zhanel và cộng sự, 1999), nhưng bằng chứng cho điều này là rất hạn chế (Miller và cộng sự, 1994).
Tetracycline
Tetracycline các phương pháp điều trị, bao gồm minocycline, doxycycline và tetracycline, được coi là liệu pháp đầu tiên ở những bệnh nhân bị mụn trứng cá từ mức độ trung bình đến nặng ngoại trừ một số trường hợp nhất định bao gồm mang thai, 8 tuổi hoặc dị ứng đã biết. Các tác nhân tetracy-cline có tác dụng chống lại sự biến đổi đáng chú ý (Zaenglein và cộng sự, 2016). Pseudotumor cerebri là một hiện tượng hiếm gặp có liên quan đến việc sử dụng các tác nhân tetracycline (Zaenglein và cộng sự, 2016).
Thuốc tetracycline bao gồm minocycline và doxycycline được FDA xếp vào loại thuốc dành cho thai kỳ D. Không nên sử dụng Tetracycline trong thời kỳ mang thai vì sử dụng trong ba tháng thứ hai và thứ ba được biết là gây đổi màu răng và xương. Tuy nhiên, không có bằng chứng xác thực rằng việc sử dụng thuốc trong ba tháng đầu thai kỳ có liên quan đến các dị tật bẩm sinh lớn (Kong và Tey, 2013; Meredith và Ormerod, 2013). Các trường hợp nhiễm độc gan ở người mẹ liên quan đến việc sử dụng các tác nhân tetracycline trong tam cá nguyệt thứ ba đã được báo cáo (Hale và Pomeranz, 2002; Rothman và Pochi, 1988; Wenk và cộng sự, 1981).
Mặc dù về lý thuyết có nguy cơ dị dạng xương và răng nếu dùng tetracyclin trong thời kỳ cho con bú, nhưng nồng độ hấp thu ở trẻ sơ sinh thấp vì liên kết mạnh với các ion canxi trong sữa mẹ. Tetra- cycline thường được coi là an toàn để sử dụng trong thời kỳ cho con bú (Spencer et al., 2001).
Doxycycline
Doxycycline dường như có hiệu quả đối với bệnh nhân mụn trứng cá trong khoảng liều 1,7 đến 2,4 mg/kg (Leyden và cộng sự, 2013), nhưng đối với các mục đích thực tế, doxycycline thường được dùng với liều 50 đến 100 mg hai lần mỗi ngày cho bệnh nhân người lớn bị mụn trứng cá. Liều lượng kháng sinh của doxycy-cline (tức là 20 mg x 2 lần / ngày hoặc 40 mg / ngày) cũng có hiệu quả ở những bệnh nhân bị mụn trứng cá ở mức độ trung bình (Moore et al., 2015; Toossi et al., 2008), hỗ trợ thêm cho việc kháng tetracycline tính chất.
Các vấn đề cần xem xét khi kê đơn doxycycline bao gồm thực tế là doxycycline nhạy cảm với ánh sáng hơn minocycline (Zaenglein và cộng sự, 2016) và thường liên quan đến rối loạn dạ dày, đặc biệt là ở liều cao hơn (Leyden và cộng sự, 2013). Để giảm thiểu những tác dụng phụ này, bệnh nhân nên được tư vấn sử dụng kem chống nắng và các biện pháp bảo vệ ánh sáng khác để giảm nguy cơ cháy nắng, uống doxycycline trong bữa ăn hoặc một cốc nước đầy, và không dùng doxycycline ít hơn 1 giờ trước khi đi ngủ. Ngoài ra, sự hấp thu bị giảm khi tiêu thụ đồng thời sắt và canxi. Phiên bản hyclate của doxycycline có xu hướng có tác dụng phụ trên đường tiêu hóa nhiều hơn so với dạng monohydrat. Doxycycline được chuyển hóa chủ yếu qua gan và có thể được sử dụng an toàn ở hầu hết bệnh nhân bị bệnh thận (Zaenglein và cộng sự, 2016).
Minocycline
Trước đây, điều trị bằng minocycline được cho là có hiệu quả tốt hơn doxycycline trong việc giảm vi khuẩn P. acnes (Strauss và cộng sự, 2007). Tuy nhiên, một đánh giá gần đây của Cochrane cho thấy minocycline có hiệu quả điều trị bệnh nhân AV nhưng không vượt trội so với các thuốc kháng sinh khác (Garner và cộng sự, 2012). Minocycline đã được chứng minh là an toàn và hiệu quả ở liều 1 mg / kg, nhưng không thấy phản ứng với liều đối với efficacy (Fleischer et al., 2006; Zaenglein et al., 2016). Đối với các mục đích thực tế, minocycline thường được dùng ở liều 50 đến 100 mg hai lần mỗi ngày.
So với doxycycline, minocycline có xu hướng có tỷ lệ tác dụng phụ trên đường tiêu hóa thấp hơn nhưng có liên quan đến ù tai, chóng mặt và lắng đọng sắc tố trong da, niêm mạc và răng. Sắc tố liên quan đến Minocycline phổ biến hơn ở những bệnh nhân dùng liều cao hơn trong thời gian dài (Zaenglein và cộng sự, 2016). Các biến cố hiếm gặp, nghiêm trọng, qua trung gian miễn dịch cũng có liên quan đến minocycline bao gồm hội chứng quá mẫn do thuốc hoặc phản ứng thuốc với tăng bạch cầu ái toan và các triệu chứng toàn thân, lupus do thuốc và các phản ứng quá mẫn khác (Kermani và cộng sự, 2012; Shaughnessy và cộng sự ., 2010; Smith và Leyden, 2005; Tripathi và cộng sự, 2013; Weinstein và cộng sự, 2013).
Macrolides
Thuốc macrolide bao gồm erythromycin và azithromycin đã được sử dụng để điều trị cho bệnh nhân bị mụn trứng cá nhưng gần đây đã không còn được ưa chuộng như phương pháp điều trị đầu tiên. Thuốc macrolide được coi là liệu pháp thay thế khi không thể sử dụng thuốc kháng sinh truyền thống. Cũng như tetracycline, macrolide có một số đặc tính chống kích ứng nhưng cơ chế hoạt động cụ thể trong mụn trứng cá vẫn chưa được biết rõ.
Tác dụng phụ thường gặp nhất là rối loạn tiêu hóa (Zaenglein và cộng sự, 2016). Thuốc macrolid đôi khi có thể gây ra bất thường dẫn truyền tim và hiếm khi gây độc cho gan (Zaenglein và cộng sự, 2016). Các tác nhân macrolide asa đã được AAP phân loại là an toàn trong thời kỳ cho con bú (Kong và Tey, 2013).
Erythromycin
Erythromycin là thuốc kháng sinh uống truyền thống được lựa chọn khi cần điều trị kháng sinh dùng để uống đối với mụn trứng cá khi bệnh nhân đang mang thai (Hale và Pomeranz, 2002; Koren và cộng sự, 1998). Do sự đề kháng của vi khuẩn ngày càng tăng, nên kết hợp erythromycin với một chế phẩm bôi tại chỗ như Benzoyl peroxide (Meredith và Ormerod, 2013). Do sự khác biệt về khả năng hấp thu, 400 mg erythromycin ethyl succinate tạo ra cùng nồng độ huyết thanh với 250mg erythromycin base hoặc stearat. Đối với cơ sở erythromycin, liều lượng dao động từ 250 đến 500 mg x 2 lần / ngày. Đối với erythromycin ethyl succinate, liều lượng dao động từ 400 đến 800 mg x 2 lần / ngày.
Erythromycin đường uống được FDA xếp vào loại B. Erythromycin được sử dụng phổ biến hơn trong thời kỳ mang thai để điều trị các bệnh nhiễm trùng khác, dẫn đến các nghiên cứu hồi cứu lớn hơn về kết quả mang thai (Romoren và cộng sự, 2012). Mặc dù, erythromycin phần lớn được coi là an toàn để sử dụng trong thai kỳ, các báo cáo về dị tật tim thai vẫn tồn tại (Kallen và cộng sự, 2005) và việc sử dụng kéo dài có liên quan đến độc tính trên gan ở 10-15% bệnh nhân mang thai (Hale và Pomeranz, 2002; McCormack et al., 1977).
Azithromycin
Azithromycin là một chất kháng sinh nhóm azalide có nguồn gốc từ erythromycin (Meredith và Ormerod, 2013) và có xu hướng được dung nạp tốt hơn so với erythromycin (Kong và Tey, 2013). Azithromycin đã được nghiên cứu với các liều lượng khác nhau (từ 3 lần một tuần đến 4 ngày một tháng) với hiệu suất khác nhau ở bệnh nhân AV và tất cả các thử nghiệm đều sử dụng phác đồ điều trị theo nhịp (Antonio et al., 2008; Basta-Juzbasic et al., 2007 ; Innocenzi và cộng sự, 2008; Kus và cộng sự, 2005; Maleszka và cộng sự, 2011; Parsad và cộng sự, 2001; Ra fi ei và Yaghoobi, 2006; Zaenglein và cộng sự, 2016).
Liều thử nghiệm bao gồm 500 mg một lần mỗi ngày trong 4 ngày liên tục mỗi tháng trong 2 tháng liên tiếp (Babaeinejad và cộng sự, 2011; Parsad và cộng sự, 2001), 500 mg một lần mỗi ngày trong 3 ngày trong tuần đầu tiên, sau đó là 500 mg một lần hàng tuần cho đến tuần thứ 10 (Maleszka và cộng sự, 2011), hoặc 500 mg một lần mỗi ngày trong 3 ngày liên tiếp mỗi tuần trong tháng 1, tiếp theo là 500 mg một lần mỗi ngày trong 2 ngày liên tiếp mỗi tuần trong tháng 2 và sau đó 500 mg một lần mỗi ngày trong 1 ngày mỗi tuần trong tháng 3 (Kus và cộng sự, 2005). Một nghiên cứu từ năm 2005 cho thấy azithromycin có hiệu quả điều trị bệnh nhân AV như doxycycline (Kus và cộng sự, 2005). Một thử nghiệm đối chứng, ngẫu nhiên gần đây hơn so sánh điều trị bằng azithromycin 3 ngày mỗi tháng với doxycycline hàng ngày cho thấy tính ưu việt của doxycycline (Ullah và cộng sự, 2014). Cũng như erythromycin, azithromycin được xếp vào loại B thai kỳ của FDA.
Trimethoprim sulfamethoxazole
Trimethoprim sulfamethoxazole (TMP/SMX) có thể được sử dụng để điều trị bệnh nhân bị mụn trứng cá bị kích ứng với macrolide và tetracycline. Điều trị bằng TMP / SMX và trimethoprim phát sinh nhiều rủi ro nghiêm trọng và được sử dụng cho các rối loạn nhiễm trùng khác, làm cho nguy cơ tăng tình trạng kháng thuốc trở nên nghiêm trọng hơn. Mặc dù một số trường hợp cho thấy hiệu quả của TMP / SMX trong điều trị bệnh nhân bị mụn trứng cá, một nghiên cứu có so sánh với đối chứng cho thấy TMP / SMX có hiệu quả tương đương với điều trị bằng oxytetracycline (Jen, 1980).
Các tác dụng phụ của TMP / SMX bao gồm rối loạn tiêu hóa, nhạy cảm với ánh sáng và bùng phát thuốc, trong đó nghiêm trọng nhất là hội chứng Stevens-Johnson / nhiễm độc gây hoại tử biểu bì (Firoz và cộng sự, 2012; Roujeau và cộng sự, 1995). Các đợt bùng phát mụn nghiêm trọng bao gồm hội chứng Stevens-Johnson / nhiễm độc gây hoại tử biểu bì thường phổ biến hơn ở các bệnh nhân HIV.
Hiếm khi, TMP / SMX có thể gây rối loạn chức năng máu nghiêm trọng như mất bạch cầu hạt, thiếu máu và giảm tiểu cầu, đặc biệt nếu được thực hiện như một liệu pháp lâu dài, cần đảm bảo theo dõi định kỳ với các xét nghiệm công thức máu để kiểm tra số lượng các tế bào máu (Zaenglein và cộng sự, 2016).
Theo nhóm công tác AAD, TMP / SMX nên được hạn chế ở những bệnh nhân không dung nạp được kháng sinh tetracycline hoặc những bệnh nhân kháng điều trị (Zaenglein và cộng sự, 2016). Liều thông thường cho bệnh nhân mụn trứng cá là loại thuốc có liều lượng tăng gấp đôi, sử dụng hai lần mỗi ngày.
TMPS / SMX được phân loại bởi FDA (thuộc nhóm C cho thai kỳ) . Việc sử dụng TMP / SMX trong ba tháng đầu của thai kỳ có thể dẫn đến thiếu hụt axit folic, do đó có thể dẫn đến dị tật ống thần kinh, dị dạng cấu trúc của hệ thống tim mạch và tiết niệu và sứt môi hoặc hở vòm miệng (Ho và Juurlink, 2011). Những nguy cơ này tăng lên ở những phụ nữ không sử dụng vitamin tổng hợp có chứa axit folic (Hernandez-Diaz và cộng sự, 2000).
Ngoài ra, nếu sử dụng thuốc trong ba tháng cuối của thai kỳ sẽ gây tăng bilirubin trong máu (Ho và Juurlink, 2011). Cả 2 cơ sở y tế là AAP và LactMed đều đánh giá TMP / SMX an toàn để sử dụng trong thời kỳ cho con bú ngoại trừ trường hợp trẻ sinh non, bị vàng da nặng hoặc mắc bệnh G6PD và có nguy cơ cao bị tổn thương não do vàng da nặng (kernicterus) (Kong và Tey, 2013).
Penicillin và cephalosporin
Penicillin và cephalosporin được chứng minh là an toàn để sử dụng trong thời kỳ mang thai và cho con bú (Hale và Pomeranz, 2002). Tuy nhiên, chúng hiếm khi được sử dụng để điều trị cho bệnh nhân bị mụn trứng cá vì thông tin về hiệu quả điều trị rất ít. Penicillin và cephalosporin có thể được sử dụng thay thế cho các loại thuốc kháng sinh thông thường, đặc biệt là trong thời kỳ mang thai hoặc khi bị dị ứng với các loại thuốc điều trị có chứa kháng sinh khác (Zaenglein và cộng sự, 2016). Các tác dụng phụ bao gồm nguy cơ gây hội chứng quá mẫn cảm, từ shock phản vệ tới rối loạn tiêu hóa (buồn nôn, tiêu chảy, chướng bụng và khó chịu; Zaenglein và cộng sự, 2016). Liều khuyến cáo cho amoxicillin là 250 mg x 2 lần / ngày đến 500 mg x 3 lần / ngày.
Cephalosporin có hoạt tính chống lại vi khuẩn P. acnes ở thử nghiệm trong phòng thí nghiệm (in vitro), nhưng cephalosporin thuộc loại ưa nước (chỉ phát huy tác dụng trong điều kiện có nước) nên được cho là kém hiệu quả với dạng tiền thân của mụn trứng cá nằm dưới da (microcomedones) khi thử nghiệm trên người và động vật (in vivo) (Mays et al., 2012). Một nghiên cứu hồi cứu trên 93 bệnh nhân cho thấy cephalexin có hiệu quả điều trị bệnh nhân bị mụn; 78% bệnh nhân được cải thiện lâm sàng với chế độ dùng liều 500 mg x 2 lần / ngày (Fenner và cộng sự, 2008).
Isotretinoin
Isotretionoin là một lựa chọn điều trị không kháng sinh và không kháng khuẩn quan trọng cho phụ nữ trưởng thành bị mụn trứng cá (Gollnick et al., 2003). Isotretinoin đường uống được FDA chấp thuận để điều trị mụn trứng cá tái phát nặng nhưng cũng có thể được sử dụng để điều trị cho những bệnh nhân bị mụn trứng cá vừa kháng điều trị hoặc tái phát nhanh chóng sau khi ngừng điều trị bằng kháng sinh đường uống (Agarwal, et al., 2011; Akman và cộng sự, 2007; Borghi và cộng sự, 2011; Choi và cộng sự, 2011a, b; Kaymak và Ilter, 2006; Lee và cộng sự, 2011). Một số nghiên cứu đã chỉ ra rằng isotretinoin làm giảm hiệu quả sản xuất bã nhờn, số lượng tổn thương do mụn trứng cá và sẹo mụn trứng cá (Amichai và cộng sự, 2006; Chivot và Midoun, 1990; Goldstein và cộng sự, 1982; Goulden và cộng sự, 1997a, b; Jones và cộng sự, 1983; King và cộng sự, 1982; Layton và cộng sự, 1993; Lehucher- Ceyrac và Weber-Buisset, 1993; Lester và cộng sự, 1985; Peck và cộng sự, 1982; Rubinow và cộng sự, 1987; Stainforth và cộng sự, 1993; Strauss và Stranieri, 1982, Strauss và cộng sự, 1984). Theo nhóm làm việc của AAD, isotretinoin cũng được chỉ định để điều trị cho những bệnh nhân bị mụn trứng cá ở mức độ trung bình, kháng điều trị hoặc tạo ra sẹo thực thể hoặc khó chịu về tâm lý xã hội (Zaenglein và cộng sự, 2016).
Isotretinoin thường được dùng với liều khởi đầu 0,5 mg / kg / ngày trong tháng đầu tiên và sau đó tăng lên 1 mg / kg / ngày khi dung nạp được với mục tiêu là liều tích lũy từ 120 đến 150 mg / kg (Goldsmith et al. ., 2004; Layton và cộng sự, 1993; Lehucher-Ceyrac và cộng sự, 1999). Trong những trường hợp rất nặng, có thể cần dùng liều ban đầu thấp hơn ngoài thuốc uống corticosteroid. Tuy nhiên, nhiều nghiên cứu gần đây đã chứng minh rằng liều tích lũy cao hơn vượt quá 200 mg / kg có thể hiệu quả hơn để giảm tỷ lệ tái phát và tái phát mụn trứng cá (Coloe et al., 2011; Zeitany et al., 2016).
Liệu pháp retinoid toàn thân và do đó dẫn đến cải thiện khả năng dung nạp và tăng sự hài lòng của bệnh nhân (Agarwal et al. ., 2011; Akman và cộng sự, 2007; Amichai và cộng sự, 2006; Choi và cộng sự, 2011a, b; De và Kanwar, 2011; Lee và cộng sự, 2010; Rademaker, 2010). Tuy nhiên, dùng thuốc ngắt quãng không hiệu quả bằng dùng hàng ngày và cho thấy tỷ lệ tái phát cao hơn (Agarwal, et al., 2011; Akman et al., 2007; Choi et al., 2011a, b; King et al., 1982). Sự hấp thụ isotretinoin tăng lên khi thực phẩm béo và isotretinoin được khuyến cáo nên dùng trong bữa ăn (Strauss et al., 2001; Webster et al., 2013). Công thức lidose (Absorica) có tác dụng hấp thu không phụ thuộc vào lượng chất béo.
Khi điều trị cho phụ nữ trưởng thành, nên xem xét nghiêm túc khả năng gây quái thai của isotretinoin. Ngoài ra, có rất nhiều tác dụng phụ, bao gồm bệnh xơ cứng, viêm môi, bệnh mỡ máu, giảm thị lực ban đêm, thay đổi thị lực, nhức đầu, nhiễm độc gan, tăng triglycerid máu, thay đổi tâm trạng, khử khoáng xương, các yếu tố nguy cơ tim mạch, có thể liên quan đến trầm cảm / lo lắng / thay đổi tâm trạng / tự tử, và có thể liên quan đến bệnh đại tràng (IBD). Đối với mối liên quan của isotretinon với IBD, quan điểm của AAD là “bằng chứng hiện tại là không đủ để chứng minh mối liên hệ nhân quả giữa việc sử dụng isotretinoin và IBD” (Zaenglein và cộng sự, 2016). Các tác dụng phụ phổ biến nhất của isotretinoin bắt chước các triệu chứng của chứng tăng vitamin A (Zaenglein và cộng sự, 2016). Với liều lượng tiêu chuẩn, những tác dụng phụ này sẽ giải quyết sau khi ngừng điều trị (Zaenglein và cộng sự, 2016).
Dữ liệu liên quan đến mối liên hệ dựa trên bằng chứng giữa isotretinoin và trầm cảm, lo lắng, thay đổi tâm trạng hoặc ý định tự sát / tự sát là hỗn hợp. Mặc dù nhiều báo cáo và loạt trường hợp nhỏ cho thấy isotretinoin không có tác động tiêu cực đến tâm trạng, trí nhớ, sự chú ý hoặc chức năng điều hành (Alhusayen và cộng sự, 2013; Bozdag và cộng sự, 2009; Chia và cộng sự, 2005; Cohen và cộng sự. , 2007; Etminan và cộng sự, 2013; Hull và cộng sự, 1991; Jick và cộng sự, 2000; Kaymak và Ilter, 2006; Marqueling và Zane, 2007; Nevoralova và Dvorakova, 2013; Ormerod và cộng sự, 2012; Rashtak et al., 2014; Rehn et al., 2009; Rubinow et al., 1987; Zaenglein et al., 2016), FDA đã trình bày 40 trường hợp cho thấy isotretinoin dechallenge và rechallenge có liên quan đến các triệu chứng tâm thần (US Food và Cục Quản lý Dược, 2003). Trong loạt trường hợp của FDA, bệnh nhân hồi phục sau khi ngừng sử dụng isotretinoin và tái phát các triệu chứng sau khi bắt đầu lại isotretinoin. Trong số những bệnh nhân này, 75% không có tiền sử tâm thần trước khi điều trị bằng isotreti-noin và thời gian trung bình để hồi phục sau khi ngừng dùng isotretinoin là 4,5 ngày, phù hợp với thời gian bán thải của isotretinoin và các chất chuyển hóa của nó. Khi bệnh nhân được trấn an lại, thời gian khởi phát các triệu chứng tâm thần trung bình ngắn hơn, và 10 bệnh nhân có các triệu chứng tâm thần dai dẳng sau khi ngừng sử dụng isotretinoin. Tính đến ngày 31 tháng 12 năm 2001, 140 người dùng isotretinoin trên toàn thế giới đã tự tử khi đang dùng isotretinoin hoặc trong vòng vài tháng sau khi ngừng điều trị và 257 bệnh nhân khác đã phải nhập viện vì trầm cảm nặng hoặc cố gắng tự tử (Duenwald, 2002). Tuy nhiên, một số người cho rằng số trường hợp trầm cảm được báo cáo ở những người sử dụng isotretinoin không lớn hơn trong dân số chung (Lamberg, 1998). Nhóm công tác AAD khuyến cáo rằng các bác sĩ kê đơn nên theo dõi bệnh nhân xem có bất kỳ dấu hiệu nào của các triệu chứng trầm cảm và giáo dục bệnh nhân về những nguy cơ tiềm ẩn khi điều trị bằng isotretinoin.
Việc theo dõi kết quả xét nghiệm trong phòng thí nghiệm đối với bệnh nhân dùng isotretinoin rất khác nhau giữa các bác sĩ. Cholesterol, triglycerid và transaminase huyết thanh được biết là tăng ở một số bệnh nhân dùng isotretinoin đường uống (Bershad và cộng sự, 1985; De Marchi và cộng sự, 2006; Zech và cộng sự, 1983).
Có thể sử dụng isotretinoin liều thấp (0,25-0,4 mg / kg / ngày) và chế độ liều tích hợp thấp hơn để giảm thiểu các tác dụng phụ liên quan đến.
Theo dõi thường quy các nghiên cứu về nguy cơ tăng mỡ máu và chức năng gan được khuyến cáo thực hiện thường xuyên nhưng giữa các giá trị khác nhau (Bershad và cộng sự, 1985; Lammer và cộng sự, 1985; Leachman và cộng sự, 1999; McElwee và cộng sự, 1991 ; Zech và cộng sự, 1983). Một số học viên theo dõi kết quả xét nghiệm trong phòng thí nghiệm hàng tháng, nhưng những người khác chỉ kiểm tra lúc ban đầu và sau khi thay đổi liều lượng.
Hansen và cộng sự. (2016) khuyến cáo rằng ở những bệnh nhân khỏe mạnh với bảng lipid cơ bản bình thường và kết quả xét nghiệm chức năng gan, các nghiên cứu lặp lại nên được thực hiện sau 2 tháng điều trị bằng isotretinoin. Nếu kết quả bình thường, không cần thử nghiệm thêm. Nhóm làm việc của AAD đã không đưa ra bất kỳ lý do dựa trên bằng chứng nào để đảm bảo theo dõi thường xuyên số lượng tế bào máu hoàn chỉnh (Zaenglein và cộng sự, 2016). Cần thử thai đối với bệnh nhân nữ có khả năng sinh con ở thời điểm ban đầu, hàng tháng trong thời gian điều trị và 1 tháng sau khi hoàn thành điều trị bằng isotretinoin.
Việc sử dụng isotretinoin đường uống trong thời kỳ mang thai là hoàn toàn chống chỉ định (loại X dành cho thai kỳ của FDA) do khả năng gây dị tật nghiêm trọng bao gồm dị tật xương sọ, mặt, tim và tuyến ức (Lammer et al., 1985). Do những ảnh hưởng nghiêm trọng này, các nhà sản xuất thuốc uống isotretinoin đã phát triển các chương trình phòng ngừa mang thai,tốt nhất là hai hình thức tránh thai được khuyến cáo (Good Field et al., 2010). Hiện tại, Hoa Kỳ và Vương quốc Anh yêu cầu đăng ký tham gia các chương trình ngừa thai này để nhận isotretinoin đường uống.
Tại Hoa Kỳ, FDA đã thành lập chương trình iPLEDGE vào năm 2006. Các bác sĩ da liễu nên khuyên phụ nữ rằng họ không nên mang thai 1 tháng trước hoặc trong vòng 1 tháng sau khi hoàn thành liệu pháp isotretinoin. Tuy nhiên, trong một nghiên cứu khảo sát gần đây về những phụ nữ hoạt động tình dục trong thời gian điều trị bằng isotretinoin, 29% thừa nhận không tuân thủ các yêu cầu ngừa thai của iPLEDGE (Collins và cộng sự, 2014).
Các liệu pháp khác và bổ trợ
Các liệu pháp sau đây có bằng chứng hạn chế về tính hiệu quả của chúng trong điều trị bệnh nhân mụn trứng cá. Tuy nhiên, những phương pháp điều trị này có thể cải thiện ngoại hình của bệnh nhân và hữu ích như một phần của phác đồ điều trị mụn trứng cá tổng thể. Một số phương pháp này cũng có thể hữu ích để điều trị sẹo mụn. Các phương pháp điều trị này bao gồm chiết xuất mụn trứng cá (Meredith và Ormerod, 2013; Zaenglein và cộng sự, 2016), liệu pháp áp lạnh (Fox và cộng sự, 2016), đốt điện (Fox và cộng sự, 2016), lột da bằng hóa chất (Dreno và cộng sự, 2011; Grover và Reddu, 2003; Ilknur và cộng sự, 2010; Kempiak và Uebelhoer, 2008; Levesque và cộng sự, 2011; Meredith và Ormerod, 2013; Ramos-e-Silva và cộng sự, 2015; Zaenglein và cộng sự, 2016; bao gồm axit glycolic Atzori và cộng sự, 1999; Grover và Reddu, 2003; Ilknur và cộng sự, 2010, SA Levesque và cộng sự, 2011, và axit retinoic Ramos-e-Silva và cộng sự, 2015), mài da vi mô (Karimipour và cộng sự cộng sự, 2010; Kempiak và Uebelhoer, 2008; Lloyd, 2001; Ramos-e-Silva và cộng sự, 2015; Tan và cộng sự, 2001), điều trị bằng laser (Zaenglein và cộng sự, 2016; bao gồm thuốc nhuộm xung, kali titanyl phốt phát, CO2 phân đoạn, hồng ngoại phân đoạn và không phân đoạn, tần số vô tuyến và ánh sáng xung cường độ cao), liệu pháp quang động (Barbaric và cộng sự, 2016; Gold và cộng sự, 2004; Kong và Tey, 2013; Ma và cộng sự, 2013; Nast và cộng sự, 2012; P ollock và cộng sự, 2004; Ross, 2005; Sakamoto và cộng sự, 2010; Wang và cộng sự, 2010; Zaenglein và cộng sự, 2016 bao gồm đèn chiếu ánh sáng tím xanh và đèn chiếu ánh sáng đỏ), đèn chiếu tia cực tím B (UVB) (Meredith và Ormerod, 2013; Ross, 2005; Zeichner, 2011), triamcinolone acetonide dùng trong miệng (Levine và Rasmussen, 1983; Potter, 1971), kỹ thuật phẫu thuật (Jacob và cộng sự, 2001; Ramos-e-Silva và cộng sự, 2015; Sanchez Viera, 2015 bao gồm cắt lỗ và cắt bao quy đầu), và phẫu thuật (Jacob và cộng sự, 2001; Sanchez Viera, 2015).
Các liệu pháp bổ sung và thay thế
Nhiều bệnh nhân muốn sử dụng các phương pháp điều trị tự nhiên hơn và có thể tìm đến thảo dược và các chất thay thế để điều trị. Mặc dù hầu hết các tác nhân này thường được dung nạp tốt, nhưng có rất ít dữ liệu liên quan đến khả năng bảo vệ và an toàn. Ngoài ra, các thành phần cụ thể, nồng độ và khả năng tạp nhiễm với các hóa chất không mong muốn khác không được quản lý tốt và đôi khi không thể xác định được. Các liệu pháp bổ sung và thay thế này bao gồm dầu cây trà (Bassett và cộng sự, 1990; Bowe và Shalita, 2008; Enshaieh và cộng sự, 2007; Hammer, 2015; Sharquie và cộng sự, 2006), niacinamide (Draelos và cộng sự, 2006 ; Fox et al., 2016; Gehring, 2004; Namazi, 2007), ayurvedic com- pounds (Lalla et al., 2001; Paranjpe and Kulkarni, 1995), barberry extract (Fouladi, 2012), gluconolactone (Hunt and Barnetson, 1992), các chất chống oxy hóa (Sardana và Garg, 2010), kẽm (Dreno và Blouin, 2008; Gupta và cộng sự, 2014; Meredith và Ormerod, 2013; Nast và cộng sự, 2012; Sardana và Garg, 2010; Strauss và cộng sự ., 2007), xử lý probiotic (Jung và cộng sự, 2013), dầu fi sh (Khayef và cộng sự, 2012), trà xanh (Bò tót và Agnihotri, 2014; Mahmood và cộng sự, 2010; Zaveri, 2006), dầu húng quế (da Silva et al., 2012), dầu copaiba (da Silva et al., 2012), khoáng chất (Gupta et al., 2014; Ma’or et al., 2006; Park et al., 2009), resveratrol (Docherty và cộng sự, 2007; Fabbrocini và cộng sự, 2011; Simonart, 2012), nước hoa hồng (rosa damascena; H ajhashemi và cộng sự, 2010), rong biển (Capitanio và cộng sự, 2012; Choi và cộng sự, 2011a, b), taurine bromamine (Marcinkiewicz, 2010; Marcinkiewicz và cộng sự, 2006, 2008), chế độ ăn kiêng (Adebamowo và cộng sự, 2005, 2006; Bhate và Williams, 2013; Di Landro và cộng sự. , 2012; Ismail và cộng sự, 2012; Strauss và cộng sự, 2007; Zaenglein và cộng sự, 2016), thư giãn có hỗ trợ phản hồi sinh học (Hughes và cộng sự, 1983), hình ảnh nhận thức (Hughes và cộng sự, 1983), và châm cứu (Kim và Kim, 2012).
Các loại thuốc bổ sung và thay thế khác (Fox và cộng sự, 2016) bao gồm Achillea millefolium, rau dền, peptide kháng khuẩn, cây kim sa, măng tây, vịnh, benzoin, cây bạch dương, cây bìm bịp, thìa là đen, quả óc chó đen, cây lưu ly, men bia, rễ cây ngưu bàng, tinh hoa , cây hoàng liên, hoa cúc la mã, cây chaste, Commiphora mukul, dầu capaiba, rau mùi, dưa chuột, bèo tấm, chiết xuất DuZhong, Quả óc chó Anh, Cây bạch đàn, chanh tươi, tỏi, phong lữ, hạt bưởi, dầu jojoba, cây bách xù, trà labrador, sả, chanh, neem, vỏ cây sồi, hành tây, vỏ cam, trái cam, rễ nho Oregon, cây hoắc hương, hạt đậu, hạt petitgrain, cây thông, chiết xuất vỏ lựu, cây dương, quả bí ngô, cây tầm xuân, cây đại hoàng, cây hương thảo, rue, dầu safflower, gỗ đàn hương, xà phòng, cây xà cừ, kháng thể đặc biệt, cây tầm ma châm chích, dầu cá mặt trời, Taraxacum của cây cinale, cỏ xạ hương, nghệ, giấm, vitex, cây phỉ, cây Withania somnifera, và chiết xuất yerba mate.
Liệu pháp mới
Các liệu pháp mới để điều trị cho bệnh nhân mụn trứng cá tiếp tục được phát triển. Các tác nhân mới nhất bao gồm bọt minocycline, chất giải phóng oxit nitric tại chỗ và cortexolone 17a-propionate. Nhiều liệu pháp mới này đang trong các giai đoạn thử nghiệm khác nhau, và mặc dù khả năng cuối cùng là khó dự đoán, các nghiên cứu sơ bộ cho thấy kết quả đầy hứa hẹn.
Minocycline tạo bọt
Minocycline dùng để uống đã được chứng minh là có hiệu quả trong điều trị bệnh nhân mụn trứng cá; tuy nhiên, các tác dụng phụ toàn thân bao gồm tăng sắc tố, da sần sùi và các phản ứng tự miễn dịch có thể hạn chế việc sử dụng thuốc (Kircik, 2010; Smith và Leyden, 2005). Một nghiên cứu gần đây ở giai đoạn 2 (thử nghiệm lâm sàng) cho thấy minocycline dạng bôi trực tiếp với liều lượng 4% chất tạo bọt có hiệu quả làm giảm đáng kể từ số lượng mụn so với đối chứng ở thời điểm 12 tuần sau khi điều trị cho cả trường hợp mụn viêm (71,1% so với 50,5 %; p = 0,0001) và mụn không viêm (72,7% so với 56,5%; p = 0,0197; Shemer và cộng sự, 2016).
Sự giảm đáng kể các tổn thương được quan sát thấy ngay từ tuần thứ 3 và kéo dài cho đến khi kết thúc nghiên cứu ở tuần thứ 12. Việc điều trị được dung nạp tốt và an toàn mà không có tác dụng phụ toàn thân liên quan đến thuốc hoặc các tác dụng phụ nghiêm trọng. Minocycline 4% dạng bọt sẽ được đánh giá thêm trong các thử nghiệm lâm sàng giai đoạn 3 (Shemer et al., 2016)7
Nitric-oxide bôi trực tiếp
Vi khuẩn P. acnes tạo ra các nhân tố tiết (cytokines) như interleukin-1 và góp phần vào cơ chế gây ra tình trạng mụn trứng cá. Nitric oxide (NO) đã được chứng minh là có đặc tính kháng khuẩn phổ rộng, chữa lành vết thương và điều hòa miễn dịch (Friedman và Friedman, 2009; Martinez và cộng sự, 2009; Qin và cộng sự, 2015). Qin và cộng sự. (2015) đã chỉ ra rằng P. acnes rất nhạy cảm với NO và được chứng minh tính an toàn (không gây độc) cho các tế bào sừng (keratinocyte), tế bào đơn nhân ở người và phôi thai cá ngựa vằn.
Trong thử nghiệm lâm sàng giai đoạn 2 gần đây, nghiên cứu trên mẫu ngẫu nhiên, có so sánh đối chiếu,, có đối chứng với giả dược một loại thuốc giải phóng NO tại chỗ ở mức 1% và 4% giúp giảm đáng kể tỷ lệ phần trăm số lượng trung bình các mụn không viêm và bệnh nhân được điều trị với nồng độ 4% NO giảm đáng kể tỷ lệ phần trăm số lượng trung bình các mụn viêm ở tuần thứ 12 của quá trình điều trị thử nghiệm (Baldwin và cộng sự, 2016). Cả hai nồng độ đều an toàn và dung nạp tốt ở bệnh nhân.
Kem thoa cortexolone 17a-propionate 1%
Thuốc kháng nội tiết tố androgen toàn thân như spironolactone phối hợp với thuốc tránh thai có thể được sử dụng để điều trị hiệu quả cho bệnh nhân bị mụn trứng cá (Kong và Tey, 2013; Meredith và Ormerod, 2013; Thiboutot và Chen, 2003; Zaenglein và cộng sự, 2016). Tuy nhiên, việc sử dụng kháng nội tiết tố androgen toàn thân bị hạn chế ở những phụ nữ mong muốn thụ thai hoặc có các rối loạn nội tiết khác hoặc chống chỉ định (Chen và cộng sự, 1995). Cho đến nay vẫn chưa có phương pháp điều trị kháng androgen tại chỗ để sử dụng.
Cortexolone 17a-propionate là một tác nhân kháng androgen steroid có hoạt tính kháng androgen mạnh và kháng viêm trung bình (Celasco et al., 2004). Cortexolone 17a-propionate ức chế cạnh tranh liên kết androgen nội sinh ở mức độ tiếp nhận androgen của con người mà không ức chế 5a- reductase ở da (Celasco và cộng sự, 2004; Trifu và cộng sự, 2011). Tác nhân nhanh chóng được chuyển hóa khi nó thâm nhập vào lớp biểu bì và giải phóng cortexolone dạng không hoạt động; do đó, cortexolone 17a-propionate không có tác dụng kháng androgen toàn thân (Trifu và cộng sự, 2011).
Trong một nghiên cứu thử nghiệm quy mô lớn với phương pháp so sánh ngẫu nhiên, có đối chứng giữa cortexolone 17a-propionat so với giả dược và kem tretinoin 0,05% cho thấy kem cortexolone 17a-propionat 1% được bệnh nhân dung nạp tốt và hiệu quả tốt hơn đáng kể so với giả dược thông qua kết quả giảm đáng kể tổng số mụn kể cả các mụn bị viêm và ở tình trạng nặng . Kem Cortexolone 17a-propionate 1% cũng có hiệu quả lâm sàng tốt hơn kem tretinoin 0,05% nhưng sự khác biệt này không có ý nghĩa thống kê.
Kết luận
Hiện nay, việc điều trị mụn trứng cá cho phụ nữ có nhiều lựa chọn. Các lựa chọn điều trị phải được điều chỉnh cho phù hợp với từng bệnh nhân với những cân nhắc về sự khác nhau của từng cơ địa của bệnh nhân, khả năng dung nạp của thuốc và các yếu tố tâm lý xã hội. Trong thời kỳ mang thai và cho con bú, có nhiều hạn chế trong việc lựa chọn liệu pháp điều trị mụn trứng cá. Tuy nhiên, mức độ minh chứng còn thấp về sự an toàn của các liệu pháp điều trị mụn trong thời kỳ mang thai và cho con bú.. Nhiều loại thuốc mới đang được nghiên cứu và phát triển để điều trị bệnh nhân mụn trứng cá, điều này sẽ giúp các bác sĩ lâm sàng nâng cao hiệu quả điều trị và chăm sóc các bệnh nhân mắc căn bệnh phổ biến này.
NGƯỜI GIỚI THIỆU
Adebamowo CA, Spiegelman D, Danby FW, Frazier AL, Willett WC, Holmes MD. High school dietary dairy intake and teenage acne. J Am Acad Dermatol 2005;52(2): 207-14.
Adebamowo CA, Spiegelman D, Berkey CS, Danby FW, Rockett HH, Colditz GA, et al. Milk consumption and acne in adolescent girls. Dermatol Online J 2006;12(4):1.
Adebamowo CA, Spiegelman D, Berkey CS, Danby FW, Rockett HH, Colditz GA, et al. Milk consumption and acne in teenaged boys. J Am Acad Dermatol 2008;58(5): 787-93.
Agarwal US, Besarwal RK, Bhola K. Oral isotretinoin in different dose regimens for acne vulgaris: A randomized comparative trial. Indian J Dermatol Venereol Leprol 2011; 77(6):688- 94.
Akman A, Durusoy C, Senturk M, Koc CK, Soyturk D, Alpsoy E. Treatment of acne with intermittent and conventional isotretinoin: a randomized, controlled multicenter study. Arch Dermatol Res 2007;299(10):467-73.
Alhusayen RO, Juurlink DN, Mamdani MM, Morrow RL, Shear NH, Dormuth CR. Isotret¬inoin use and the risk of inflammatory bowel disease: a population-based cohort study. J Invest Dermatol 2013;133(4):907-12.
American Academy of Pediatrics Committee on Drugs. Transfer of drugs and other chemicals into human milk. Pediatrics 2001;108(3):776-89.
Amichai B, Shemer A, Grunwald MH. Low-dose isotretinoin in the treatment of acne vulgaris. J Am Acad Dermatol 2006;54(4):644-6.
Antonio JR, Pegas JR, Cestari TF, Do Nascimento LV. Azithromycin pulses in the treatment of inflammatory and pustular acne: efficacy, tolerability and safety. J Dermatolog Treat 2008;19(4):210-5.
Atzori L, Brundu MA, Orru A, Biggio P. Glycolic acid peeling in the treatment of acne.
J Eur Acad Dermatol Venereol 1999;12(2):119-22.
Autret E, Berjot M, Jonville-Bera AP, Aubry MC, Moraine C. Anophthalmia and agenesis of optic chiasma associated with adapalene gel in early pregnancy. Lancet 1997; 350(9074):339.
Azziz R, Carmina E, Dewailly D, Diamanti-Kandarakis E, Escobar-Morreale HF, Futterweit W, et al. The Androgen Excess and PCOS Society criteria for the poly- cystic ovary syndrome: the complete task force report. Fertil Steril 2009;91(2): 456-88.
Babaeinejad S, Khodaeiani E, Fouladi RF. Comparison of therapeutic effects of oral doxycycline and azithromycin in patients with moderate acne vulgaris: What is the role of age? J Dermatolog Treat 2011;22(4):206-10.
Back DJ, Breckenridge AM, Crawford FE, Hall JM, MacIver M, Orme ML, et al. The effect of rifampicin on the pharmacokinetics of ethynylestradiol in women. Contraception 1980;21(2):135-43.
Bainton R. Interaction between antibiotic therapy and contraceptive medication. Oral Surg Oral Med Oral Pathol 1986;61(5):453-5.
Baldwin H, Blanco D, McKeever C, Paz N, Vasquez YN, Quiring J, et al. Results of a phase 2 efficacy and safety study with SB204, an investigational topical nitric oxide- releasing drug for the treatment of acne vulgaris. J Clin Aesthet Dermatol 2016; 9(8):12-8.
Barbaric J, Abbott R, Posadzki P, Car M, Gunn LH, Layton MM, et al. Light therapies for acne. Cochrane Database Syst Rev 2016;9:Cd007917.
Bartlett JG, Chang TW, Gurwith M, Gorbach SL, Onderdonk AB. Antibiotic-associated pseudomembranous colitis due to toxin-producing clostridia. N Engl J Med 1978;298(10):531-4.
Bassett IB, Pannowitz DL, Barnetson RS. A comparative study of tea-tree oil versus benzoylperoxide in the treatment of acne. Med J Aust 1990;153(8):455-8.
Basta-Juzbasic A, Lipozencic J, Oremovic L, Kotrulja L, Gruber F, Brajac I, et al. A dose¬finding study of azithromycin in the treatment of acne vulgaris. Acta Dermatovenerol Croat 2007;15(3):141-7.
Bataille V, Snieder H, MacGregor AJ, Sasieni P, Spector TD. The influence of genetics and environmental factors in the pathogenesis of acne: a twin study of acne in women. J Invest Dermatol 2002;119(6):1317-22.
Becker LE, Bergstresser PR, Whiting DA, Clendenning WE, Dobson RL, Jordan WP, et al. Topical clindamycin therapy for acne vulgaris. A cooperative clinical study. Arch Dermatol 1981;117(8):482-5.
Bershad S, Rubinstein A, Paterniti JR, Le NA, Poliak SC, Heller B, et al. Changes in plasma lipids and lipoproteins during isotretinoin therapy for acne. N Engl J Med 1985; 313(16):981-5.
Bhate K, Williams HC. Epidemiology of acne vulgaris. Br J Dermatol 2013;168(3):474-85.
Blasiak RC, Stamey CR, Burkhart CN, Lugo-Somolinos A, Morrell DS. High-dose isotreti- noin treatment and the rate of retrial, relapse, and adverse effects in patients with acne vulgaris. JAMA Dermatol 2013;149(12):1392-8.
Bojar RA, Eady EA, Jones CE, Cunliffe WJ, Holland KT. Inhibition of erythromycin- resistant propionibacteria on the skin of acne patients by topical erythromycin with and without zinc. Br J Dermatol 1994;130(3):329-36.
Borghi A, Mantovani L, Minghetti S, Giari S, Virgili A, Bettoli V. Low-cumulative dose isotretinoin treatment in mild-to-moderate acne: efficacy in achieving stable remission. J Eur Acad Dermatol Venereol 2011;25(9):1094-8.
Bowe WP, Shalita AR. Effective over-the-counter acne treatments. Semin Cutan Med Surg 2008;27(3):170-6.
Bozdag KE, Gulseren S, Guven F, Cam B. Evaluation of depressive symptoms in acne patients treated with isotretinoin. J Dermatolog Treat 2009;20(5):293-6.
Bozzo P, Chua-Gocheco A, Einarson A. Safety of skin care products during pregnancy. Can Fam Physician 2011;57(6):665-7.
Bradford LG, Montes LF. Topical application of vitamin A acid in acne vulgaris. South Med J 1974;67(6):683-7.
Burke BM, Cunliffe WJ. The assessment of acne vulgaris-the Leeds technique. Br J Dermatol 1984;111(1):83-92.
Capitanio B, Sinagra JL, Bordignon V, Cordiali Fei P, Picardo M, Zouboulis CC. Underestimated clinical features of postadolescent acne. J Am Acad Dermatol 2010;63(5):782-8.
Capitanio B, Sinagra JL, Weller RB, Brown C, Berardesca E. Randomized controlled study of a cosmetic treatment for mild acne. Clin Exp Dermatol 2012;37(4):346-9.
Carroll KC, Bartlett JG. Biology of Clostridium difficile: implications for epidemiology and diagnosis. Annu Rev Microbiol 2011;65:501-21.
Celasco G, Moro L, Bozzella R, Ferraboschi P, Bartorelli L, Quattrocchi C, et al. Biological profile of cortexolone 17alpha-propionate (CB-03-01), a new topical and peripherally selective androgen antagonist. Arzneimittelforschung 2004;54(12):881-6.
Chen C, Puy LA, Simard J, Li X, Singh SM, Labrie F. Local and systemic reduction by topical finasteride or flutamide of hamster flank organ size and enzyme activity. J Invest Dermatol 1995;105(5):678-82.
Chen MJ, Chen CD, Yang JH, Chen CL, Ho HN, Yang WS, et al. High serum dehydroepi¬androsterone sulfate is associated with phenotypic acne and a reduced risk of abdominal obesity in women with polycystic ovary syndrome. Hum Reprod 2011;26(1):227-34.
Chia CY, Lane W, Chibnall J, Allen A, Siegfried E. Isotretinoin therapy and mood changes in adolescents with moderate to severe acne: A cohort study. Arch Dermatol 2005; 141(5):557-60.
Chivot M, Midoun H. Isotretinoin and acne-a study of relapses. Dermatologica 1990; 180(4):240-3.
Choi CW, Lee DH, Kim HS, Kim BY, Park KC, Youn SW. The clinical features of late onset acne compared with early onset acne in women. J Eur Acad Dermatol Venereol 2011;25(4):454-61.
Choi JS, Bae HJ, Kim SJ, Choi IS. In vitro antibacterial and anti-inflammatory properties of seaweed extracts against acne inducing bacteria, Propionibacterium acnes. J Environ Biol 2011;32(3):313-8.
Christiansen JV, Gadborg E, Ludvigsen K, Meier CH, Norholm A, Pedersen D, et al. Topical tretinoin, vitamin A acid (Airol) in acne vulgaris. A controlled clinical trial. Dermatologica 1974;148(2):82-9.
Cochran RJ, Tucker SB, Flannigan SA. Topical zinc therapy for acne vulgaris. Int J Dermatol 1985;24(3):188-90.
Cohen J, Adams S, Patten S. No association found between patients receiving isotretinoin for acne and the development of depression in a Canadian prospective cohort. Can J Clin Pharmacol 2007;14(2):e227-3.
Collier CN, Harper JC, Cafardi JA, Cantrell WC, Wang W, Foster KW, et al. The preva- lence of acne in adults 20 years and older. J Am Acad Dermatol 2008;58(1):56-9. Collins MK, Moreau JF, Opel D, Swan J, Prevost N, Hastings M, et al. Compliance with pregnancy prevention measures during isotretinoin therapy. J Am Acad Dermatol 2014;70(1):55-9.
Coloe J, Du H, Morrell DS. Could higher doses of isotretinoin reduce the frequency of treatment failure in patients with acne? J Am Acad Dermatol 2011;65(2):422-3.
Cunliffe WJ. Acne and unemployment. Br J Dermatol 1986;115(3):386.
Cunliffe WJ, Holland KT. Clinical and laboratory studies on treatment with 20% azelaic acid cream for acne. Acta Derm Venereol Suppl (Stockh) 1989;143:31-4.
Cunliffe WJ, Caputo R, Dreno B, Forstrom L, Heenen M, Orfanos CE, et al. Clinical efficacy and safety comparison of adapalene gel and tretinoin gel in the treatment of acne vulgaris: Europe and U.S. multicenter trials. J Am Acad Dermatol 1997;36(6 Pt 2): S126- 34.
da Silva AG, Puziol Pde F, Leitao RN, Gomes TR, Scherer R, Martins ML, et al. Application of the essential oil from copaiba (Copaifera langsdori Desf.) for acne vulgaris: A double-blind, placebo-controlled clinical trial. Altern Med Rev 2012;17(1):69-75. Danesh MJ, Murase JE. The new U.S. Food and Drug Administration pregnancy and lactation labeling rules: their impact on clinical practice. J Am Acad Dermatol 2015;73(2):310-1.
De D, Kanwar AJ. Combination of low-dose isotretinoin and pulsed oral azithromycin in the management of moderate to severe acne: a preliminary open-label, prospective, non¬comparative, single-centre study. Clin Drug Investig 2011;31(8):599-604.
De Marchi MA, Maranhao RC, Brandizzi LI, Souza DR. Effects of isotretinoin on the metabolism of triglyceride-rich lipoproteins and on the lipid profile in patients with acne. Arch Dermatol Res 2006;297(9):403-8.
Del Rosso JQ, Bikowski JB, Baum E, Smith J, Hawkes S, Benes V, et al. A closer look at truncal acne vulgaris: prevalence, severity, and clinical significance. J Drugs Dermatol 2007;6(6):597-600.
Del Rosso JQ, Pillai R, Moore R. Absence of degradation of tretinoin when benzoyl peroxide is combined with an optimized formulation of tretinoin gel (0.05%). J Clin Aesthet Dermatol 2010;3(10):26-8.
Di Landro A, Cazzaniga S, Parazzini F, Ingordo V, Cusano F, Atzori L, et al. Family history, body mass index, selected dietary factors, menstrual history, and risk of moderate to severe acne in adolescents and young adults. J Am Acad Dermatol 2012;67(6): 1129-35.
Docherty JJ, McEwen HA, Sweet TJ, Bailey E, Booth TD. Resveratrol inhibition of Propionibacterium acnes. J Antimicrob Chemother 2007;59(6):1182-4.
Doshi A, Zaheer A, Stiller MJ. A comparison of current acne grading systems and proposal of a novel system. Int J Dermatol 1997;36(6):416-8.
Draelos ZD, Matsubara A, Smiles K. The effect of 2% niacinamide on facial sebum production. J Cosmet Laser Ther 2006;8(2):96-101.
Draelos ZD, Carter E, Maloney JM, Elewski B, Poulin Y, Lynde C, et al. Two randomized studies demonstrate the efficacy and safety of dapsone gel, 5% for the treatment of acne vulgaris. J Am Acad Dermatol 2007;56(3):439.e1-439.e10.
Dreno B, Blouin E. Acne, pregnant women and zinc salts: a literature review. Ann Dermatol Venereol 2008;135(1):27-33.
Dreno B, Fischer TC, Perosino E, Poli F, Viera MS, Rendon MI, et al. Expert opinion: efficacy of superficial chemical peels in active acne management-what can we learn from the literature today? Evidence-based recommendations. J Eur Acad Dermatol Venereol 2011;25(6):695-704.
Dreno B, Bettoli V, Ochsendorf F, Layton AM, Perez M, Dakovic R, et al. Efficacy and safety of clindamycin phosphate 1.2%/tretinoin 0.025% formulation for the treat- ment of acne vulgaris: pooled analysis of data from three randomised, double- blind, parallel- group, phase III studies. Eur J Dermatol 2014;24(2):201-9.
Dreno B, Thiboutot D, Layton AM, Berson D, Perez M, Kang S. Large-scale international study enhances understanding of an emerging acne population: adult females. J Eur Acad Dermatol Venereol 2015;29(6):1096-106.
Duenwald M. After 20 years, debate over drug persists. New York Times 2002:F7.
Elstein W. Topical deodorized polysulfides. Broadscope acne therapy. Cutis 1981; 28(4):468-72.
Enshaieh S, Jooya A, Siadat AH, Iraji F. The efficacy of 5% topical tea tree oil gel in mild to moderate acne vulgaris: a randomized, double-blind placebo-controlled study. Indian J Dermatol Venereol Leprol 2007;73(1):22-5.
Etminan M, Bird ST, Delaney JA, Bressler B, Brophy JM. Isotretinoin and risk for inflam¬matory bowel disease: a nested case-control study and meta-analysis of published and unpublished data. JAMA Dermatol 2013;149(2):216-20.
Fabbrocini G, Staibano S, De Rosa G, Battimiello V, Fardella N, Ilardi G, et al. Resveratrol-containing gel for the treatment of acne vulgaris: a single-blind, vehicle- controlled, pilot study. Am J Clin Dermatol 2011;12(2):133-41.
Fazio A. Oral contraceptive drug interactions: important considerations. South Med J 1991;84(8):997-1002.
FennerJA,WissK, LevinNA.Oral cephalexinfor acnevulgaris:clinical experience with 93 patients. Pediatr Dermatol 2008;25(2):179-83.
Firoz BF, Henning JS, Zarzabal LA, Pollock BH. Toxic epidermal necrolysis: five years of treatment experience from a burn unit. J Am Acad Dermatol 2012; 67(4):630-5.
Fleischer Jr AB, Dinehart S, Stough D, Plott RT. Safety and efficacy of a new extended-release formulation of minocycline. Cutis 2006;78(4 Suppls):21-31.
Fouladi RF. Aqueous extract of dried fruit of Berberis vulgaris L. in acne vulgaris, a clinical trial. J Diet Suppl 2012;9(4):253-61.
Fox L, Csongradi C, Aucamp M, du Plessis J, Gerber M. Treatment modalities for acne. Molecules 2016:21(8).
Frampton JE, Wagstaff AJ. Azelaic acid 15% gel: in the treatment of papulopustular rosacea. Am J Clin Dermatol 2004;5(1):57-64.
Friedman A, Friedman J. New biomaterials for the sustained release of nitric oxide: past, present and future. Expert Opin Drug Deliv 2009;6(10):1113-22.
Garner SE, Eady A, Bennett C, Newton JN, Thomas K, Popescu CM. Minocycline for acne vulgaris: efficacy and safety. Cochrane Database Syst Rev 2012(8):Cd002086.
Gaur S, Agnihotri R. Green tea: A novel functional food for the oral health of older adults. Geriatr Gerontol Int 2014;14(2):238-50.
Gehring W. Nicotinic acid/niacinamide and the skin. J Cosmet Dermatol 2004;3(2):88-93.
Gold MH, Bradshaw VL, Boring MM, Bridges TM, Biron JA, Carter LN. The use of a novel intense pulsed light and heat source and ALA-PDT in the treatment of moderate to severe inflammatory acne vulgaris. J Drugs Dermatol 2004;3(6 Suppl):S15-9.
Gold LS, Cruz A, Eichenfield L, Tan J, Jorizzo J, Kerrouche N, et al. Effective and safe com¬bination therapy for severe acne vulgaris: a randomized, vehicle-controlled, double¬blind study of adapalene 0.1%-benzoyl peroxide 2.5% fixed-dose combina- tion gel with doxycycline hyclate 100 mg. Cutis 2010;85(2):94-104.
Goldsmith LA, Bolognia JL, Callen JP, Chen SC, Feldman SR, Lim HW, et al. American Academy of Dermatology Consensus Conference on the safe and optimal use of isotretinoin: summary and recommendations. J Am Acad Dermatol 2004;50(6): 900-6.
Goldstein JA, Socha-Szott A, Thomsen RJ, Pochi PE, Shalita AR, Strauss JS. Comparative effect of isotretinoin and etretinate on acne and sebaceous gland secretion. J Am Acad Dermatol 1982;6(4 Pt 2 Suppl):760-5.
Gollnick H, Cunliffe W, Berson D, Dreno B, Finlay A, Leyden JJ, et al. Management of acne: a report from a Global Alliance to Improve Outcomes in Acne. J Am Acad Dermatol 2003;49(1 Suppl):S1-37.
Goodfield MJ, Cox NH, Bowser A, McMillan JC, Millard LG, Simpson NB, et al. Advice on the safe introduction and continued use of isotretinoin in acne in the U.K. 2010. Br J Dermatol 2010;162(6):1172-9.
Goulden V, Clark SM, Cunliffe WJ. Post-adolescent acne: a review of clinical features. Br J Dermatol 1997;136(1):66-70.
Goulden V, Clark SM, McGeown C, Cunliffe WJ. Treatment of acne with intermittent isotretinoin. Br J Dermatol 1997;137(1):106-8.
Grant JD, Anderson PC. Chocolate as a cause of acne: a dissenting view. Mo Med 1965; 62:459-60.
Grover C, Reddu BS. The therapeutic value of glycolic acid peels in dermatology. Indian J Dermatol Venereol Leprol 2003;69(2):148-50.
Guengerich FP. Inhibition of oral contraceptive steroid-metabolizing enzymes by steroids and drugs. Am J Obstet Gynecol 1990;163(6 Pt 2):2159-63.
Gupta M, Mahajan VK, Mehta KS, Chauhan PS. Zinc therapy in dermatology: A review. Dermatol Res Pract 2014;2014:709152.
Gupta A, Singh S, Kotla NG, Webster TJ. Formulation and evaluation of a topical niosomal gel containing a combination of benzoyl peroxide and tretinoin for anti- acne activity. Int J Nanomedicine 2015;10:171-82.
Hajhashemi V, Ghannadi A, Hajiloo M. Analgesic and anti-inflammatory effects of rosa damascena hydroalcoholic extract and its essential oil in animal models. Iran J Pharm Res 2010;9(2):163-8.
Hale T. Medications and mothers’ milk. 14th ed. Amarillo: Hale Publishing; 2010.
Hale EK, Pomeranz MK. Dermatologic agents during pregnancy and lactation: An update and clinical review. Int J Dermatol 2002;41(4):197-203.
Hammer KA. Treatment of acne with tea tree oil (melaleuca) products: a review of efficacy, tolerability and potential modes of action. Int J Antimicrob Agents 2015;45(2):106-10.
Hansen TJ, Lucking S, Miller JJ, Kirby JS, Thiboutot DM, Zaenglein AL. Standardized laboratory monitoring with use of isotretinoin in acne. J Am Acad Dermatol 2016;75(2):323-8.
Harper JC. Evaluating hyperandrogenism: a challenge in acne management. J Drugs Dermatol 2008;7(6):527-30.
Hayashi N, Akamatsu H, Kawashima M. Establishment of grading criteria for acne severity. J Dermatol 2008;35(5):255-60.
Hernandez-Diaz S, Werler MM, Walker AM, Mitchell AA. Folic acid antagonists during pregnancy and the risk of birth defects. N Engl J Med 2000;343(22): 1608-14. Hjorth N, Storm D, Dela K. Topical anhydrous aluminum chloride formulation in the treatment of acne vulgaris: a double-blind study. Cutis 1985;35(5):499-500.
Ho JM, Juurlink DN. Considerations when prescribing trimethoprim-sulfamethoxazole. CMAJ 2011;183(16):1851-8.
Hoffmann K, George A, Heschl L, Leifheit AK, Maier M. Oral contraceptives and antibiotics. A cross¬sectional study about patients’ knowledge in general practice. Reprod Health 2015;12:43.
Holzmann R, Shakery K. Postadolescent acne in females. Skin Pharmacol Physiol 2014; 27(Suppl. 1):3-8.
Hughes H, Brown BW, Lawlis GF, Fulton Jr JE. Treatment of acne vulgaris by biofeed back relaxation and cognitive imagery. J Psychosom Res 1983;27(3):185-91.
Hull SM, Cunliffe WJ, Hughes BR. Treatment of the depressed and dysmorphophobic acne patient. Clin Exp Dermatol 1991;16(3):210-1.
Hunt MJ, Barnetson RS. A comparative study of gluconolactone versus benzoyl peroxide in the treatment of acne. Australas J Dermatol 1992;33(3):131-4.
Hurley HJ, Shelley WB. Special topical approach to the treatment of acne. Suppression of sweating with aluminum chloride in an anhydrous formulation. Cutis 1978; 22(6):696- 703.
Ilknur T, Demirtasoglu M, Bicak MU, Ozkan S. Glycolic acid peels versus amino fruit acid peels for acne. J Cosmet Laser Ther 2010;12(5):242-5.
Imperato-McGinley J, Gautier T, Cai LQ, Yee B, Epstein J, Pochi P. The androgen control of sebum production. Studies of subjects with dihydrotestosterone deficiency and complete androgen insensitivity. J Clin Endocrinol Metab 1993;76(2):524-8.
Innocenzi D, Skroza N, Ruggiero A, Concetta Potenza M, Proietti I. Moderate acne vulgaris: efficacy, tolerance and compliance of oral azithromycin thrice weekly for. Acta Dermatovenerol Croat 2008;16(1):13-8.
Ismail NH, Manaf ZA, Azizan NZ. High glycemic load diet, milk and ice cream con¬sumption are related to acne vulgaris in Malaysian young adults: a case control study. BMC Dermatol 2012;12:13.
Jacob CI, Dover JS, Kaminer MS. Acne scarring: a classification system and review of treatment options. J Am Acad Dermatol 2001;45(1):109-17.
Jen I. A comparison of low dosage trimethoprim/sulfamethoxazole with oxytetracy¬cline in acne vulgaris. Cutis 1980;26(1):106-8.
Jick SS, Kremers HM, Vasilakis-Scaramozza C. Isotretinoin use and risk of depression, psychotic symptoms, suicide, and attempted suicide. Arch Dermatol 2000; 136(10):1231-6.
Jones DH, King K, Miller AJ, Cunliffe WJ. A dose-response study of I3-cis-retinoic acid in acne vulgaris. Br J Dermatol 1983;108(3):333-43.
Jung GW, Tse JE, Guiha I, Rao J. Prospective, randomized, open-label trial comparing the safety, efficacy, and tolerability of an acne treatment regimen with and without a probiotic supplement and minocycline in subjects with mild to moderate acne. J Cutan Med Surg 2013;17(2):114-22.
Kallen BA, Otterblad Olausson P, Danielsson BR. Is erythromycin therapy teratogenic in humans? Reprod Toxicol 2005;20(2):209-14.
Kamangar F, Shinkai K. Acne in the adult female patient: a practical approach. Int J Dermatol 2012;51(10):1162-74.
Karimipour DJ, Karimipour G, Orringer JS. Microdermabrasion: an evidence-based review. Plast Reconstr Surg 2010;125(1):372-7.
Katsambas A, Graupe K, Stratigos J. Clinical studies of 20% azelaic acid cream in the treatment of acne vulgaris. Comparison with vehicle and topical tretinoin. Acta Derm Venereol Suppl (Stockh) 1989;143:35-9.
Kaymak Y, Ilter N. The effectiveness of intermittent isotretinoin treatment in mild or moderate acne. J Eur Acad Dermatol Venereol 2006;20(10):12-60.
Kempiak SJ, Uebelhoer N. Superficial chemical peels and microdermabrasion for acne vulgaris. Semin Cutan Med Surg 2008;27(3):212-20.
Kermani TA, Ham EK, Camilleri MJ, Warrington KJ. Polyarteritis nodosa-like vasculitis in association with minocycline use: a single-center case series. Semin Arthritis Rheum 2012;42:213-21.
Khayef G, Young J, Burns-Whitmore B, Spalding T. Effects of fish oil supplementation on inflammatory acne. Lipids Health Dis 2012;11:165.
Khodaeiani E, Fouladi RF, Amirnia M, Saeidi M, Karimi ER. Topical 4% nicotinamide vs. 1% clindamycin in moderate inflammatory acne vulgaris. Int J Dermatol 2013; 52(8):999- 1004.
Kim KS, Kim YB. Anti-inflammatory effect of Keigai-rengyo-to extract and acupuncture in male patients with acne vulgaris: a randomized controlled pilot trial. J Altern Complement Med 2012;18(5):501-8.
King K, Jones DH, Daltrey DC, Cunliffe WJ. A double-blind study of the effects of 13-cis- retinoic acid on acne, sebum excretion rate and microbial population. Br J Dermatol 1982;107(5):583-90.
Kircik LH. Doxycycline and minocycline for the management of acne: a review of efficacy and safety with emphasis on clinical implications. J Drugs Dermatol 2010;9(11):1407- 11.
Kircik LH. Efficacy and safety of azelaic acid (AzA) gel 15% in the treatment of post- inflammatory hyperpigmentation and acne: a 16-week, baseline-controlled study. J Drugs Dermatol 2011;10(6):586-90.
Klaz I, Kochba I, Shohat T, Zarka S, Brenner S. Severe acne vulgaris and tobacco smoking in young men. J Invest Dermatol 2006;126(8):1749-52.
Kong YL, Tey HL. Treatment of acne vulgaris during pregnancy and lactation. Drugs 2013;73(8):779-87.
Koren G, Pastuszak A, Ito S. Drugs in pregnancy. N Engl J Med 1998;338(16):1128-37.
Krishnan G. Comparison of two concentrations of tretinoin solution in the topical treatment of acne vulgaris. Practitioner 1976;216(1291):106-9.
Kuhlman DS, Callen JP. A comparison of clindamycin phosphate 1 percent topical lotion and placebo in the treatment of acne vulgaris. Cutis 1986;38(3):203-6.
Kus S, Yucelten D, Aytug A. Comparison of efficacy of azithromycin vs. doxycycline in the treatment of acne vulgaris. Clin Exp Dermatol 2005;30(3):215-20.
Kwon HH, Yoon JY, Hong JS, Jung JY, Park MS, Suh DH. Clinical and histological effect of a low glycaemic load diet in treatment of acne vulgaris in Korean patients: a randomized, controlled trial. Acta Derm Venereol 2012;92(3):241-6.
Lalla JK, Nandedkar SY, Paranjape MH, Talreja NB. Clinical trials of ayurvedic formula¬tions in the treatment of acne vulgaris. J Ethnopharmacol 2001;78(1):99-102.
LambergL. Acnedrugdepression warnings highlight need for expert care. JAMA 1998; 279(14):1057.
Lammer EJ, Chen DT, Hoar RM, Agnish ND, Benke PJ, Braun JT, et al. Retinoic acid embryopathy. N Engl J Med 1985;313(14):837-41.
Lawrence DM, Katz M, Robinson TW, Newman MC, McGarrigle HH, Shaw M, et al. Reduced sex hormone binding globulin and derived free testosterone levels in women with severe acne. Clin Endocrinol (Oxf) 1981;15(1):87-91.
Layton AM, Knaggs H, Taylor J, Cunliffe WJ. Isotretinoin for acne vulgaris-10 years later: A safe and successful treatment. Br J Dermatol 1993;129(3):292-6.
Leachman SA, Insogna KL, Katz L, Ellison A, Milstone LM. Bone densities in patients receiving isotretinoin for cystic acne. Arch Dermatol 1999;135(8):961-5.
Lebrun CM. Rosac cream with sunscreens (sodium sulfacetamide 10% and sulfur 5%). Skinmed 2004;3(2):92.
Lee JJ, Feng L, Reshef DS, Sabichi AL, Williams B, Rinsurongkawong W, et al. Mortality in the randomized, controlled lung intergroup trial of isotretinoin. Cancer Prev Res (Phila) 2010;3(6):738-44.
Lee JW, Yoo KH, Park KY, Han TY, Li K, Seo SJ, et al. Effectiveness of conventional, low- dose and intermittent oral isotretinoin in the treatment of acne: a randomized, controlled comparative study. Br J Dermatol 2011;164(6):1369-75.
Lehucher-Ceyrac D,Weber-Buisset MJ. Isotretinoin and acne in practice: A prospective analysis of 188 cases over 9 years. Dermatology 1993;186(2):123-8.
Lehucher-Ceyrac D, de La Salmoniere P, Chastang C, Morel P. Predictive factors for failure of isotretinoin treatment in acne patients: results from a cohort of 237 pa- tients. Dermatology 1999;198(3):278-83.
Lester RS, Schachter GD, Light MJ. Isotretinoin and tetracycline in the management of severe nodulocystic acne. Int J Dermatol 1985;24(4):252-7.
Levesque A, Hamzavi I, Seite S, Rougier A, Bissonnette R. Randomized trial comparing a chemical peel containing a lipophilic hydroxy acid derivative of salicylic acid with a salicylic acid peel in subjects with comedonal acne. J Cosmet Dermatol 2011; 10(3):174-8.
Levine RM, Rasmussen JE. Intralesional corticosteroids in the treatment of nodulocystic acne. Arch Dermatol 1983;119(6):480-1.
Leyden JJ, Shalita AR, Saatjian GD, Sefton J. Erythromycin 2% gel in comparison with clindamycin phosphate 1% solution in acne vulgaris. J Am Acad Dermatol 1987; 16(4):822-7.
Leyden J, Thiboutot DM, Shalita AR, Webster G, Washenik K, Strober BE, et al. Compar¬ison of tazarotene and minocycline maintenance therapies in acne vulgaris: a multicenter, double-blind, randomized, parallel-group study. Arch Dermatol 2006;142(5):605-12.
Leyden JJ, Bruce S, Lee CS, Ling M, Sheth PB, Stewart DM, et al. A randomized, phase 2, dose-ranging study in the treatment of moderate to severe inflammatory facial acne vulgaris with doxycycline calcium. J Drugs Dermatol 2013;12(6):658-63.
Liden S, Goransson K, Odsell L. Clinical evaluation in acne. Acta Derm Venereol Suppl (Stockh) 1980(Suppl. 89):47-52.
Lipson AH, Collins F, Webster WS. Multiple congenital defects associated with maternal use of topical tretinoin. Lancet 1993;341(8856):1352-3.
Lloyd JR. The use of microdermabrasion for acne: a pilot study. Dermatol Surg 2001; 27(4):329-31.
Lolis MS, Bowe WP, Shalita AR. Acne and systemic disease. Med Clin North Am 2009; 93(6):1161- 81.
Lookingbill DP, Chalker DK, Lindholm JS, Katz HI, Kempers SE, Huerter CJ, et al. Treat¬ment of acne with a combination clindamycin/benzoyl peroxide gel compared with clindamycin gel, benzoyl peroxide gel and vehicle gel: combined results of two double-blind investigations. J Am Acad Dermatol 1997;37(4):590-5.
Loureiro KD, Kao KK, Jones KL, Alvarado S, Chavez C, Dick L, et al. Minor malformations characteristic of the retinoic acid embryopathy and other birth outcomes in children of women exposed to topical tretinoin during early pregnancy. Am J Med Genet A 2005;136(2):117-21.
Lowenstein EJ. Diagnosis and management of the dermatologic manifestations of the polycystic ovary syndrome. Dermatol Ther 2006;19:210-23.
Lucky AW. Endocrine aspects of acne. Pediatr Clin North Am 1983;30(3):495-9. Lucky AW. Hormonal correlates of acne and hirsutism. Am J Med 1995;98(1a): 89s-94s.
Lucky AW, McGuire J, Rosenfield RL, Lucky PA, Rich BH. Plasma androgens in women with acne vulgaris. J Invest Dermatol 1983;81(1):70-4.
Lucky AW, Biro FM, Huster GA, Leach AD, Morrison JA, Ratterman J. Acne vulgaris in premenarchal girls. An early sign of puberty associated with rising levels of dehydroepiandrosterone. Arch Dermatol 1994;130(3):308-14.
Lucky AW, Biro FM, Simbartl LA, Morrison JA, Sorg NW. Predictors of severity of acne vulgaris in young adolescent girls: results of a five-year longitudinal study. J Pediatr 1997;130(1):30-9.
Lucky AW, Cullen SI, Funicella T, Jarratt MT, Jones T, Reddick ME. Double-blind, vehicle-controlled, multicenter comparison of two 0.025% tretinoin creams in patients with acne vulgaris. J Am Acad Dermatol 1998;38(4):S24-30.
Lucky AW, Maloney JM, Roberts J, Taylor S, Jones T, Ling M, et al. Dapsone gel 5% for the treatment of acne vulgaris: Safety and efficacy of long-term (1 year) treat- ment. J Drugs Dermatol 2007;6(10):981-7.
Ma L, Xiang LH, Yu B, Yin R, Chen L, Wu Y, et al. Low-dose topical 5-aminolevulinic acid photodynamic therapy in the treatment of different severity of acne vulgaris. Photodiagnosis Photodyn Ther 2013;10(4):583-90.
Magin P, Pond D, Smith W, Watson A. A systematic review of the evidence for ‘myths and misconceptions’ in acne management: diet, face-washing and sunlight. Fam Pract 2005;22(1):62-70.
Mahmood T, Akhtar N, Khan BA, Khan HM, Saeed T. Outcomes of 3% green tea emul¬sion on skin sebum production in male volunteers. Bosn J Basic Med Sci 2010; 10(3):260- 4.
Maleszka R, Turek-Urasinska K, Oremus M, Vukovic J, Barsic B. Pulsed azithromycin treatment is as effective and safe as 2-week-longer daily doxycycline treatment of acne vulgaris: a randomized, double-blind, noninferiority study. Skinmed 2011;9(2):86-94.
Ma’or Z, Henis Y, Alon Y, Orlov E, Sorensen KB, Oren A. Antimicrobial properties of Dead Sea black mineral mud. Int J Dermatol 2006;45(5):504-11.
Marcinkiewicz J. Taurine bromamine (TauBr)-its role in immunity and new perspec- tives for clinical use. J Biomed Sci 2010;17(Suppl. 1):S3.
Marcinkiewicz J, Biedron R, Bialecka A, Kasprowicz A, Mak M, Targosz M. Susceptibility of Propionibacterium acnes and Staphylococcus epidermidis to killing by MPO- halide system products. Implication for taurine bromamine as a new candidate for topical therapy in treating acne vulgaris. Arch Immunol Ther Exp (Warsz) 2006;54(1):61-8.
Marcinkiewicz J, Wojas-Pelc A, Walczewska M, Lipko-Godlewska S, Jachowicz R, Maciejewska A, et al. Topical taurine bromamine, a new candidate in the treat- ment of moderate inflammatory acne vulgaris: a pilot study. Eur J Dermatol 2008;18(4):433-9.
Margolis DJ, Fanelli M, Hoffstad O, Lewis JD. Potential association between the oral tetracycline class of antimicrobials used to treat acne and inflammatory bowel disease. Am J Gastroenterol 2010;105(12):2610-6.
Margolis DJ, Fanelli M, Kupperman E, Papadopoulos M, Metlay JP, Xie SX, et al. Associa¬tion of pharyngitis with oral antibiotic use for the treatment of acne: a cross- sectional and prospective cohort study. Arch Dermatol 2012;148(3):326-32.
Marqueling AL, Zane LT. Depression and suicidal behavior in acne patients treated with isotretinoin: a systematic review. Semin Cutan Med Surg 2007;26(4): 210-20.
Martinez LR, Han G, Chacko M, Chacko M, Mihu MR, Jacobson M, et al. Antimicrobial and healing efficacy of sustained release nitric oxide nanoparticles against Staphylococcus aureus skin infection. J Invest Dermatol 2009;129(10):2463-9.
Mays RM, Gordon RA, Wilson JM, Silapunt S. New antibiotic therapies for acne and rosacea. Dermatol Ther 2012;25(1):23-37.
McCormack WM, George H, Donner A, Kodgis LF, Alpert S, Lowe EW, et al. Hepatotoxicity of erythromycin estolate during pregnancy. Antimicrob Agents Chemother 1977; 12(5):630-5.
McElwee NE, Schumacher MC, Johnson SC, Weir TW, Greene SL, Scotvold MJ, et al. An observational study of isotretinoin recipients treated for acne in a health mainte- nance organization. Arch Dermatol 1991;127(3):341-6.
Meredith FM, Ormerod AD. The management of acne vulgaris in pregnancy. Am J Clin Dermatol 2013;14(5):351-8.
Michaelsson G, Juhlin L, Vahlquist A. Effects of oral zinc and vitamin A in acne. Arch Dermatol 1977;113(1):31-6.
Miller DM, Helms SE, Brodell RT. A practical approach to antibiotic treatment in women taking oral contraceptives. J Am Acad Dermatol 1994;30(6):1008-11.
Mills Jr OH, Kligman AM, Pochi P, Comite H. Comparing 2.5%, 5%, and 10% benzoyl peroxide on inflammatory acne vulgaris. Int J Dermatol 1986;25(10):664-7.
Mills Jr O, Thornsberry C, Cardin CW, Smiles KA, Leyden JJ. Bacterial resistance and therapeutic outcome following three months of topical acne therapy with 2% erythromycin gel versus its vehicle. Acta Derm Venereol 2002;82(4):260-5.
Moon SH, Roh HS, Kim YH, Kim JE, Ko JY, Ro YS. Antibiotic resistance of microbial strains isolated from Korean acne patients. J Dermatol 2012;39(10):833-7.
Moore A, Ling M, Bucko A, Manna V, Rueda MJ. Efficacy and safety of subantimicrobial dose, modified-release doxycycline 40 mg versus doxycycline 100 mg versus place- bo for the treatment of inflammatory lesions in moderate and severe acne: a randomized, double¬blinded, controlled study. J Drugs Dermatol 2015;14(6):581-6.
Namazi MR. Nicotinamide in dermatology: a capsule summary. Int J Dermatol 2007; 46(12):1229-31.
Nast A, Dreno B, Bettoli V, Degitz K, Erdmann R, Finlay AY, et al. European evidence- based (S3) guidelines for the treatment of acne. J Eur Acad Dermatol Venereol 2012;26(Suppl. 1):1-29.
Navarre-Belhassen C, Blanchet P, Hillaire-Buys D, Sarda P, Blayac JP. Multiple congenital malformations associated with topical tretinoin. Ann Pharmacother 1998; 32(4):505-6.
Nevoralova Z, Dvorakova D. Mood changes, depression and suicide risk during isotreti- noin treatment: A prospective study. Int J Dermatol 2013;52(2):163-8.
O’Brien SC, Lewis JB, Cunliffe WJ. The Leeds revised acne grading system. J Dermatolog Treat 1998;9:215-20.
Ormerod AD, Thind CK, Rice SA, Reid IC, Williams JH, McCaffery PJ. Influence of isotreti- noin on hippocampal-based learning in human subjects. Psychopharmacology (Berl) 2012;221(4):667-74.
Padilla RS, McCabe JM, Becker LE. Topical tetracycline hydrochloride vs. topical clindamycin phosphate in the treatment of acne: a comparative study. Int J Dermatol 1981;20(6):445-8.
Panchaud A, Csajka C, Merlob P, Schaefer C, Berlin M, De Santis M, et al. Pregnancy outcome following exposure to topical retinoids: a multicenter prospective study. J Clin Pharmacol 2012;52(12):1844-51.
Paranjpe P, Kulkarni PH. Comparative efficacy of four Ayurvedic formulations in the treatment of acne vulgaris: a double-blind randomised placebo-controlled clinical evaluation. J Ethnopharmacol 1995;49(3):127-32.
Pariser D, Bucko A, Fried R, Jarratt MT, Kempers S, Kircik L, et al. Tretinoin gel micro¬sphere pump 0.04% plus 5% benzoyl peroxide wash for treatment of acne vulgaris: morning/morning regimen is as effective and safe as morning/evening regimen. J Drugs Dermatol 2010;9(7):805-13.
Pariser DM, Rich P, Cook-Bolden FE, Korotzer A. An aqueous gel fixed combination of clindamycin phosphate 1.2% and benzoyl peroxide 3.75% for the once-daily treat- ment of moderate to severe acne vulgaris. J Drugs Dermatol 2014;13(9):1083-9. Park SK, Lee
CW, Lee MY. Antibacterial effects of minerals from ores indigenous to Korea. J Environ Biol 2009;30(1):151-4.
Parsad D, Pandhi R, Nagpal R, Negi KS. Azithromycin monthly pulse vs daily doxycy- cline in the treatment of acne vulgaris. J Dermatol 2001;28(1):1-4.
Peck GL, Olsen TG, Butkus D, Pandya M, Arnaud-Battandier J, Gross EG, et al. Isotreti¬noin versus placebo in the treatment of cystic acne. A randomized double-blind study. J Am Acad Dermatol 1982;6(4 Pt 2 Suppl):735-45.
Pedace FJ, Stoughton R. Topical retinoic acid in acne vulgaris. Br J Dermatol 1971; 84(5):465-9.
Plewig G, Kligman AM. Acne: Morphogenesis and treatment. New York, NY: Springer¬Verlag; 1975.
Plewig G, Fulton JE, Kligman AM. Pomade acne. Arch Dermatol 1970;101(5):580-4.
Pollock B, Turner D, Stringer MR, Bojar RA, Goulden V, Stables GI, et al. Topical aminolaevulinic acid-photodynamic therapy for the treatment of acne vulgaris: A study of clinical efficacy and mechanism of action. Br J Dermatol 2004;151(3): 616-22.
Potter RA. Intralesional triamcinolone and adrenal suppression in acne vulgaris. J Invest Dermatol 1971;57(6):364-70.
Poulin Y, Sanchez NP, Bucko A, Fowler J, Jarratt M, Kempers S, et al. A 6-month main¬tenance therapy with adapalene-benzoyl peroxide gel prevents relapse and con- tinuously improves efficacy among patients with severe acne vulgaris: results of a randomized controlled trial. Br J Dermatol 2011;164(6):1376-82.
Public Affairs Committee of the Teratology Society. Teratologypublic affairs committee position paper: Pregnancy labeling for prescription drugs: Ten years later. Birth Defects Res A Clin Mol Teratol 2007;79:627-30.
Qin M, Landriscina A, Rosen JM, Wei G, Kao S, Olcott W, et al. Nitric oxide-releasing nanoparticles prevent propionibacterium acnes-induced inflammation by both clearing the organism and inhibiting microbial stimulation of the innate immune response. J Invest Dermatol 2015;135(11):2723-31.
Rademaker M. Adverse effects of isotretinoin: a retrospective review of 1743 patients started on isotretinoin. Australas J Dermatol 2010;51(4):248-53.
Rademaker M. Making sense of the effects of the cumulative dose of isotretinoin in acne vulgaris. Int J Dermatol 2016;55(5):518-23.
Rafiei R, Yaghoobi R. Azithromycin versus tetracycline in the treatment of acne vulgaris. J Dermatolog Treat 2006;17(4):217-21.
Ramos-e-Silva M, Ramos-e-Silva S, Carneiro S. Acne in women. Br J Dermatol 2015; 172:20¬6.
Rashtak S, Khaleghi S, Pittelkow MR, Larson JJ, Lahr BD, Murray JA. Isotretinoin expo¬sure and risk of inflammatory bowel disease. JAMA Dermatol 2014;150(12): 1322-6.
Rehn LM, Meririnne E, Hook-Nikanne J, Isometsa E, Henriksson M. Depressive symp¬toms and suicidal ideation during isotretinoin treatment: a 12-week follow-up study of male Finnish military conscripts. J Eur Acad Dermatol Venereol 2009; 23(11):1294-7.
Romoren M, Lindbaek M, Nordeng H. Pregnancy outcome after gestational exposure to erythromycin – a population-based register study from Norway. Br J Clin Pharmacol 2012;74(6):1053-62.
Ross EV. Optical treatments for acne. Dermatol Ther 2005;18(3):253-66.
Rothman KF, Pochi PE. Use of oral and topical agents for acne in pregnancy. J Am Acad Dermatol 1988;19(3):431-42.
Roujeau JC, Kelly JP, Naldi L, Rzany B, Stern RS, Anderson T, et al. Medication use and the risk of Stevens-Johnson syndrome or toxic epidermal necrolysis. N Engl J Med 1995;333(24):1600-7.
Rubinow DR, Peck GL, Squillace KM, Gantt GG. Reduced anxiety and depression in cystic acne patients after successful treatment with oral isotretinoin. J Am Acad Dermatol 1987;17(1):25-32.
Sakamoto FH, Torezan L, Anderson RR. Photodynamic therapy for acne vulgaris: a critical review from basics to clinical practice: part II. Understanding parameters for acne treatment with photodynamic therapy. J Am Acad Dermatol 2010;63(2):195-211 quiz 211-92.
Sanchez Viera M. Management of acne scars: fulfilling our duty of care for patients. Br J Dermatol 2015;172(Suppl. 1):47-51.
Sardana K, Garg VK. An observational study of methionine-bound zinc with antioxi- dants for mild to moderate acne vulgaris. Dermatol Ther 2010;23(4):411-8.
Schafer T, Nienhaus A, Vieluf D, Berger J, Ring J. Epidemiology of acne in the general population: The risk of smoking. Br J Dermatol 2001;145(1):100-4.
Seirafi H, Farnaghi F, Vasheghani-Farahani A, Alirezaie NS, Esfahanian F, Firooz A, et al. Assessment of androgens in women with adult-onset acne. Int J Dermatol 2007; 46(11):1188-91.
SelcenD,Seidman S, NigroMA.Otocerebralanomaliesassociatedwithtopicaltretinoin use. Brain Dev 2000;22(4):218-20.
Shahlita AR, Smith EB, Bauer E. Topical erythromycin v clindamycin therapy for acne. A multicenter, double-blind comparison. Arch Dermatol 1984;120(3):351-5.
Shalita AR. Treatment of mild and moderate acne vulgaris with salicylic acid in an alcohol-detergent vehicle. Cutis 1981;28(5):556-8561.
Shalita AR. Comparison of a salicylic acid cleanser and a benzoyl peroxide wash in the treatment of acne vulgaris. Clin Ther 1989;11(2):264-7.
Shalita AR, Smith JG, Parish LC, Sofman MS, Chalker DK. Topical nicotinamide compared with clindamycin gel in the treatment of inflammatory acne vulgaris. Int J Dermatol 1995;34(6):434-7.
Shalita AR, Chalker DK, Griffith RF, Herbert AA, Hickman JG, Maloney JM, et al.
Tazarotene gel is safe and effective in the treatment of acne vulgaris: a multicenter, double-blind, vehicle-controlled study. Cutis 1999;63(6):349-54.
Sharquie KE, Al-Turfi IA, Al-Shimary WM. Treatment of acne vulgaris with 2% topical tea lotion. Saudi Med J 2006;27(1):83-5.
Shaughnessy KK, Bouchard SM, Mohr MR, Herre JM, Salkey KS. Minocycline-induced drug reaction with eosinophilia and systemic symptoms (DRESS) syndrome with persistent myocarditis. J Am Acad Dermatol 2010;62(2):315-8.
Shemer A, Shiri J, Mashiah J, Farhi R, Gupta AK. Topical minocycline foam for moderate to severe acne vulgaris: phase 2 randomized double-blind, vehicle-controlled study results. J Am Acad Dermatol 2016;74(6):1251-2.
Shuster S, Fisher GH, Harris E, Binnell D. The effect of skin disease on self image [proceedings]. Br J Dermatol 1978;99(Suppl. 16):18-9.
Simonart T. Newer approaches to the treatment of acne vulgaris. Am J Clin Dermatol 2012;13(6):357-64.
Skolnick JL, Stoler BS, Katz DB, Anderson WH. Rifampin, oral contraceptives, and preg¬nancy. JAMA 1976;236(12):1382.
Smith K, Leyden JJ. Safety of doxycycline and minocycline: A systematic review. Clin Ther 2005;27(9):1329-42.
Smith RN, Mann NJ, Braue A, Makelainen H, Varigos GA. A low-glycemic-load diet improves symptoms in acne vulgaris patients: a randomized controlled trial. Am J Clin Nutr 2007;86(1):107-15.
Smith RN, Mann NJ, Braue A, Makelainen H, Varigos GA. The effect of a high-protein,
low glycemic-load diet versus a conventional, high glycemic-load diet on bio¬chemical parameters associated with acne vulgaris: a randomized, investigator- masked, controlled trial. J Am Acad Dermatol 2007;57(2):247-56.
Smith R, Mann N, Makelainen H, Roper J, Braue A, Varigos G. A pilot study to determine
the short-term effects of a low glycemic load diet on hormonal markers of acne: A nonrandomized, parallel, controlled feeding trial. Mol Nutr Food Res 2008;52(6): 718¬26.
Spencer JP, Gonzalez III LS, Barnhart DJ. Medications in the breast-feeding mother. Am Fam Physician 2001;64(1):119-26.
Stainforth JM, Layton AM, Taylor JP, Cunliffe WJ. Isotretinoin for the treatment of acne vulgaris: which factors may predict the need for more than one course? Br J Dermatol 1993;129(3):297-301.
Strauss JS, Stranieri AM. Changes in long-term sebum production from isotretinoin therapy. J Am Acad Dermatol 1982;6(4 Pt 2 Suppl):751-6.
Strauss JS, Rapini RP, Shalita AR, Konecky E, Pochi PE, Comite H, et al. Isotretinoin therapy for acne: Results of a multicenter dose-response study. J Am Acad Dermatol 1984;10(3):490-6.
Strauss JS, Leyden JJ, Lucky AW, Lookingbill DP, Drake LA, Hanifin JM, et al. A randomized
trial of the efficacy of a new micronized formulation versus a standard formulation of isotretinoin in patients with severe recalcitrant nodular acne. J Am Acad Dermatol 2001;45(2):187-95.
Strauss JS, Krowchuk DP, Leyden JJ, Lucky AW, Shalita AR, Siegfried EC, et al. Guidelines of care for acne vulgaris management. J Am Acad Dermatol 2007;56(4):651-63.
Tan MH, Spencer JM, Pires LM, Ajmeri J, Skover G. The evaluation of aluminum oxide crystal microdermabrasion for photodamage. Dermatol Surg 2001;27(11):943-9. Tan J, Stein Gold L, Schlessinger J, Brodell R, Jones T, Cruz A, et al. Short-term combina- tion therapy and long¬term relapse prevention in the treatment of severe acne vulgaris. J Drugs Dermatol 2012;11(2):174-80.
Tan JK, Jones E, Allen E, Pripotnev S, Raza A, Wolfe B. Evaluation of essential clinical components and features of current acne global grading scales. J Am Acad Dermatol 2013;69(5):754-61.
Tan J, Humphrey S, Vender R, Barankin B, Gooderham M, Kerrouche N, et al.A treatment forsevere nodular acne: a randomized investigator-blinded, controlled, noninferiority trial comparing fixed-dose adapalene/benzoyl peroxide plus doxycycline vs. oral iso- tretinoin. Br J Dermatol 2014;171(6):1508-16.
Tanghetti E. The evolution of benzoyl peroxide therapy. Cutis 2008;82(5 Suppl):5-11.
Tarimci N, Sener S, Kilinc T. Topical sodium sulfacetamide/sulfur lotion. J Clin Pharm Ther 1997;22(4):301.
Thiboutot D. New treatments and therapeutic strategies for acne. Arch Fam Med 2000; 9:179¬87.
Thiboutot D. Acne: hormonal concepts and therapy. Clin Dermatol 2004;22(5):419-28.
Thiboutot D, Chen W. Update and future of hormonal therapy in acne. Dermatology 2003;206(1):57-67.
Thiboutot DM, Shalita AR, Yamauchi PS, Dawson C, Kerrouche N, Arsonnaud S, et al. Adapalene gel, 0.1%, as maintenance therapy for acne vulgaris: A randomized, controlled, investigator-blind follow-up of a recent combination study. Arch Dermatol 2006;142(5):597-602.
Timpatanapong P, Rojanasakul A. Hormonal profiles and prevalence of polycystic ovary syndrome in women with acne. J Dermatol 1997;24(4):223-9.
Toossi P, Farshchian M, Malekzad F, Mohtasham N, Kimyai-Asadi A. Subantimicrobial- dose doxycycline in the treatment of moderate facial acne. J Drugs Dermatol 2008; 7(12):1149- 52.
Torok HM, Pillai R. Safety and efficacy of micronized tretinoin gel (0.05%) in treating adolescent acne. J Drugs Dermatol 2011;10(6):647-52.
Trifu V, Tiplica GS, Naumescu E, Zalupca L, Moro L, Celasco G. Cortexolone 17alpha- propionate 1% cream, a new potent antiandrogen for topical treatment of acne vulgaris. A pilot randomized, double-blind comparative study vs. placebo and tre- tinoin 0.05% cream. Br J Dermatol 2011;165(1):177-83.
Tripathi SV, Gustafson CJ, Huang KE, Feldman SR. Side effects of common acne treat¬ments. Expert Opin Drug Saf 2013;12(1):39-51.
Trivedi MK, Shinkai K, Murase JE. A review of hormone-based therapies to treat adult acne vulgaris in women. Int J Womens Dermatol 2017;3:44-52.
Tschen EH, Katz HI, Jones TM, Monroe EW, Kraus SJ, Connolly MA, et al. A combination benzoyl peroxide and clindamycin topical gel compared with benzoyl peroxide, clindamycin phosphate, and vehicle in the treatment of acne vulgaris. Cutis 2001;67(2):165-9.
Tucker SB. Occupational tropical acne. Cutis 1983;31(1):79-81.
U.S. Food and Drug Administration. Transcripts from the Dermatologic Drugs Advisory Committee Meeting [Internet]. [accessed November 12, 2016]. Available from: http://www.fda.gov/ohrms/dockets/ac/accutane.htm; 2003.
U.S. National Library of Medicine. LactMed: A new NLM database on drugs and lacta- tion [Internet]. [accessed November 12, 2016]. Available from https://toxnet.nlm. nih.gov/newtoxnet/lactmed.htm; 2017.
Ullah G, Noor SM, Bhatti Z, Ahmad M, Bangash AR. Comparison of oral azithromycin with oral doxycycline in the treatment of acne vulgaris. J Ayub Med Coll Abbottabad 2014;26(1):64-7.
van Hoogdalem EJ. Transdermal absorption of topical anti-acne agents in man; review of clinical pharmacokinetic data. J Eur Acad Dermatol Venereol 1998;11(Suppl. 1): S13- 9 [discussion S28-19].
Wang XL, Wang HW, Zhang LL, Guo MX, Huang Z. Topical ALA PDT for the treatment of severe acne vulgaris. Photodiagnosis Photodyn Ther 2010;7(1):33-8.
Webster GF, Leyden JJ, Gross JA. Comparative pharmacokinetic profiles of a novel isotretinoin formulation (isotretinoin-Lidose) and the innovator isotretinoin formulation: a randomized, 4-treatment, crossover study. J Am Acad Dermatol 2013;69(5):762-7.
Wei B, Pang Y, Zhu H, Qu L, Xiao T, Wei HC, et al. The epidemiology of adolescent acne in North East China. J Eur Acad Dermatol Venereol 2010;24(8):953-7.
Weinstein M, Laxer R, Debosz J, Somers G. Doxycycline-induced cutaneous inflamma- tion with systemic symptoms in a patient with acne vulgaris. J Cutan Med Surg 2013;17(4):283-6.
Wenk RE, Gebhardt FC, Bhagavan BS, Lustgarten JA, McCarthy EF. Tetracycline- associated fatty liver of pregnancy, including possible pregnancy risk after chronic dermatologic use of tetracycline. J Reprod Med 1981;26(3):135-41.
Williams HC, Dellavalle RP, Garner S. Acne vulgaris. Lancet 2012;379(9813): 361-72.
Yentzer BA, Hick J, Reese EL, Uhas A, Feldman SR, Balkrishnan R. Acne vulgaris in the United States: a descriptive epidemiology. Cutis 2010;86(2):94-9.
Zaenglein AL, Shamban A, Webster G, Del Rosso J, Dover JS, Swinyer L, et al. A phase IV, open-label study evaluating the use of triple-combination therapy with minocycline HCl extended-release tablets, a topical antibiotic/retinoid preparation and benzoyl peroxide in patients with moderate to severe acne vulgaris. J Drugs Dermatol 2013;12(6):619-25.
Zaenglein AL, Pathy AL, Schlosser BJ, Alikhan A, Baldwin HE, Berson DS, et al. Guide¬lines of care for the management of acne vulgaris. J Am Acad Dermatol 2016; 74(5):945-73.
Zaveri NT. Green tea and its polyphenolic catechins: medicinal uses in cancer and noncancer applications. Life Sci 2006;78(18):2073-80.
Zech LA, Gross EG, Peck GL, Brewer HB. Changes in plasma cholesterol and triglyceride levels after treatment with oral isotretinoin. A prospective study. Arch Dermatol 1983;119(12):987-93.
Zeichner JA. Narrowband UV-B phototherapy for the treatment of acne vulgaris during pregnancy. Arch Dermatol 2011;147(5):537-9.
Zeitany AE, Bowers EV, Morrell DS. High-dose isotretinoin has lower impact on wallets: a cost analysis of dosing approaches. J Am Acad Dermatol 2016;74(1): 174-6.
Zhanel GG, Siemens S, Slayter K, Mandell L. Antibiotic and oral contraceptive drug interactions: is there a need for concern? Can J Infect Dis 1999;10(6):429-33.
Zouboulis CC, Derumeaux L, Decroix J, Maciejewska-Udziela B, Cambazard F, Stuhlert A. A multicentre, single-blind, randomized comparison of a fixed clindamycin phosphate/tretinoin gel formulation (Velac) applied once daily and a clindamycin lotion formulation (Dalacin T) applied twice daily in the topical treatment of acne vulgaris. Br J Dermatol 2000;143(3): 498-505.
Xem thêm: