Bài viết Tăng sinh Melanin và các chất điều hòa tính hiệu mới trong điều trị nám được dịch bởi Bác sĩ Phạm Tăng Tùng từ sách “ĐIỀU TRỊ NÁM Ở NGƯỜI CHÂU Á” của Masakazu Kawaguchi và Tamio Suzuki
1. GIỚI THIỆU
Nguyên nhân gây nám là do sự gia tăng lắng đọng melanin ở thượng bì. Rối loạn sắc tố này thường xuất hiện ở những phụ nữ da sẫm màu và trong giai đoạn sinh sản của họ. Tiếp xúc với tia UV, các yếu tố về hormone và mang thai là các yếu tố nguy cơ đã được biết có liên quan đến sự hình thành nám [1, 2].
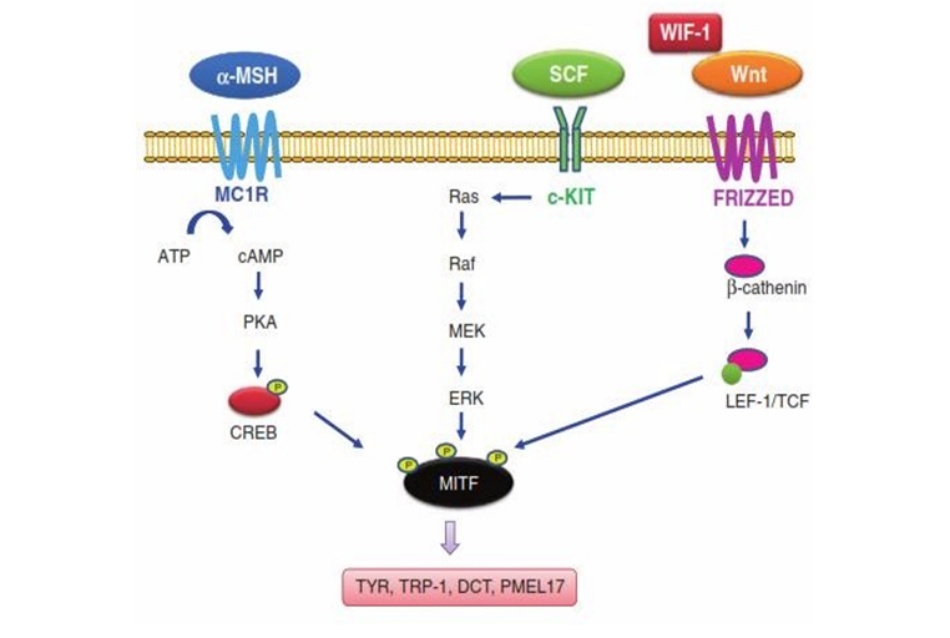
Melanin được tạo ra bởi melanocyte và được vận chuyển đến xung quanh các tế bào sừng (keratinocytes). Yếu tố phiên mã quan trọng nhất tham gia điều hòa chức năng tế bào melanocyte là microphthalmia transcription factor (MITF). Các gen mã hóa enzyme tyrosinase (TYR) (đây là emzyme chủ đạo của quá trình tổng hợp melanin), tyrosinase-related protein-1 (TRP-1), dopachrome tautomer- ase (DCT), và PMEL17 đóng vai trò trong các rối loạn tăng sắc tố và bị tác động bởi một số yếu tố. MITF đóng vai trò chính yếu trong điều hòa phiên mã của các gen này. Mức độ biểu hiện của MITF lại được điều hòa bởi rất nhiều yếu tố phiên mã, bao gồm lymphoid enhancer-binding factor 1 (LEF-1)/T-cell factor (TCF), là một chất điều hòa âm tính con đường tính hiệu Wnt-β-catenin, và bởi protein gắn yếu tố đắp ứng với cAMP (CREB). Có rất nhiều con đường tín hiệu tham gia điều hòa tyrosi- nase và MITF để kích thích tổng hợp melanogenesis. Sự hoạt hóa của thụ thể mela- nocortin-1 (MC1R) bởi chất đồng vận α-melanocyte-stimulating hormone (α-MSH) làm tăng sản xuất cAMP và đưa đến sự phosphoryl hóa của CREB. CREB khi được phosphoryl hóa sẽ tăng điều hòa phiên mã của rất nhiều gen khác nhau, bao gồm cả MITF. Yếu tố tế bào gốc (SCF, còn được gọi là KIT ligand) và thụ thể của nó c-KIT liên kết với con đường tín hiệu Ras-MAP kinase và điều hòa chức năng MITF thông qua quá trình phosphoryl hóa MITF [3] (hình 11.1). Gần đây, các cơ chế phân tử và tế bào mới trong các rối loạn sắc tố, bao gồm cả nám đã được xác định. Những cơ chế này gồm các yếu tố hormone sinh dục [4], RNA H19 không mã hóa [5], microRNAs (miRNA) [6, 7], và chất điều hòa con đường Wnt [8-10] (hình 11,2).
Bôi kem chống nắng bảo vệ da khỏi ánh sáng kết hợp với chất làm trắng đã được sử dụng để điều trị nám. Có rất nhiều chất làm trắng đã được biết rõ như hy- droquinone, arbutin, kojic acid, và ascorbic acid, những chất này làm giảm sắc tố bằng cách can thiệp vào một số quá trình liên quan tới sự tổng hợp melanin 3’-UTR (ví dụ: ức chế tăng sinh melanocyte, ức chế sự hoạt hóa và biểu hiệu của TYR, ức chế sự biểu hiện của MITF, và ức chế sự hình thành melanosome 5’-UTR). Những chất làm trắng này ít có hiệu quả và đôi lúc mang lại biến chứng nặng. Do đó, bắt buộc phải tìm ra được chất làm trắng hiệu quả hơn nhưng ít biến chứng hơn.

Thuốc điều trị đái tháo đường metformin [11] và thuốc ức chế bơm proton dạ dày omeprazole [12] làm giảm hàm lượng melanin lần lượt bằng cách làm giảm sự tích lũy cAMP và thoái hóa TYR.
Chúng tôi cũng đã phát hiện thấy các chất ức chế disintegrin và metallopro- tease (ADAM) làm giảm hàm lượng melanin bằng cách cắt đứt quá trình của pro- tein liên quan đến melanin PMEL17 [13]. PMEL17 (còn được gọi là gp100 và bạc) là một loại glycoprotein xuyên màng gắn melanin type I, có chức năng tạo ra một khung sợi nền để melanin có thể lắng đọng bên trong melanosome. Quá trình thủy phân protein PMEL17 là bắt buộc để tạo thành các sợi chức năng trong quá trình tổng hợp melanogenesis. Chúng tôi đã chứng minh rằng các chất ức chế ADAM cắt đứt quá trình hình thành của các vi sợi và sự tập hợp dải bên trong melanosome của các vi sợi này thông qua sự điều hòa của quá trình PMEL17. ADAM là một họ các enzyme thủy phân protein tham gia vào quá trình cắt đứt vùng ngoại bào của pro- tein màng (ectodomain shedding); các enzyme này đóng vai trò quan trọng trong nhiều quá trình chuyển hóa của tế bào [14, 15]. ADAM 17 đóng vai trò cực kì quan trọng trong quá trình ectodomain shedding của nhiều protein tan trong nước, bao gồm yếu tố hoại tử u alpha (TNF-α), KIT ligand và thụ thể của nó. Ở người, ADAM 17 là một gen tham gia vào quá trình điều hòa sắc tố ở người châu Á [16]. Đột biến ở ADAM 10 đã được xác định là nguyên nhân gây tăng sắc tố dạng lưới đầu chi Kita- mura (reticulate acropigmentation of Kitamura), bệnh lý đặc trưng bởi các dát tăng sắc tố hơi lõm, dạng lưới ở vùng mu bàn tay và bàn chân [17]. Vì các enzyme ADAM tham gia vào nhiều con đường truyền tin của quá trình điều hòa tăng sinh melanin, nên chúng có thể là một hoạt chất tiềm năng trong điều trị các rối loạn sắc tố.
Xác định các yếu tố tham gia vào sinh bệnh học có thể giúp nghiên cứu ra được các phương pháp điều trị nám mới.
2. PHƠI NHIỄM TIA UV VÀ MẤT CHỨC NĂNG HÀNG RÀO BẢO VỆ
Dựa trên những phân tích sao mã từ các mẫu da nám, người ta đã xác định được 279 gen điều hòa tăng cường và 152 gen điều hòa âm tính tham gia vào quá trình tổng hợp melanin [8]. Đúng như mong đợi, có sự gia tăng mức độ biểu hiện của các yếu tố liên quan đến quá trình tổng hợp melanin như TYR, TRP-1, DCT và MITF trong các tổn thương nám, điều này cho thấy hoạt động tăng sinh collagen cao hơn trong các tổn thương nám. Vì số lượng melanocyte không tăng lên, nên sự tăng sắc tố thượng bì chủ yếu là do sự tăng tổng hợp melanin trong các tế bào melano- cyte vùng nám và đây là cơ chế bệnh sinh chính của nám.
Một nghiên cứu phân tích thông tin sinh học xác nhận sự thay đổi đáng kể quá trình chuyển hóa lipid trong nám. Gen chuyển hóa lipid như peroxisome proliferator-activated receptor alpha (PPARA), PPAR gamma coactivator 1 alpha (PPARGC1A), arachidonate 15-lipoxygenase, type B (ALOX15B), và diacylglycerol O-acyltransferase 2-like 3 (DGAT2L3) đã được xác định là các gen điều hòa âm tính quá trình tổng hợp melanin. Chúng ta đã biết rằng chuyển hóa lipid của các tế bào lớp sừng đóng vai trò quan trọng trong quá trình ổn định hàng rào da. Điểm thú vị đó là chức năng của hàng rào da trong các vùng da nám bị tổn thương so với vùng da xung quanh [8, 18]; ở những vùng da này lớp tế bào sừng thường mỏng và có tốc độ phục hồi chậm hơn.
Tia UV có thể đóng vai trò chính trong sự hình thành nám dựa vào vị trí nám và hiện tượng nám nặng hơn sau khi phơi bày với ánh sáng mặt trời. Hơn nữa, tiếp xúc lâu dài với tia UV sẽ ảnh hưởng đến chuyển hóa acid béo và chức năng hàng rào bảo vệ của da [19]. Acid béo tự do và triglycerides trên thượng bì của vùng da lão hóa ánh sáng hoặc vùng mới bị chiếu UV có sự sụt giảm đáng kể [20]. Mức độ biểu hiện của các gen liên quan đến quá trình tổng hợp lipid bao gồm cả PPAR cũng giảm đáng kể [20]. Hoạt hóa phối tử (ligand) của PPARs sẽ kích thích sự thay đổi, bao gồm tích lũy lipid, và tăng tái sinh hàng rào thượng bì trong tế bào sừng; do đó, PPAR là yếu tố điều hòa quan trọng của quá trình chuyển hóa lipib thông qua các acid béo [21]. Do đó, sự phá hủy chức năng hàng rào bảo vệ do tia UV có thể là yếu tố sinh bệnh học của nám.
3. TÍN HIỆU Wnt
Mặc dù ảnh hưởng của phơi nhiễm tia UV đã được biết đến, tuy nhiên cơ chế tăng sắc tố do tia UV có thể không giống với tăng sắc tố gây ra bởi các nguyên nhân khác. Ngoài ra tia UV có thể không là yếu tố cần thiết khiến nám hình thành. Yếu tố ức chế Wnt -1 (WIF-1) đã được xác định [9] như là một yếu tố tham gia vào sinh bệnh học của nám, và sự biểu hiện của nó không có gì thay đổi sau khi tiếp xúc với tia UV. WIF-1 là một chất đối vận của tín hiệu Wnt; nó ức chế con đường truyền tin Wnt bằng cách gắn trực tiếp vào phối tử Wnt và ngăn phối tử này gắn với receptor bề mặt của tế bào.
Các con đường truyền tin Wnt chính thống và không chính thống đóng vai trò quan trọng trong quá trình sinh tổng hợp melanin. Trong con đường Wnt chính thống, Wnts ngăn chặn sự thoái hóa của β-catein, nhân tố này thúc đẩy vận chuyển chất qua màng nhân tế bào từ đó thúc đẩy quá trình phiên mã yếu tố MITF. WIF-1 làm mờ tổn thương nám và biểu hiện trong cả tế bào sừng và nguyên bào sợi bình thường được nuôi cấy, nhưng không biểu hiện ở trong tế bào melanocytes. WIF-1 điều hòa âm tính sự biểu hiện của TYR (tyrosinase) và quá trình vận chuyển mela- nosome khi nuôi cấy chung tế bào sừng và melanocyte. Bằng cách tái tổ hợp WIF-1 vào môi trường nuôi cấy đồng thời của hai loại tế bào này, thì sự biểu hiện của TYR cũng như sự biểu hiện của MITF giảm đáng kể. Tuy nhiên, một báo cáo khác lại cho rằng WIF-1 và các chất điều biến con đường tín hiệu Wnt khác như Wnt5a là những chất điều hòa tăng cường nám dựa vào phân tích microarray [8]. Hiện nay, sự giảm biểu hiện của WIF-1 có liên quan đến sự hình thành của nám thông qua quá trình kích thích tăng sinh melanin và vận chuyển melanosome khi có sự hoạt hóa con đường tín hiệu Wnt.
4. HORMONE SINH DỤC NỮ
Vì mang thai và những thay đổi hormone tử cung và buồng trứng là các yếu tố nguy cơ của nám, nên các hormone sinh dục nữ estrogen và progesterone được cho là có liên quan đến hiện tượng tăng sắc tố trong nám [2]. Estrogen kích thích tăng sinh melanin ở các tế bào melanocyte người bằng cách tăng tổng hợp enzyme sản xuất melanin, và các tế bào melanocytes đồng thời cũng biểu hiện thụ thể của estrogen [4]. Một phân tích hóa mô miễn dịch đã cho thấy mức độ biểu hiện của thụ thể estrogen và progesterone tăng ở vùng da bị nám [22, 23].
Gần đây, dựa trên một phân tích microarray, người ta đã phát hiện có sự tăng điều hòa của PDZ protein kidney 1 (PDZK1) trong các tổn thương tăng sắc tố ở các bệnh nhân nám [4]. PDZK1 là một thành viên của gia đình các yếu tố điều hòa trao đổi muối nước (NHERF). NHERF có miền gắn PDZ, miền này là nơi xảy ra tương tác protein-protein và gắn với kênh vận chuyển ion. Estrogen làm tăng sự biểu hiện của MITF và TYR thông qua PDZK1 trong melanocyte. Cắt giảm PDZK1 làm giảm sự biểu hiện của TYR do estrogen. Sự biểu hiện quá mức của PDZK1 sẽ làm tăng sự biểu hiện TYR (do estrogen) cùng với sự tăng biểu hiện của ER-α và ER-β (thụ thể estrogen). PDZK1 cũng tăng cường sự biểu hiện của một số kênh vận chuyển ion như kênh protein trao đổi muối-nước (NHE), cystic fibrosis transmembrane conductance regulator (CFTR), và SLC26A3. Những kênh vận chuyển này được tăng cường bởi estrogen và chất ức chế đặc hiệu của các protein vận chuyển này sẽ ức chế được sự biểu hiện của TYR. Điều thú vị là sự tăng cường PDZK1 kích thích vận chuyển melanosome vào tế bào sừng bất kể sự biểu hiện của proteases-activated receptor-2 (PER-2) (thụ thể tham gia vận chuyển melanosome). PDZK1 đã được xem như là một yếu tố quan trọng liên quan đến sự hình thành sắc tố trong nám và có mối liên hệ mật thiết với estrogen.
5. CÁC MicroRNA VÀ MỤC TIÊU CỦA CHÚNG
Các miRNA đã được xác định là những nhân tố mới trong sinh bệnh học của nám. Sự giảm biểu hiện của RNA H19 không mã hóa đã được phát hiện trong vùng da tăng sắc tố của bệnh nhân nám, nhưng không thấy ở vùng da tăng sắc tố do phơi nhiễm tia UV trong các phân tích microarray [5]. Các RNA không mã hóa đóng vai trò quan trọng trong điều hòa biểu hiện của các gen. Trong một thí nghiệm tìm hiểu cơ chế giảm biểu hiện của H19 trong nám, một miRNA đã được xác định như là mục tiêu của H19 trong quá trình tăng sinh melanin [6]. Các miRNA rất nhỏ, từ 20-24 nucle- otide, và hiện diện như là các RNAs không mã hóa. Chúng gắn vào đầu 3’ không mã hóa của mRNA theo dạng chuỗi đặc trung và ức chế dịch mã hoặc thúc đẩy sự thoái hóa của mRNA, do đó chúng đóng vai trò quan trọng trong quá trình điều hòa sau phiên mã của quá trình biểu hiện gen [24].
Giảm hoạt H19 làm giảm mức độ biểu hiện của miR-675 trong tế bào sừng, nhưng không thấy trong melanocytes hoặc nguyên bào sợi. Ngoài ra, biểu hiện quá mức miR-675 sẽ làm giảm sự biểu hiện của TYR và TRP-1, trong khi đó yếu tố ức chế miR-675 sẽ làm tăng sự biểu hiện của TYR và TRP-1 trong môi trường nuôi cấy đồng thời melanocyte và tế bào sừng. Do mức độ biểu hiện của mỉ-675 có liên quan đến H19 có trong tế bào sừng mà không có trong melanocyte, nên miR-675 được cho là tạo ra từ tế bào sừng. Exosome là các túi ngoại bào có nguồn gốc từ hệ thống mạng lưới nội chất được tạo ra từ các tế bào sống đi vào môi trường ngoại bào. Exo- some có thể được tạo ra từ nhiều loại tế bào khác nhau, kể cả tế bào ung thư cũng như tế bào thường và chứa rất nhiều loại protein tế bào khác nhau như phân tử MHC, các phân tử kết dính (adhesion molecule) và miRNA. Sự dịch chuyển của các miRNA trong exosome sang các tế bào nhận được cho là phương tiện giao tiếp liên tế bào (tế bào-tế bào), tương tự miR-675 có thể được tiết ra từ tế bào sừng thông qua exosome và điều hòa quá trình sinh tổng hợp bên trong melanocyte. Một phân tích microarray đã cho thấy MITF là mục tiêu của miR-675, nó ức chế sự biểu hiện mRNA của MITF bằng cách gắn vào đầu 3’-UTR (đầu không mã hóa).
Cadherin 11 (Cad-11) là một đích khác của miR-675 [7]. miR-675 cũng ức chế sự biểu hiện của Cad-11 bằng cách gắn vào đầu 3’-UTR. Sự tăng biểu hiện của Cad- 11 cũng được quan sát thấy trong các vùng da tăng sắc tố ở bệnh nhân nám, điều này cho thấy vài trò của Cad-11 trong nám. Cad-11 điều hòa sự di cư của nguyên bào sợi và hàm lượng β-caroten ở da, cả hai yếu tố này đều đóng vai trò quan trọng trong sự hình thành mô sơ [25]. Mặc dù sự biểu hiện của Cad-11 không phát hiện được trong melanocyte, nhưng Cad-11 trong nguyên bào sợi hoặc keratinocytes sẽ kích thích quá trình sinh tổng hợp melanin, làm tăng sự biểu hiện của β-caroten và Wnt, cũng như thúc đẩy sự di cư của tế bào melanocyte.
Sự biểu hiện quá mức của miR-675 trong tế bào da chuột được tạo ra bằng cách cấy nucleic acid (transfection reagent) đã làm giảm sự biểu hiện các gen tham gia sinh tổng hợp melanin [6]. miRNA trong exosome có khả năng đề kháng với liệu pháp RNase (enzyme thủy phân ribonuclease) và miR-675 có thể trở thành liệu pháp trúng đích tiềm năng trong điều trị nám.
6. KẾT LUẬN
Trong bài tổng quan này, chúng tôi tóm tắt những hiểu biết hiện có về cơ chế hình thành nám. Các chất điều hòa nám mới như RNA H19 không mã hóa, WIF-1, microRNA, và PDZK1 đã được xác định gần đây. Ngoài ra, Cad-11 được xem là một chất điều hòa quan trọng của nám, và việc ức chế chức năng của Cad-11 có thể là một phương pháp điều trị tiềm nang đối với nám.
Nắm được sinh bệnh học của nám có thể giúp đưa ra những lựa chọn điều trị mới cho vấn đề này.
7. TÀI LIỆU THAM KHẢO
- Ortonne JP, Arellano I, Berneburg M, Cestari T, Chan H, Grimes P, et al. A global survey of the role of ultraviolet radiation and hormonal influences in the develop- ment of melasma. J Eur Acad Dermatol 2009;23:1254–62.
- Lee Recent progress in melasma pathogenesis. Pigment Cell Melanoma Res. 2015;28(6): 648–60.
- Yamaguchi Y, Hearing VJ. Physiological factors that regulate skin pigmentation. Biofactors. 2009;35:193–9.
- Kim NH, Cheong KA, Lee TR, Lee PDZK1 upregulation in estrogen-related hyperpigmentation in melasma. J Invest Dermatol. 2012;132:2622–31.
- Kim NH, Lee CH, Lee H19 RNA downregulation stimulated melanogenesis in melasma. Pigment Cell Melanoma Res. 2009;23:84–92.
- Kim NH, Choi SH, Kim CH, Lee CH, Lee TR, Lee Reduced MiR-675 in exosome in H19 RNA-related melanogenesis via MITF as a direct target. J Invest Dermatol. 2014;134: 1075–82.
- Kim NH, Choi SH, Lee TR, Lee CH, Lee Cadherin 11, a miR-675 target, induces N-cadherin expression and epithelial-mesenchymal transition in melasma. J Invest Dermatol. 2014;134:2967–76.
- Kang HY, Suzuki I, Lee DJ, Ha J, Reiniche P, Aubert J, et al. Transcriptional pro- filing shows altered expression of wnt pathway- and lipid metabolism-related genes as well as melanogenesis- related genes in melasma. J Invest 2011;131:1692–700.
- Kim JY, Lee TR, Lee Reduced WIF-1 expression stimulates skin hyperpigmen- tation in patients with melasma. J Invest Dermatol. 2013;133:191–200.
- Park TJ, Kim M, Kim H, Park SY, Park KC, Ortonne JP, et al. Wnt inhibitory fac- tor (WIF)-1 promotes melanogenesis in normal human melanocytes. Pigment Cell Melanoma Res. 2014;27:72–81.
- Lehraiki A, Abbe P, Cerezo M, Rouaud F, Regazzetti C, Chignon-Sicard B, et Inhibition of melanogenesis by the antidiabetic metformin. J Invest Dermatol. 2014;134:2589–97.
- Matsui MS, Petris MJ, Niki Y, Karaman-Jurukovska N, Muizzuddin N, Ichihashi M, et al. Omeprazole, a gastric proton pump inhibitor, inhibits melanogenesis by blocking ATP7A J Invest Dermatol. 2015;135:834–41.
- Kawaguchi M, Hozumi Y, Suzuki ADAM protease inhibitors reduce melano- genesis by regulating PMEL17 processing in human melanocytes. J Dermatol Sci. 2015;78:133–42.
- Schlöndorff J, Blobel Metalloprotease-disintegrins: modular proteins capa- ble of promoting cell-cell interactions and triggering signals by protein-ectodomain shedding. J Cell Sci. 1999;112:3603–17.
- Edwards DR, Handsley MM, Pennington CJ. The ADAM Mol Aspects Med. 2008;29:258– 16.McEvoy B, Beleza S, Shriver MD.M The genetic ar- chitecture of normal variation.
Tham khảo thêm một số bài viết cùng chủ đề