Bài viết Cập nhật về nám da và các phác đồ điều trị nám da hiệu quả – Tải file PDF Tại đây.
Tác giả: Ana Claudia C. Esposito; Daniel P. Cassiano; Carolina N. da Silva; Paula B. Lima; Joana A. F. Dias; Karime Hassun; Edile ́ia Bagatin; Luciane D. B. Miot; Helio Amante Miot
Dịch: Bs. Trương Tấn Minh Vũ
TÓM TẮT
Nám da là một rối loạn sắc tố tái phát mãn tính phổ biến, ảnh hưởng đến các vùng da tiếp xúc với ánh sáng, đặc biệt là ở phụ nữ trong độ tuổi sinh sản. Mặc dù hiện tại không có phương pháp điều trị dứt điểm cho nám da, nhưng bài này đánh giá nghiêm túc các kiến thức về bảo vệ da chống lại ánh sáng, các liệu pháp bôi tại chỗ và uống, và các quy trình như lột da, laser và vi kim đại diện cho các chiến lược chính để kiểm soát và phòng ngừa bệnh này. Vì cơ chế bệnh sinh của nám chưa được hiểu rõ hoàn toàn nên có khả năng phát triển các chiến lược điều trị mới có thể tác động trên các con đường thúc đẩy sắc tố bền vững thay vì chỉ làm giảm tổng hợp melanin và loại bỏ melanin khỏi lớp biểu bì.
GIỚI THIỆU
Nám da ảnh hưởng đến các vùng da tiếp xúc với ánh sáng, đặc biệt là ở phụ nữ trong độ tuổi sinh sản, nhưng không có phương pháp điều trị dứt điểm, ảnh hưởng đáng kể đến chất lượng cuộc sống, bao gồm sự tự tin thấp dẫn đến các vấn đề xã hội, lo âu và các triệu chứng trầm cảm [1–3]. Trong khi nám do mang thai hoặc do thuốc nhạy cảm với ánh sáng có kết quả tốt hơn sau khi yếu tố gây bệnh chấm dứt, hầu hết bệnh nhân đều gặp phải tình trạng rối loạn mãn tính, thay đổi theo mùa và tái phát sau khi điều trị thành công, cần duy trì sau điều trị. Nói chung, nám mờ dần theo tuổi tác và biến mất ở hầu hết phụ nữ sau thời kỳ mãn kinh, mặc dù nám ở vị trí ngoài mặt có thể tồn tại lâu hơn [4, 5]. Mặc dù tỷ lệ nám da cao và có nhiều phương pháp điều trị khác nhau, nhưng có rất ít thử nghiệm ngẫu nhiên có đối chứng trên mẫu lớn để hỗ trợ mạnh hệ thống phân cấp điều trị. Đánh giá này nhằm mục đích trình bày và thảo luận nghiêm túc về các chiến lược điều trị chính cho nám da.
CHỐNG NẮNG
Cùng với việc mang thai, tiếp xúc trực tiếp với ánh nắng mặt trời là yếu tố nguy cơ hàng đầu gây nám, được báo cáo bởi 27–51% bệnh nhân như là yếu tố kích thích và 84% như là yếu tố gây tổn thương lâm sàng [6, 7]. Bệnh nhân bị nám thường báo cáo tiếp xúc với ánh nắng mặt trời do nghề nghiệp hoặc cố ý. Do đó, các biện pháp chống nắng nghiêm ngặt nên được khuyến cáo có điều kiện đối với bất kỳ bệnh nhân nào được điều trị và duy trì sau điều trị.
Vì sự hình thành melanin trong nám có thể được gây ra bởi tia UVB, UVA hoặc ánh sáng nhìn thấy có bước sóng ngắn (visible light, VL), bệnh nhân bị nám phải nhận thức được loại ánh nắng mặt trời trong các tình huống thông thường hàng ngày. Một lượng lớn ánh sáng tiếp xúc với da ngay cả trong bóng râm hoặc gần cửa sổ, vì UVA và VL xuyên qua kính chắn gió và kính cửa sổ. Hơn nữa, các bước sóng này xuất hiện ở mức độ sinh melanin từ 08:30 đến 17:30 ở các vùng nhiệt đới [8, 9].
Vì hầu hết các loại kem chống nắng hoạt động dưới hiệu quả trong thực tế do lượng sản phẩm được sử dụng ít hoặc không đủ số lần bôi lại, đặc biệt là bảo vệ khỏi tia UVA và VL, việc đo lường hành vi và nhận thức về việc tiếp xúc với ánh nắng mặt trời nên được củng cố đối với bệnh nhân bị nám [10–12]. Ngoài ra, những người da sẫm màu ít tuân thủ việc chống nắng thường xuyên, sử dụng kem chống nắng và bôi lại, mặc dù họ bị ảnh hưởng bởi nám nhiều hơn những người da trắng, do đó cản trở hiệu quả điều trị [13].
Trong đo lường hành vi chống nắng, bôi kem chống nắng tại chỗ đóng một vai trò quan trọng trong điều trị nám và nên được điều chỉnh để đạt hiệu quả tốt nhất trong các rối loạn sắc tố [14]. Tuy nhiên, các thành phần bảo vệ khỏi ánh sáng được sử dụng trong kem chống nắng bôi thương mại rất khác nhau giữa các quốc gia do các quy định khác nhau từ các cơ quan y tế.
Khả năng chống tia UVB của kem chống nắng được xác định trên toàn thế giới bởi hệ số chống nắng in vivo (sun protection factor, SPF). Đối với các hoạt động hàng ngày, kem chống nắng SPF-30 có thể ngăn ngừa ban đỏ và lão hóa da [15, 16]. Tuy nhiên, hầu hết bệnh nhân thường thoa 50% lượng kem chống nắng tại chỗ được khuyến nghị trên da, vì vậy các sản phẩm có chỉ số SPF cao hơn (ví dụ: ≥ 50) được khuyến cáo cho bệnh nhân bị rối loạn sắc tố [17].
Bức xạ UVA có khả năng sinh melanin cao và đạt mức cao vào sáng sớm (ngay cả trong những ngày nhiều mây), xuyên qua kính thông thường, nhưng không gây ban đỏ. UVA là dải sóng chính cần được chú ý trong điều trị nám và duy trì sau điều trị. Khả năng bảo vệ chống lại tia UVA thường được xác định bởi yếu tố tối màu da kéo dài do sắc tố (persistent pigment darkening, PPD) in vivo. Tuy nhiên, các cơ quan quản lý khác nhau sử dụng các thuật ngữ khác nhau cho khả năng bảo vệ khỏi tia UVA [15]. Do để đạt được các giá trị PPD cao làm ảnh hưởng đến tính chất thẩm mỹ của kem chống nắng bôi tại chỗ, phạm vi PPD từ 20– 30 được chỉ định trong các rối loạn sắc tố để đảm bảo sự tuân thủ của bệnh nhân.
Mặc dù bức xạ VL (đặc biệt là trong phạm vi ánh sáng màu xanh-tím năng lượng cao) có thể gây ra sự hình thành melanin, nhưng vẫn chưa có phương pháp xác thực nào để đánh giá hiệu quả của kem chống nắng bảo vệ chống lại dải sóng này [15, 18]. Kem chống nắng có màu được chỉ định để bảo vệ chống lại VL, trong khi muối oxit sắt dường như mang lại hiệu quả tốt hơn trong nám. Hơn nữa, mặc dù nhiệt độ cao dẫn đến sự hình thành melanin, nhưng không có nghiên cứu hệ thống nào về bức xạ nhiệt mặt trời (bức xạ hồng ngoại, IR) trong nám da, cũng như không có các phương pháp được kiểm chứng để đánh giá khả năng bảo vệ khỏi tia hồng ngoại. Do đó, những người lao động phải tiếp xúc với nhiệt độ cao như đầu bếp, thợ làm bánh, thợ luyện kim, thợ làm thủy tinh và lái xe nên được thông báo về vai trò của nhiệt độ cao đối với tình trạng nám mãn tính.
Mặc dù tầm quan trọng của việc chống nắng trong điều trị nám, một số nghiên cứu có hệ thống nghiên cứu kem chống nắng trong điều trị và ngăn ngừa tái phát nám. Việc đánh giá các nhóm giả dược trong các thử nghiệm đối chứng ngẫu nhiên về nám cho phép đo lường hiệu quả của kem chống nắng có màu phổ rộng, ước tính 10–20% diện tích nám và giảm chỉ số mức độ nghiêm trọng (MASI) trong 8 tuần [19]. Sau 12 tuần sử dụng kem chống nắng phổ rộng (SPF19, PA+++), chỉ số MASI giảm 26,9% [20]. Đáng chú ý, việc sử dụng kem chống nắng phổ rộng có màu (với oxit sắt) làm giảm tái phát nám sau điều trị ở 39 phụ nữ Pháp [21].
Liên quan đến nhóm dân số có nguy cơ cao, 200 phụ nữ từ Marốc trong thời kỳ đầu mang thai được khuyến khích sử dụng kem chống nắng phổ rộng (SPF 69, PPD 28). Tỷ lệ nám da là 2,7% sau 12 tháng theo dõi, thấp hơn dự kiến (53%) trong nhóm dân số có nguy cơ cao này [22]. Thêm nữa, 68 bệnh nhân Mexico bị nám bôi hydroquinone (HQ) 4% tại chỗ trong 8 tuần; tuy nhiên, họ được chọn ngẫu nhiên để sử dụng kem chống nắng SPF-50 thông thường hoặc kem chống nắng có màu phổ rộng với oxit sắt, giúp tăng cường khả năng bảo vệ khỏi tia UVA và VL. Mức giảm trung bình của MASI là 62% đối với nhóm kem chống nắng thông thường và 78% đối với kem chống nắng phổ rộng và VL [23].
Mỹ phẩm trang điểm có thể được khuyên dùng để ngụy trang cho vết nám. Tuy nhiên, khả năng bảo vệ khỏi ánh nắng của các sản phẩm đa chức năng (ví dụ: kem dưỡng ẩm, phấn phủ) không tốt bằng khả năng bảo vệ của kem chống nắng tại chỗ tiêu chuẩn, nên được bôi dưới lớp trang điểm. Thật sự, vẫn chưa có bằng chứng chắc chắn nào cho thấy việc bổ sung các chất chống oxy hóa tại chỗ (vitamin C, vitamin E, Polypodium leucAtomos…) hoặc các chất làm giảm sắc tố (butylresorcinol, glabridin) vào thành phần của kem chống nắng bôi tại chỗ làm tăng hiệu quả của các phương pháp điều trị nám [17]. Do đó, vai trò của chất chống oxy hóa đường uống (được hiểu sai là “chất chống nắng đường uống”) cũng được thảo luận dưới đây.
Cuối cùng, một số mỹ phẩm, thuốc nhạy cảm với ánh sáng (ví dụ: phenothiazin, sulfonamid, sulfonylurea, thuốc lợi tiểu thiazide, tetracycline, thuốc chống trầm cảm ba vòng, promethazine, piroxicam) và hormone steroid (ví dụ: thuốc tránh thai, liệu pháp thay thế estrogen) làm tăng tác động tạo melanin của việc tiếp xúc ánh nắng mặt trời và nên được thay thế để có thể điều trị nám thành công [24–27]. Vì nám da có nền tảng di truyền rõ ràng, nên áp dụng các biện pháp phòng ngừa như chống nắng và tránh dùng thuốc tránh thai ở những nữ vị thành niên trong gia đình có người bị nám da [28].
ĐIỀU TRỊ TẠI CHỖ
Hydroquinone và thuốc ba thành phần
HQ là một hợp chất phenolic có đặc tính chống oxy hóa can thiệp vào quá trình hình thành melanin bằng cách ức chế tyrosinase. Nó cũng ức chế quá trình tổng hợp DNA và RNA và có thể làm thay đổi sự hình thành của melanosome, gây tổn thương có chọn lọc đối với melanocyte. Những đặc tính này ức chế quá trình trao đổi chất của melanocyte, làm giảm dần quá trình sản xuất melanin. Hiệu quả và độc tính của HQ bôi tại chỗ phụ thuộc vào nồng độ, chất vận chuyển và độ ổn định hóa học của sản phẩm cuối cùng.
Các công ty dược ở Hoa Kỳ có thể tạo ra HQ tới 12%; các sản phẩm HQ không kê đơn (3% và 2%) không còn có sẵn nữa. Nói chung, HQ được sử dụng dưới dạng kem 2–5% và có thể bôi hai lần một ngày khi bắt đầu trị liệu, nhưng thường được kê đơn sử dụng trước khi đi ngủ. Hiệu quả giảm sắc tố có thể được nhìn thấy sau 5–8 tuần và việc điều trị có thể được tiếp tục trong tối đa 1 năm [29]. Trong nám da, mức giảm trung bình của MASI sửa đổi (mMASI) khi điều trị bằng kem chống nắng phổ rộng và HQ 4% tại chỗ dự kiến là 30–40% sau 8 tuần và 45–55% sau 16 tuần [30, 31].
Hiệu quả của HQ được tối ưu hóa khi kết hợp với retinoids và corticosteroid tại chỗ. Năm 1975, Kligman và Willis mô tả việc sử dụng kết hợp tretinoin 0,1%, HQ 5% và dexamethasone 0,1% trong việc làm sáng da [32]. Hiện tại, sự kết hợp tretinoin 0,05% với HQ 4% và fluocinolone acetonide 0,01% (triple combination, TC) được coi là phương pháp điều trị tại chỗ tiêu chuẩn vàng cho nám nhờ tác dụng làm trắng nhanh và mạnh [33, 34]. Các đo lường về hiệu quả và an toàn chỉ ra rằng nên sử dụng TC không liên tục trong tối đa 6 tháng. Đối với nám da, giảm mMASI bằng cách điều trị bằng kem chống nắng phổ rộng và TC tại chỗ dự kiến là 30–40% sau 8 tuần và 50–60% trong 16 tuần [35–37].
Việc sử dụng HQ và TC có thể gây ra các tác dụng phụ, như viêm da tiếp xúc dị ứng và kích ứng, mảng trắng da giống hoa giấy, ban đỏ và giãn mạch. Ochronosis ngoại sinh đã được báo cáo do sử dụng HQ nồng độ cao kéo dài. Mặc dù HQ bôi ngoài da đã bị cấm ở một số quốc gia, nhưng không có bằng chứng đáng kể nào về rủi ro từ việc sử dụng bôi ngoài da để điều trị nám. Tuy nhiên, cả HQ và tretinoin đều không nên được sử dụng trong thai kỳ [38–40].
Azelaic acid
Azelaic acid, hay 9-cacbonodicarboxilic acid, là một hợp chất không chứa phenolic có nguồn gốc từ nấm men Pityrosporum ovale, là một chất ức chế yếu tyrosinase của các melanocyte và các oxyoreductase của ty thể, làm giảm quá trình tổng hợp DNA của các melanocyte bình thường và tăng chức năng. Azelaic acid an toàn khi sử dụng cho bệnh nhân mang thai và cho con bú và thường được dung nạp tốt vì cảm giác châm chích và ngứa sau khi bôi thuốc sẽ biến mất trong vài phút. Azelaic acid thường được sử dụng dưới dạng kem 20% hai lần mỗi ngày để điều trị nám, giảm 50% MASI sau 8 tuần [41].
Niacinamide
Niacinamide, hay nicotinamide, là một dạng hoạt tính sinh học của niacin (vitamin B3) được tìm thấy trong rễ của nhiều loại rau và nấm men, là tiền chất thiết yếu của các coenzym như các phân tử nicotinamide adenine dinucleotide (NADH) và nicotinamide adenine dinucleophosphate (NADPH) với tác dụng chống oxy hóa mạnh [42]. Các nghiên cứu in vitro chỉ ra rằng niacinamide làm giảm đáng kể quá trình chuyển giao melanosome sang keratinocyte, can thiệp vào con đường truyền tín hiệu tế bào giữa keratinocyte và melanocyte, làm giảm quá trình tạo melanin [43]. Niacinamide bôi tại chỗ giúp ổn định chức năng hàng rào biểu bì bằng cách tăng tổng hợp protein và ceramide và biệt hóa keratinocyte, cải thiện tình trạng vi mô của da và làm mờ các nếp nhăn nhỏ. Hơn nữa, nó thúc đẩy tác dụng chống viêm trên da [44]. Niacinamide an toàn khi sử dụng cho bệnh nhân mang thai và cho con bú và thường được bôi đơn lẻ dưới dạng kem 4–5% hai lần mỗi ngày hoặc kết hợp với các chất làm sáng da khác, chẳng hạn như kojic acid và arbutin. Đối với nám da, niacinamide 4% giúp giảm 62% hemi-MASI (hMASI) sau 8 tuần [45].
Cysteamine
L-Cysteamine là một hợp chất aminothiol có đặc tính chống oxy hóa và giảm sắc tố do ức chế enzyme peroxidase và tyrosinase, hoạt động như một chất liên kết của sắt và đồng và làm tăng nồng độ glutathione nội bào. L-Cysteamine có thể được tìm thấy tự nhiên như một sản phẩm thoái hóa nội bào của L-cysteine.
Hai nghiên cứu ngẫu nhiên, mù đôi, có đối chứng với giả dược với 50 và 53 người tham gia thử nghiệm thoa một lớp mỏng kem cysteamine 5% lên mặt vào ban đêm, để đến 3 giờ trong 16 tuần, đạt được mức giảm MASI 50% và tương ứng là 59% [46, 47]. Thêm nữa, một thử nghiệm lâm sàng ngẫu nhiên, đánh giá mù gồm 40 phụ nữ Brazil bị nám da mặt sử dụng kem chống nắng có màu phổ rộng và thoa cysteamine 5% hoặc HQ 4% hàng đêm trong 16 tuần giúp giảm MASI 32% và 52%. tương ứng [31]. Một so sánh khác về cysteamine và HQ 4% trong 16 tuần ở Úc cho kết quả giảm mMASI lần lượt là 21% và 32% [48]. Thêm nữa, trong một thử nghiệm ngẫu nhiên trên 50 phụ nữ bị nám, cysteamine 5% được so sánh với kem TC (HQ 4%, axit retinoic 0,05% và betamethasone 0,1%) trong 16 tuần, đạt được mức giảm MASI lần lượt là 51% và 42% tương ứng.
Thiamidol
Thiamidol (isobutylamido thiazolyl resorcinol) là một chất ức chế tyrosinase mới, mạnh được chứng minh là có thể ngăn ngừa tăng sắc tố da do tia UVB gây ra [49]. Sau 24 tuần dùng thiamidol 0,2% bôi hai lần mỗi ngày, 23 phụ nữ bị nám da mặt đã giảm được MASI trung bình là 26%. Một thử nghiệm đối chứng ngẫu nhiên gồm 50 phụ nữ Brazil bị nám so sánh việc bôi hai lớp thiamidol 0,2% hai lần mỗi ngày so với HQ 4% hàng đêm trong 12 tuần với kem chống nắng có màu phổ rộng. Mức giảm mMASI lần lượt là 43% và 33%.
Thành phần bôi tại chỗ khác
Một số sản phẩm bôi ngoài da đầy hứa hẹn đang được xem xét để điều trị nám [50]. Tuy nhiên, còn ít được thử nghiệm trong các thử nghiệm ngẫu nhiên có đối chứng sử dụng điểm số MASI làm kết quả chính, hạn chế việc đánh giá hiệu quả của chúng và xác định vai trò của chúng trong số các phương pháp điều trị hiện có.
Vitamin C có biểu hiện hoạt tính nhất là axit L- ascorbic, thường được dùng trong điều trị nám ở nồng độ 5–20%. Vì nó rất không ổn định nên một số dạng hợp chất được phát triển để dùng trong làm trắng da và trị nám [51]. Vitamin C ức chế quá trình tạo melanin bằng cách tương tác với đồng trong tyrosinase, làm cạn kiệt dopaquinone. Nó thường được kết hợp với các chất làm sáng khác, như kojic acid và arbutin.
Kojic acid được thu từ các loại nấm khác nhau như Aspergillus oryzae, Penicillium spp., và Acetobacter spp. Kojic acid liên kết với đồng trong tyrosinase, ngăn chặn hoạt động và quá trình tạo eumelanin. Trong điều trị nám, kojic acid được sử dụng với nồng độ từ 1% đến 4% kết hợp với các chất làm sáng da khác. Tác dụng của nó bắt đầu sau 2–4 tuần sử dụng liên tục, với sự cải thiện dần dần cho đến 6 tháng [52].
Arbutin là một chất dẫn xuất HQ được chiết xuất từ quả nho Uva ursi folium, cũng được tìm thấy trong lá của quả việt quất và quả nam việt quất, có tác dụng ức chế tyrosinase và ngăn chặn sự trưởng thành của melanosome. Trong điều trị nám da, nó thường được sử dụng ở nồng độ từ 1% đến 6% kết hợp với các phương pháp điều trị và làm sáng da khác [53].
Glycolic acid là một alpha hydroxy acid có tác dụng phụ thuộc vào độ pH và nồng độ của nó. Nó làm giảm sự gắn kết của các tế bào sừng hoá tại điểm nối của lớp sừng và hạt, dẫn đến làm mỏng lớp biểu bì khi sử dụng liên tục. Thành phần này tạo điều kiện cho sự xâm nhập của các thành phần hoạt tính khác và thúc đẩy sự phân tán của melanin bằng cách tăng tốc độ luân chuyển tế bào sừng [54]. Để điều trị nám, glycolic acid thường được kết hợp với các chất làm sáng da khác, chẳng hạn như kojic acid và HQ, trong các loại kem ở nồng độ từ 4% đến 10% [55]. Các tác dụng phụ chủ yếu phát sinh từ kích ứng ban đầu, có thể có ban đỏ tạm thời và nóng rát ngay sau khi bôi.
Clobetasol là một loại steroid bôi ngoài da mạnh giúp thúc đẩy nhanh chóng loại bỏ các sắc tố gây nám da. Cơ chế giảm sắc tố do corticosteroid thúc đẩy vẫn chưa được làm rõ, và quá trình loại bỏ được thúc đẩy thường diễn ra trong thời gian ngắn. Hơn nữa, loại kem này không thể được sử dụng trong thời gian dài do các tác dụng phụ tại chỗ của nó, mặc dù clobetasol có thể được sử dụng trong một chu kỳ ngắn, sau đó là một phương pháp điều trị khác có độ an toàn tốt hơn. Điều trị bằng clobetasol tại chỗ trong tối đa 8 tuần và theo sau bằng các thành phần làm trắng tại chỗ có thể mang lại kết quả nhanh hơn khi so sánh với các thành phần làm trắng thông thường [56, 57].
Mười bệnh nhân bị nám da mặt từ Ấn Độ đã được điều trị bằng kem clobetasol propionate 0,05% bôi tại chỗ 2 lần/ngày trong 4 tuần, sau đó sử dụng 1 lần/ngày kết hợp với kem chống nắng trong 4 tuần nữa. Tất cả những người tham gia đều cho thấy sắc tố mờ dần sau 2 tuần, và rõ ràng hơn sau 4–6 tuần. Tuy nhiên, ba trường hợp (30%) phải ngừng điều trị sau 4 tuần vì teo và giãn mao mạch tại chỗ [57].
Trong một thử nghiệm chia đôi khuôn mặt được thực hiện ở Ấn Độ, những người bị nám da mặt tham gia được chỉ định bôi kem azelaic acid 20% 2 lần/ngày cho một nửa khuôn mặt trong 24 tuần. Ở nửa khuôn mặt còn lại, họ chỉ bôi kem clobetasol propionate 0,05% trong 8 tuần, tiếp theo là kem azelaic acid 20% trong 16 tuần tiếp theo. Đối với 30 bệnh nhân hoàn thành nghiên cứu, bên được điều trị tuần tự có biểu hiện sáng da đáng kể, với các tác dụng phụ nhẹ và thoáng qua [56].
Tranexamic acid bôi tại chỗ (TXA) tác động kém hơn là được uống và tiêm trong da. Hơn nữa, TXA có nhiều công thức, cách vận chuyển và phác đồ điều trị làm tăng sự thay đổi của kết quả và cản trở việc đánh giá phù hợp về vai trò của nó trong điều trị nám [58]. Một nghiên cứu có đối chứng sử dụng liposomal TXA 5% trong 12 tuần ở Thái Lan giúp giảm 51% MASI, mặc dù không có sự khác biệt giữa các nhóm [58].
Một nghiên cứu ngẫu nhiên trên 100 phụ nữ Ai Cập so sánh kem liposomal TXA 5% 2 lần/ngày với kem HQ 4% hàng đêm trong 12 tuần, kết quả giảm hMASI lần lượt là 46% và 45% [59]. Một thử nghiệm ngẫu nhiên khác với 60 phụ nữ Iran so sánh TXA 5% 2 lần/ngày với HQ 3% trong 12 tuần, kết quả giảm mMASI lần lượt là 52% và 48% [60]. Thêm nữa, một nghiên cứu ngẫu nhiên so sánh TXA tại chỗ với TC sửa đổi trong 8 tuần ở Ấn Độ, kết quả giảm MASI lần lượt là 5% và 30% [61].
Metformin ức chế quá trình hình thành melanin bằng cách giảm sự tích tụ adenosine monophosphate (cAMP) trong tế bào, nhưng do tính ưa mỡ thấp của nó nên buộc phải sử dụng ở nồng độ cao để có hiệu quả tại chỗ [62]. Lotion metformin 30% bôi tại chỗ 2 lần/ngày được so sánh với TC trong 8 tuần trong một nghiên cứu ngẫu nhiên có đối chứng trên 40 bệnh nhân Ai Cập bị nám. Mức giảm MASI lần lượt là 56% và 57% [63]. Trong khi đó, không có bằng chứng chắc chắn nào về mối liên hệ giữa nám da với tình trạng kháng insulin [64].
Methimazole là một loại thuốc kháng giáp đường uống gần đây thu hút sự chú ý do tác dụng làm giảm sắc tố bằng cách ức chế peroxidase, nhưng nó cũng được chứng minh là có tác dụng ức chế tyrosinase trong các nghiên cứu thực nghiệm. Về cơ bản, nó không gây độc tế bào đối với melanocyte và không thúc đẩy sự thay đổi nồng độ hormone kích thích tuyến giáp (TSH) trong huyết thanh [65]. Một nghiên cứu mù đôi đánh giá hiệu quả và độ an toàn của methimazole 5% mỗi ngày một lần so với HQ 4% trong 8 tuần ở 50 phụ nữ Iran bị nám, mức giảm mMASI lần lượt là 25% và 76% [66].
Melatonin là một loại hormone do tuyến tùng tổng hợp và tiết ra, có vai trò chống oxy hóa mạnh, điều hòa nhịp sinh học. Nó làm giảm các gốc tự do do tia UV gây ra và ức chế hormone kích thích tế bào hắc tố alpha (aMSH) [67]. Vì stress oxy hóa toàn thân tăng lên ở những bệnh nhân bị nám, nồng độ melatonin và catalase trong huyết thanh thấp hơn đáng kể [68]. Sau 90 ngày bôi melatonin 5% 2 lần/ngày kết hợp với kem chống nắng trong 90 ngày, MASI giảm 31% so với HQ 4% và kem chống nắng, đạt mức giảm 37% [69]. Vì rối loạn giấc ngủ là nguyên nhân chính gây ra stress oxy hóa, melatonin đường uống có thể đóng một vai trò đặc biệt trong điều trị bệnh nhân có chất lượng giấc ngủ kém [70].
Malassezin là một hợp chất indole tự nhiên được sản xuất bởi Malassezia furfur, được báo cáo là gây ra quá trình chết theo chương trình của melanocyte, thúc đẩy các chỉ dấu chết theo chương trình phụ thuộc vào liều và giảm tổng hợp melanin trong môi trường nuôi cấy melanocyte. Các thử nghiệm in vitro cũng chứng minh rằng malassezin không phải là chất ức chế tyrosinase, mà là chất chủ vận có hoạt tính cao của thụ thể aryl hydrocarbon với các chức năng cân bằng nội môi chính có thể tác động đến cơ chế tạo sắc tố. Trong một nghiên cứu về liều lượng, mù đôi, nhóm sử dụng malassezin tại chỗ hai lần một ngày trong 8 tuần đã giảm 30,13% mức độ nghiêm trọng của tăng sắc tố, so với 16,67% ở nhóm giả dược. Không có tái phát trong 8 tuần theo dõi [71, 72].
Vào năm 2017, Cohen đã đề xuất một liệu pháp kép mới (sử dụng tại chỗ) cho nám da kết hợp thuốc kháng estrogen và chất ức chế yếu tố tăng trưởng nội mô mạch máu. Thuốc kháng estrogen có thể là chất điều biến thụ thể estrogen chọn lọc (như tamoxifen hoặc raloxifene) hoặc chất ức chế aromatase (như anastrozole, letrozole hoặc exemestane). Chất ức chế yếu tố tăng trưởng nội mô mạch máu sẽ là bevacizumab [73–75].
ĐIỀU TRỊ TOÀN THÂN
Tranexamic acid (TXA)
TXA là một chất chống tiêu sợi huyết tương tự lysine tổng hợp có tác dụng ức chế cạnh tranh sự hoạt hóa plasminogen thành plasmin. TXA thúc đẩy sự ức chế hoạt tính tyrosinase bằng cách ngăn chặn sự tương tác của melanocyte và keratibocyte thông qua sự ức chế hệ thống plasminogen/plasmin. TXA cũng làm giảm hoạt động của tế bào mast và ức chế các yếu tố tăng trưởng nguyên bào sợi [76, 77].
Trong một thử nghiệm ngẫu nhiên có đối chứng với 44 phụ nữ, uống TXA 250 mg hoặc giả dược hai lần mỗi ngày trong 3 tháng, giúp giảm 49% MASI, so với 18% ở những người chỉ sử dụng kem chống nắng [78]. Tuy nhiên, có một sự tái phát nám rõ rệt trong 3 tháng sau khi ngưng dùng TXA.
TXA đường uống cũng cải thiện hiệu quả của các loại kem bổ trợ như kem TC trong trị nám, với đáp ứng lâm sàng sớm hơn [79]. Trong một thử nghiệm đối chứng ngẫu nhiên, nhóm dùng TXA đường uống, 250 mg, hai lần mỗi ngày trong 60 ngày kết hợp với kem chống nắng phổ rộng và kem TC giảm 64% mMASI, trong khi nhóm dùng kem chống nắng phổ rộng và TC chỉ giảm 12% mMASI [80, 81]. Sự tái phát nám da được ghi nhận trong những tháng sau khi ngừng TXA, ngay cả khi dùng kem chống nắng và duy trì TC.
Về liều TXA, những bệnh nhân bị nám nặng được chọn ngẫu nhiên để dùng liều hàng ngày là 500 mg, 750 mg, 1000 mg hoặc 1500 mg trong 8 tuần. Tất cả bốn liều đều có hiệu quả và không có sự khác biệt liên quan trong việc giảm chỉ số MASI hoặc melanin giữa chúng [82], mặc dù liều cao hơn cho kết quả nhanh hơn [83]. Vì tác dụng chống huyết khối còn phụ thuộc vào liều dùng, thì liều thấp hơn sẽ mang lại kết quả thuận lợi, vì ít tác dụng phụ và rủi ro hơn cho bệnh nhân sẽ tốt hơn. Mặc dù là chỉ định off-label, TXA thường được kê đơn với liều 250 mg hai lần mỗi ngày trong 2–4 tháng đối với nám da.
Một phân tích hồi cứu trên 561 bệnh nhân với các chế độ điều trị khác nhau. Các sự kiện bất lợi xảy ra ở 40 (7,1%). Hầu hết là thoáng qua, nhưng một người (0,2%) bị huyết khối tĩnh mạch sâu 6 tuần sau khi bắt đầu điều trị. Sau đó, bệnh nhân được chẩn đoán mắc bệnh thiếu protein S có tính chất gia đình [84].
Các tác dụng phụ chủ yếu được báo cáo của TXA là đau lưng, đau cơ xương, thiểu kinh, nhức đầu, phát ban mề đay và đau bụng. Chống chỉ định với TXA là rối loạn chức năng thận, bệnh ác tính, bệnh tim mạch hoặc hô hấp, đang dùng liệu pháp chống đông máu, tiền sử (cá nhân hoặc người thân) mắc bệnh thuyên tắc huyết khối (bao gồm huyết khối tĩnh mạch sâu, thuyên tắc phổi, huyết khối động mạch, đột quỵ và xuất huyết dưới nhện) và đang mang thai. Các yếu tố khác (ví dụ, liệu pháp tránh thai hoặc thay thế nội tiết tố, hút thuốc và du lịch đường dài) nên được coi là tiêu chí loại trừ tiềm năng. Không có chỉ dấu sinh hóa của các sự cố huyết khối liên quan đến TXA, vì vậy nên tiến hành phân tích tiền sử cẩn thận để xác định các yếu tố nguy cơ chính [85].
Pycnogenol
Pycnogenol là một chiết xuất thu được từ vỏ cây thông biển Pinus pinaster của Pháp. Nó chứa các hợp chất phenolic monomeric (catechin, epicatechin và taxifolin) và flavonoid cô đặc (procyanidin), với các hoạt tính chống oxy hóa và chống viêm có khả năng kích thích sự tổng hợp của enzyme nitric oxide synthase và hoạt tính antityrosinase dẫn đến ức chế sinh tổng hợp melanin. Trong ống nghiệm, pycnogenol có đặc tính chống oxy hóa mạnh hơn vitamin E và C. Ngoài ra, nó tái chế vitamin C, tái tạo vitamin E và giảm ban đỏ da do UVB gây ra [86]. Liều thông thường được kê đơn là 75–150 mg mỗi ngày đối với nám da, chia thành hai đến ba liều trong 2–4 tháng. Các tác dụng phụ là không đáng kể.
Pycnogenol đường uống 50 mg hai lần mỗi ngày được đề xuất để điều trị nám, giảm 58% MASI ở 31 phụ nữ Brazil sau 90 ngày [87]. Một nghiên cứu khác trên 30 phụ nữ Trung Quốc bị nám da, những người này uống 25 mg pycnogenol ba lần mỗi ngày trong 30 ngày, giúp giảm 32% diện tích trung bình và giảm 22% cường độ của nám da mặt [86]. Thêm nữa, một thử nghiệm ngẫu nhiên có kiểm soát đánh giá việc bổ sung 150 mg pycnogenol đường uống (hoặc giả dược) với kem chống nắng có màu phổ rộng và TC ở 44 phụ nữ bị nám. Sau 60 ngày, mức giảm mMASI vượt trội hơn đối với nhóm dùng pycnogenol đường uống, ở mức 49% so với 34% [37].
Thành phần dùng toàn thân khác
Polypodium leucatomos (PL) là một loại sản phẩm điều trị không kê đơn, được bán trên thị trường với tên Heliocare ở Hoa Kỳ. Nó là loài dương xỉ thuộc họ Polypodiaceae, có nguồn gốc từ Trung và Nam Mỹ. Nó được mô tả như một chất bổ sung chống viêm để điều trị các bệnh viêm da và giảm mức độ nghiêm trọng của cháy nắng. Cơ chế hoạt động chính xác của nó vẫn chưa được biết, nhưng nó là một chất chống oxy hóa mạnh và dường như hoạt động để duy trì tính toàn vẹn cấu trúc của chất nền ngoại bào, thường bị ảnh hưởng bởi bức xạ cực tím [88, 89]. Những đặc tính này dẫn đến giả thuyết về hiệu quả của nó trong điều trị nám. Tuy nhiên, một thử nghiệm trên 40 phụ nữ gốc Tây Ban Nha bị nám từ trung bình đến nặng sử dụng kem chống nắng và được chọn ngẫu nhiên để uống giả dược hoặc chiết xuất PL 720 mg mỗi ngày trong 12 tuần cho thấy không có sự khác biệt trong việc giảm MASI [90].
Một nghiên cứu khác gồm 33 phụ nữ châu Á bị nám sử dụng kem HQ 4% tại chỗ và kem chống nắng phổ rộng được chọn ngẫu nhiên dùng PL 480 mg/ngày hoặc giả dược trong 12 tuần. Sau 56 ngày, MASI giảm đáng kể hơn ở nhóm PL (49,4%) so với giả dược (32,6%). Tuy nhiên, việc giảm chỉ số melanin, chỉ số ban đỏ, điểm chất lượng cuộc sống và cải thiện bề ngoài không có sự khác biệt giữa các nhóm [91]. Những kết quả mâu thuẫn này cần thêm các nghiên cứu có hệ thống mới để đánh giá hiệu quả của PL trong điều trị nám.
Carotenoid là các sắc tố tự nhiên có trong một số loại thực vật đóng vai trò là chất ổn định của các phân tử không ổn định do khả năng loại bỏ các loại oxy phản ứng thuận nghịch và các gốc tự do khác, hấp thụ năng lượng của các phân tử này và tiêu tán năng lượng dưới dạng nhiệt. Ở da, khả năng bảo vệ quang học của carotenoid xảy ra bằng cách hấp thụ trực tiếp tia UVA, UVB và VL bằng cách chống lại tác động của tia UV đối với các phân tử tiếp xúc, sẽ trở nên không ổn định và có khả năng gây nguy hiểm cho các phân tử DNA và protein của tế bào. Ngoài ra, chúng có thể kích hoạt các con đường enzym chống oxy hóa và chống tăng sinh để đáp ứng với việc tiếp xúc với tia UV [92]. Fucoxanthin đường uống (10 mg/kg) làm giảm sắc tố da do tia UVB gây ra trên thực nghiệm ở chuột lang, có thể là do ức chế tổng hợp cytokine prostaglandin E2 (PGE2) tiền viêm và các thụ thể liên quan đến quá trình tạo melanin [85]. Mặc dù tính phù hợp của việc sử dụng nó, cho đến nay vẫn chưa có thử nghiệm ngẫu nhiên có kiểm soát nào về việc sử dụng carotenoid đường uống trong điều trị nám da.
Glutathione được dùng để điều trị nám do đặc tính chống oxy hóa, dẫn đến ức chế tyrosinase. Hơn nữa, nó làm tăng nồng độ cysteine nội bào và N-acetylcysteine, chuyển quá trình tạo melanin từ eumelanin thành pheomelanin. Nó được kê đơn trên toàn thế giới để điều trị rối loạn màu da bằng đường uống hoặc tiêm tĩnh mạch. Một nghiên cứu ngẫu nhiên có đối chứng với giả dược trên 60 sinh viên y khoa trẻ người Thái Lan dùng glutathione đường uống 250 mg hai lần mỗi ngày trong 4 tuần cho thấy chỉ số melanin giảm nhất quán và giảm đốm nâu [93]. Do đó, các nghiên cứu ngẫu nhiên có kiểm soát sử dụng chất chống oxy hóa đường uống với glutathione hoặc N-acetylcysteine để điều trị nám da được chứng minh.
Chiết xuất cà chua giàu lycopene đường uống được chứng minh là làm tăng nồng độ superoxide dismutase trong huyết thanh và góp phần với hydroquinone 4% bôi tại chỗ để giảm mMASI, sau 12 tuần [94].
LỘT DA BẰNG HÓA CHẤT
Lột da bằng hóa chất làm tăng tốc độ luân chuyển của tế bào sừng biểu bì, được phân loại ở bề mặt, trung bình và sâu tùy theo lớp da và mức độ mô học tiếp cận được. Các tác động có thể bao gồm tái tạo biểu bì, tế bào sừng từ lớp sừng hoá, loại bỏ melanin và tái tổ chức lớp bì do quá trình viêm và sản xuất các cytokine, kích thích nguyên bào sợi và tăng tổng hợp collagen và elastin [95]. Hơn nữa, có nhiều chỉ định peel trong da liễu thẩm mỹ. Với nám da, chúng thường được kết hợp với điều trị khác, như TC và HQ cộng với kem chống nắng có màu phổ rộng và các quy trình khác, như vi kim, để có kết quả tốt hơn [96, 97].
Lột da bằng hóa chất không phải là liệu pháp đầu tay, nhưng là một biện pháp bổ trợ. Chú ý, nên thực hiện lột da theo đợt liên tiếp đối với nám. Các tác động phụ thuộc vào sự luân chuyển tế bào sừng và sự phân bố melanin [98, 99]. Các thành phần được sử dụng phổ biến nhất để lột da bằng hóa chất là (1) Trichloroacetic acid (TCA) 15% hoặc 20% trong dung dịch nước, dùng gạc nhẹ nhàng thoa lên và không loại bỏ hoặc trung hòa; (2) Glycolic acid (GA) 30%, 50% hoặc 70% ở dạng gel, bôi bằng ngón tay đeo găng và loại bỏ (sau khi da đỏ hoặc châm chích) hoặc trung hòa (nếu frosting) bằng natri bicacbonat 10%; (3) Salicylic acid (SA) 20% hoặc 30% trong ethanol, được bôi bằng gạc và không loại bỏ; và (4) Dung dịch Jessner (JS), gồm 14 g resorcinol, 14 g salicylic acid và 14 mL lactic acid (85%) trong cồn etylic 95%, được bôi bằng gạc và không loại bỏ.
Kết quả có thể nhẹ, trung bình hoặc rõ rệt, nhưng có thể không giảm thêm sắc tố da. GA là thành phần được trích dẫn nhiều nhất trong các tài liệu về lột da bằng hóa chất và trị nám [100]. Dung dịch lactic acid (LA) nồng độ đủ mạnh, ở nồng độ 92% hoặc 82%, được báo cáo trong hai nghiên cứu như một giải pháp thay thế được bôi bằng ngón tay đeo găng ngay trên vùng tổn thương và loại bỏ sau khi ban đỏ hoặc châm chích. Hiệu quả của nó dường như tương tự như hiệu quả của JS [101, 102].
Retinoic acid (RA) hoặc tretinoin, ở nồng độ 1%, 3% và 5% trong ethanol/propylene glycol, được báo cáo lần đầu tiên vào năm 2001 như một tác nhân gây bong tróc bề mặt hàng loạt và được chỉ định điều trị nám và lão hóa [103, 104]. Nó là một chất phân tán màu vàng và nên được duy trì trên da trong tối đa 6 giờ (rửa sạch tại nhà) và màu nhuộm nâu được thêm vào để dùng cho da mặt mà không ảnh hưởng đến tác dụng lột da. Kỳ vọng là tăng luân chuyển tế bào sừng hóa và loại bỏ melanin hình thành sẵn trong lớp biểu bì. Tuy nhiên, RA là một công thức dễ bay hơi, bị phân hủy khi tiếp xúc với VL, UV và oxy. Vì vậy, một hệ thống chống oxy hóa mạnh mẽ là cần thiết.
Cho đến nay, phương tiện tốt nhất và nồng độ lý tưởng cho RA vẫn chưa được biết. Các nghiên cứu dược kỹ thuật cho thấy khả năng bị giữ lại của các công thức có mức độ mạnh cao trong lớp sừng hoá nhiều hơn khi so sánh với kem RA 0,05% truyền thống. Do đó, nồng độ cao không có lợi thế rõ ràng vì chúng khó đồng nhất hơn, làm tăng nguy cơ kết tinh và giảm khả năng xâm nhập qua da [105].
Một đánh giá dựa trên bằng chứng, bao gồm 40 nghiên cứu và 2912 bệnh nhân, kết luận rằng lột GA không hiệu quả hơn HQ 4% [106]. Hơn nữa, một đánh giá khác, bao gồm các mức độ khuyến nghị, kết luận rằng tất cả các phương pháp lột da bề mặt có thể được sử dụng trong điều trị nám da như một liệu pháp bổ sung hoặc duy trì, với hiệu quả từ nhẹ đến trung bình. Các tác giả cũng chứng minh không có lợi thế đáng kể nào của thành phần này so với thành phần khác và khuyến nghị lựa chọn dựa trên mức độ thoải mái, kinh nghiệm của bác sĩ da liễu và độ mạnh an toàn nhất [107].
Ngược lại, một phân tích tổng hợp gần đây đã đánh giá hiệu quả của tất cả các phương pháp điều trị nám hiện có. Lột da bằng hóa chất không được coi là một lựa chọn điều trị do có rất ít thử nghiệm ngẫu nhiên có đối chứng chất lượng cao [108]. Tác dụng phụ hiếm, nhưng mối quan tâm chính là nguy cơ tăng sắc tố, đặc biệt là ở những người da sẫm màu [99].
21 nghiên cứu ngẫu nhiên và so sánh về lột da bằng hóa chất trong trị nám được xác định (Bảng 1). Nói chung, không có sự khác biệt có liên quan được ghi nhận trong các so sánh. Tuy nhiên, điều quan trọng là phải làm nổi bật tính không đồng nhất cao và những hạn chế của các nghiên cứu, chẳng hạn như (1) chất lượng phương pháp từ thấp đến trung bình, (2) sự khác biệt trong một quần thể được chọn, (3) thiếu sự tiếp nhận và đánh giá ở các loại da khác nhau, (4) cỡ mẫu nhỏ, (5) thiết kế thay đổi, (6) các loại lột da hóa học, (7) đo lường thiếu hiệu quả, (8) ngắn hạn hoặc không theo dõi, (9) tỷ lệ mất mẫu, (10) tính không đồng nhất trong kết quả của nhóm, và (11) kết luận kém. Tuy nhiên, GA được coi là hiệu quả và an toàn hơn so với lột da TCA để điều trị nám [99, 106], trong khi lột da JS và RA là quy trình bổ trợ an toàn và chi phí thấp cho nám. Hơn nữa, JS điều chỉnh (17% LA, 17% SA, 8% axit citric và ethanol) có thể làm giảm phản ứng dị ứng với resorcinol và tăng sắc tố sau viêm [109]. Tuy nhiên, các nghiên cứu bổ sung được thiết kế tốt là cần thiết.
VI KIM
Vi kim lần đầu tiên được phát triển để điều trị sẹo mụn và da chảy xệ. Tuy nhiên, sự cải thiện tình trạng tăng sắc tố sau viêm và nám được ghi nhận ở những bệnh nhân này [110]. Khi được thực hiện với một kim lăn, việc tạo ra một vết thương trên da vừa phải (ban đỏ lan rộng và một số vết chảy máu) thúc đẩy quá trình cải thiện sớm tình trạng nám da [111]. Kỹ thuật này, kết hợp với TC và kem chống nắng phổ rộng trong 8 tuần (Hình 1), thúc đẩy giảm mMASI vượt trội (48%) tốt hơn so với TC đơn thuần và được chứng minh là ngăn ngừa thêm tái phát [81, 112].
RCT: thử nghiệm ngẫu nhiên có đối chứng; R: ngẫu nhiên; NR: không ngẫu nhiên; SB: mù đơn; DB: mù kép; IB: mù kiểm tra viên; TC: kem kết hợp ba thành phần (HQ 2%, RA 0,05%, Fluocinolone 0,01%); AA: azelaic acid; mMASI: chỉ số mức độ nghiêm trọng và diện tích nám sửa đổi; VAS: Thang đo trực quan; PIH: tăng sắc tố sau viêm; MKF: công thức Kligman cải tiến
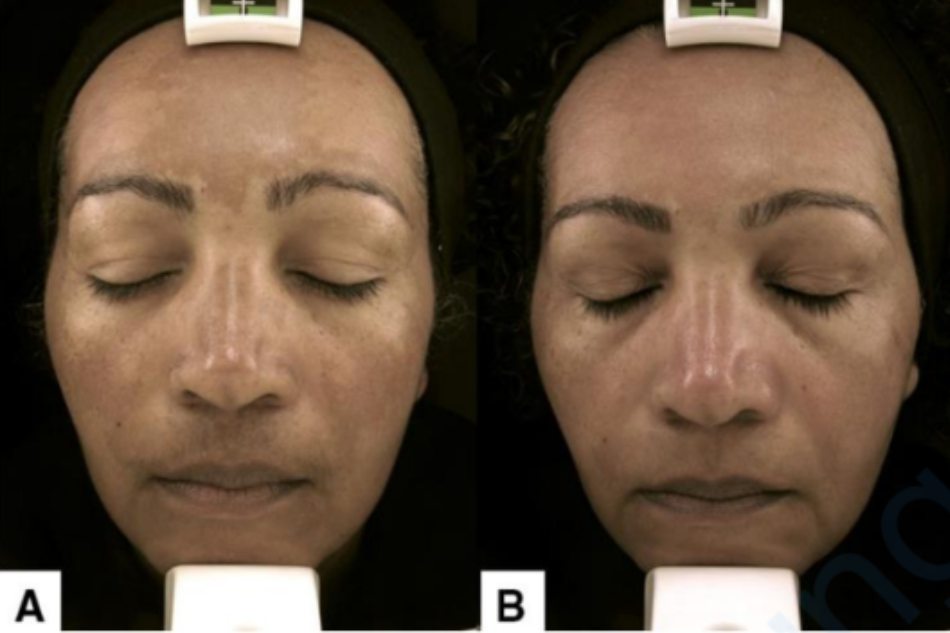
Nám da mặt ở một phụ nữ da Fitzpatrick loại V 48 tuổi được điều trị bằng kem chống nắng có màu, kem ba thành phần trước khi đi ngủ, uống tranexamic acid 250 mg mỗi 12 giờ và hai lần vi kim với khoảng cách 30 ngày giữa các lần điều trị. A: trước và B: sau 2 tháng điều trị
Cơ chế hoạt động của vi kim vẫn chưa hoàn toàn được biết đến. Sau thủ thuật, sự tăng sinh tế bào sừng sớm xảy ra, làm tăng quá trình đào thải melanin qua da. Ngoài ra, vi kim giúp cải thiện các dạng lão hóa da do ánh nắng mặt trời, như rối loạn đàn hồi do ánh sáng mặt trời và các melanocyte hình con lắc, đồng thời tái cấu trúc các màng đáy bị tổn thương [113]. Vi kim cũng là một quy trình an toàn để thực hiện trên da màu [106].
Nhiều nghiên cứu trích dẫn phương pháp vi kim siêu nhỏ để tăng khả năng thâm nhập của chất làm trắng tại chỗ. Tuy nhiên, điểm cuối lâm sàng tốt nhất cho sự thâm nhập không được nhất trí. Hơn nữa, hiệu quả làm trắng của sản phẩm phụ thuộc vào độ thẩm thấu của da và tần suất sử dụng. Do đó, việc cung cấp thuốc đúng giờ để làm trắng trên cơ sở vi kim mỗi hai tuần hoặc hàng tháng là không có lợi. Ngược lại, hầu hết các thành phần này không được phát triển để sử dụng trong da. Vì vậy, thông tin an toàn của chúng là không rõ. Ngoài ra, sự xâm nhập sâu và ngang của các chất này sau khi vi kim diễn ra thất thường, khiến cho các tác dụng phụ của việc hấp thụ toàn thân có thể xảy ra là không thể đoán trước [114].
Vi kim RF được báo cáo là một phương pháp điều trị hiệu quả đối với nám kháng trị, mặc dù không có nghiên cứu ngẫu nhiên có kiểm soát lớn nào được thực hiện [115–117].
LIỆU PHÁP TIÊM TRONG DA VÀ HUYẾT TƯƠNG GIÀU TIỂU CẦU
Một thách thức đáng kể trong điều trị nám là khả năng thẩm thấu thấp của các chất hòa tan trong nước qua lớp kỵ nước của lớp sừng. Với liệu pháp tiêm trong da, thuốc được đưa trực tiếp vào lớp bì, dẫn đến nồng độ thuốc cao hơn ở vùng mục tiêu với thể tích nhỏ hơn. Do đó, hiệu quả lớn hơn và lâu dài hơn, với ít tác dụng phụ hơn. Để tiêm trong da, các chất phải được hòa tan trong nước vô trùng và nên tránh trộn lẫn với các chất khác nhau được tiêm qua các ống tiêm riêng biệt.
TXA là chất được nghiên cứu nhiều nhất trong liệu pháp điều trị nám trong da. Việc tiêm được thực hiện bằng ống tiêm 28-gauge đến 30-gauge ở độ sâu 1 mm và khoảng cách 1 cm giữa mỗi điểm. Trong các thử nghiệm lâm sàng, 3–12 buổi được thực hiện với khoảng thời gian giữa các buổi là 1– 6 tuần. Có sự giảm điểm về mức độ nghiêm trọng, dao động trong khoảng từ 33,3% đến 81,2%. Các nồng độ TXA khác nhau được sử dụng (4–100 mg/cc), nhưng nồng độ cao hơn dường như không cải thiện được tình trạng sáng da. Đáng chú ý, nồng độ thấp hơn tái phát nhiều hơn, trong khi nồng độ cao hơn thì đau hơn. Liệu pháp tiêm trong da với TXA dường như làm sáng da chậm hơn nhưng có hiệu quả tương tự như điều trị bằng đường uống, với mức độ an toàn tốt hơn [118]. Mặc dù liệu pháp điều trị tiêm trong da có khả năng thúc đẩy cải thiện tình trạng nám da, nhưng các nghiên cứu có đối chứng vẫn còn khan hiếm mặc dù các sản phẩm vitamin C và glutathione đã được sử dụng rộng rãi.
Huyết tương giàu tiểu cầu (Platelet-rich plasma, PRP) dường như là một kỹ thuật hứa hẹn để điều trị nám, mặc dù chỉ có một số nghiên cứu có đối chứng so sánh PRP với các liệu pháp tiêu chuẩn. Không có sự đồng thuận nào về phương pháp chuẩn bị PRP chuẩn hoặc nồng độ tiểu cầu. Tiểu cầu chứa yếu tố tăng trưởng tiểu cầu, yếu tố tăng trưởng biến đổi (TGF) b1 và b2, và yếu tố tăng trưởng biểu bì. Những chất này tác động lên quá trình chuyển hóa sắc tố và viêm, đồng thời có thể sửa chữa các cấu trúc da bị thay đổi của nám.
Trong một phân tích tổng hợp về PRP điều trị nám liên quan đến 395 người trưởng thành trong mười thử nghiệm lâm sàng, điểm mMASI giảm đáng kể sau thủ thuật [119]. Ngoài việc tiêm trong da, PRP có thể được sử dụng sau khi vi kim, với kết quả tương tự giữa hai kỹ thuật. Số lượng các lần PRP dao động từ ba đến sáu, được thực hiện hàng tháng hoặc nửa tháng một lần. Tác dụng phụ tối thiểu được ghi nhận, như ban đỏ tạm thời, phù nề và đau tại chỗ tiêm.
CÔNG NGHỆ LASER VÀ ÁNH SÁNG
Nhiều thử nghiệm lâm sàng khám phá việc sử dụng công nghệ laser và ánh sáng để điều trị nám. Tuy nhiên, do sự không đồng nhất của thiết kế nghiên cứu (các thông số lâm sàng được sử dụng như kết quả, số lần điều trị, khoảng thời gian điều trị và thời gian theo dõi), sự đa dạng của cài đặt thông số thiết bị và đặc điểm nám, việc so sánh các kết quả này rất phức tạp [120]. Trong thực hành lâm sàng, loại laser nhắm vào melanin được sử dụng nhiều nhất để điều trị nám là Q-switched Nd-YAG ở chế độ toning. Kỹ thuật Q-switching tạo ra các xung với đỉnh năng lượng cực cao được phân phối trong một thời gian ngắn (nano giây). Kết quả là sự phá hủy melanin bằng hiệu ứng quang âm [121, 122]. Đổi lại, chế độ toning sử dụng mật độ năng lượng thấp (lên đến 3j/cm2) và kích thước điểm lớn hơn trong các lần với khoảng thời gian ngắn (1–6 tuần). Do đó, không có sự phá hủy các melanocyte hoặc keratinocyte trong lớp biểu bì mà thay vào đó là các melanosome nội bào (quá trình quang nhiệt chọn lọc dưới tế bào), dẫn đến tình trạng viêm ít hơn và do đó ít chứng tăng sắc tố và giảm sắc tố sau viêm dạng đốm. Tuy nhiên, ngay cả với kỹ thuật an toàn hơn này, vẫn có báo cáo về rối loạn sắc tố sau các thủ thuật với khoảng thời gian giữa các lần điều trị ngắn [123].
Gần đây, ngành công nghiệp này phát triển các loại laser có thời gian phát xung là pico giây ở các bước sóng khác nhau: 532, 755 và 1064 nm. Năng lượng, được cung cấp trong thời gian thậm chí còn ngắn hơn, làm giảm hiệu ứng quang nhiệt và tăng hiệu ứng quang âm trong mô được điều trị. Tuy nhiên, tính ưu việt của laser pico giây so với laser nano giây trong điều trị nám có thể chưa được chứng minh rõ ràng [124, 125].
Bên cạnh sắc tố, tia laser nhắm vào nước cũng được sử dụng để điều trị nám. Laser phân đoạn bóc tách (CO2 và Er: YAG) làm bốc hơi các keratinocyte có nhiều melanin hơn và các melanocyte tăng chức năng trong nám. Hơn nữa, việc lành thương của da xung quanh các cột đông tụ giúp cải thiện môi trường lão hoá ánh sáng của lớp bì nông của nám, có thể làm giảm kích thích cận tiết đối với các melanocyte.
Tuy nhiên, laser bóc tách có hiệu ứng nhiệt cao, dẫn đến rối loạn sắc tố. Do đó, các xung ngắn với mật độ năng lượng thấp được khuyến nghị để giảm biến chứng này [126]. Ngược lại, các tia laser không bóc tách sẽ tạo ra các cột tổn thương đông tụ trong lớp bì, giữ cho lớp sừng nguyên vẹn, ít gây viêm hơn. Một loại laser không bóc tách, thulium 1927 nm, dường như có triển vọng trong điều trị nám vì khả năng thâm nhập của nó là xung quanh điểm giao nhau giữa lớp bì và biểu bì [127].
Tăng sinh mạch máu là một hiện tượng phụ của tổn thương bức xạ ion hóa trong nám đồng thời tham gia vào quá trình duy trì tăng sắc tố. Do đó, laser nhuộm xung (585 nm) có thể được sử dụng trong điều trị nám, đặc biệt là khi thấy rõ có giãn mao mạch. Khi điều trị mạch máu, laser nhuộm xung làm giảm kích thích melanocyte, theo sau là sự tái phát của các đốm sắc tố. Do nguy cơ tăng sắc tố sau viêm, không nên sử dụng trong các kiểu da tối màu hơn (≥IV) [128].
MÀI MÒN DA
Phương pháp mài mòn cơ học trên bề mặt da bằng cách sử dụng động cơ siêu nhỏ và đầu mài kim cương quay được đề xuất để điều trị nám da.
Thật sự, mài da nhẹ nhàng phục hồi toàn bộ lớp biểu bì và lớp bì nông. Mặc dù có thể xảy ra hiện tượng tăng sắc tố sau viêm thoáng qua, nhưng tình trạng giảm sắc tố tồn tại kéo dài được thấy sau khi mài da đối với sẹo mụn. Ví dụ, theo dõi lâu dài 410 phụ nữ Thái Lan bị nám được điều trị bằng mài da cho thấy hiệu quả duy trì 95% trong 5 năm và tỷ lệ tác dụng phụ thấp. Tuy nhiên, những kết quả này chưa bao giờ được lặp lại thông qua một thử nghiệm có đối chứng [129]. Vi mài da với oxit nhôm không có vai trò trực tiếp trong điều trị nám vì nó chỉ ảnh hưởng đến lớp sừng nhưng có thể tạo điều kiện cho các sản phẩm thẩm thấu [130].
KẾT LUẬN
Việc điều trị nám là một thách thức, vì các đốm sắc tố không được loại bỏ hoàn toàn ở hầu hết bệnh nhân và thường xuyên tái phát. Phương pháp điều trị đầu tiên là chống nắng nghiêm ngặt hàng ngày và kết hợp kem chống nắng có màu với các chất làm trắng tại chỗ, có thể có tác động khác nhau đối với sự hình thành melanin.
Trong những trường hợp nặng và/hoặc kháng trị, nên kê đơn thuốc uống. Tranexamic acid có bằng chứng tốt nhất để điều trị nám, tuy nhiên nó là một loại thuốc làm tan huyết khối và do đó nên được kê đơn cho một số bệnh nhân chọn lọc. Cũng có nhiều bằng chứng về việc sử dụng pycnogenol như một chất bổ trợ toàn thân trong điều trị nám.
Các thủ thuật cũng hữu ích để điều trị nám. Vi kim là một kỹ thuật chi phí thấp với ít tác dụng phụ bổ sung cho điều trị tại chỗ. Lột da bằng hóa chất hoạt động chủ yếu thông qua đổi mới biểu bì. Laser và các công nghệ dựa trên ánh sáng nên được sử dụng cẩn thận tối đa vì nhiệt gây ra sự hình thành hắc tố sau viêm.
Sự kết hợp của các thành phần làm trắng tại chỗ với thuốc uống và các thủ thuật có thể mang lại kết quả nhanh hơn, mặc dù các chiến lược ngăn ngừa tái phát tiếp theo vẫn chưa được nghiên cứu kỹ lưỡng.
NGHIÊN CỨU TRONG TƯƠNG LAI
Nghiên cứu chuyên sâu đang được thực hiện trên phương pháp điều trị nám mới và hiệu quả hơn và sự kết hợp của các cơ chế hoạt động khác nhau của các loại thuốc có sẵn. Các chiến lược làm giảm stress oxy hóa tại chỗ và toàn thân, ổn định tế bào mast của lớp bì, giảm sự hình thành melanin mà không gây độc cho melanocyte, loại bỏ melanin biểu bì mà không kích thích viêm, phục hồi lão hóa và thúc đẩy tự thực bào được coi là có triển vọng.
Do đó, việc phát triển các chiến lược điều trị và phòng ngừa hiệu quả đối với nám da là một công việc đang được tiến hành phụ thuộc vào sự hiểu biết tốt hơn về cơ chế bệnh sinh của nó. Trong khi đó, chống nắng kết hợp với các phương pháp điều trị làm giảm sự hình thành melanin, tăng luân chuyển melanin biểu bì và sửa chữa lớp bì nông là trụ cột của các chiến lược trị liệu.
TÀI LIỆU THAM KHẢO
- Esposito MCC, Esposito ACC, Jorge MFS, D’Elia MPB, Miot HA. Depression, anxiety, and self-esteem in women with facial melasma: an Internet-based survey in Int J Dermatol. 2021;60(9):e346–7.
- Pollo CF, Miot LDB, Meneguin S, Miot HA. Factors associated with quality of life in facial melasma: a cross- sectional Int J Cosmet Sci. 2018;40(3): 313–6.
- Maranzatto CF, Miot HA, Miot LD, Meneguin Psychometrican analysis and dimensional structure of the Brazilian version of melasma quality of life scale (MELASQoL-BP). An Bras Dermatol. 2016;91(4):422–8.
- Ritter CG, Fiss DV, Borges da Costa JA, de Carvalho RR, Bauermann G, Cestari TF. Extra-facial melasma: clinical, histopathological, and immunohisto- chemical case- control J Eur Acad Dermatol Venereol. 2013;27(9):1088–94.
- Handel AC, Miot LD, Miot HA. Melasma: a clinical and epidemiological An Bras Dermatol. 2014;89(5):771–82.
- Guinot C, Cheffai S, Latreille J, Dhaoui MA, Youssef S, Jaber K, et Aggravating factors for melasma: a prospective study in 197 Tunisian patients. J Eur Acad Dermatol Venereol. 2010;24(9):1060–9.
- Tamega Ade A, Miot LD, Bonfietti C, Gige TC, Marques ME, Miot HA. Clinical patterns and epi- demiological characteristics of facial melasma in Brazilian women. J Eur Acad Dermatol 2013;27(2):151–6.
- Alcantara GP, Esposito ACC, Olivatti TOF, Yoshida MM, Miot HA. Evaluation of ex vivo melanogenic response to UVB, UVA, and visible light in facial melasma and unaffected adjacent An Bras Dermatol. 2020;95(6):684–90.
- Mazeto I, Esposito ACC, Cassiano DP, Miot HA. Sun exposure (UVB, UVA, and blue-violet visible light) in ordinary daily Int J Dermatol. 2021.
- Schalka S, dos Reis VM, Cuce LC. The influence of the amount of sunscreen applied and its sun pro- tection factor (SPF): evaluation of two sunscreens including the same ingredients at different con- centrations. Photodermatol Photoimmunol Pho- 2009;25(4):175–80.
- Nii D, Esposito AC, Peres G, Schmitt JV, Miot Tinted sunscreens lead to a smaller amount of the product applied on the face. Int J Dermatol. 2020;59(12):e438–9.
- Henderson SI, King KL, Karipidis KK, Tinker RA, Green AC. Effectiveness, compliance and applica- tion of sunscreen for solar ultraviolet radiation protection in Public Health Res Pract. 2022;32(1).
- Tsai J, Chien Photoprotection for Skin of Color. Am J Clin Dermatol. 2022;23(2):195–205.
- Passeron T, Lim HW, Goh CL, Kang HY, Ly F, Morita A, et al. Photoprotection according to skin phototype and dermatoses: practical recommendations from an expert J Eur Acad Dermatol Venereol. 2021;35(7):1460–9.
- Addor FAS, Barcaui CB, Gomes EE, Lupi O, Marcon CR, Miot HA. Sunscreen lotions in the dermato- logical prescription: review of concepts and con- troversies. An Bras 2022;97(2):204–22.
- Guan LL, Lim HW, Mohammad TF. Sunscreens and photoaging: a review of current Am J Clin Dermatol. 2021;22(6):819–28.
- Morgado-Carrasco D, Piquero-Casals J, Granger C, Trullas C, Passeron T. Melasma: The need for tai- lored photoprotection to improve clinical out- Photodermatol Photoimmunol Photomed. 2022:(ahead of print).
- Lim HW, Kohli I, Granger C, Trullas C, Piquero- Casals J, Narda M, et al. Photoprotection of the skin from visible light-induced pigmentation: current testing methods and proposed J Invest Dermatol. 2021;141(11):2569–76.
- Dias JAF, Lima PB, Cassiano DP, Esposito ACC, Bagatin E, Miot LDB, et al. Oral ketotifen associated with famotidine for the treatment of facial mel- asma: a randomized, double-blind, placebo-con- trolled trial. J Eur Acad Dermatol Venereol. 2022;36(2):e123–5.
- Sarkar R, Ghunawat S, Narang I, Verma S, Garg VK, Dua R. Role of broad-spectrum sunscreen alone in the improvement of melasma area severity index (MASI) and Melasma Quality of Life Index in mel- asma. J Cosmet 2019;18(4):1066–73.
- Boukari F, Jourdan E, Fontas E, Montaudie H, Cas- tela E, Lacour JP, et al. Prevention of melasma relapses with sunscreen combining protection against UV and short wavelengths of visible light: a prospective randomized comparative trial. J Am Acad Dermatol. 2015;72(1):189– 90 e1.
- Lakhdar H, Zouhair K, Khadir K, Essari A, Richard A, Seite S, et al. Evaluation of the effectiveness of a broad- spectrum sunscreen in the prevention of chloasma in pregnant J Eur Acad Dermatol Venereol. 2007;21(6):738–42.
- Castanedo-Cazares JP, Hernandez-Blanco D, Carlos- Ortega B, Fuentes-Ahumada C, Torres-Alvarez B. Near- visible light and UV photoprotection in the treatment of melasma: a double-blind randomized trial. Photodermatol Photoimmunol 2014;30(1):35–42.
- Sarkar R, Puri P, Jain RK, Singh A, Desai A. Melasma in men: a clinical, aetiological and histological J Eur Acad Dermatol Venereol. 2010;24(7): 768–72.
- Kar SK. Melasma: A rare adverse effect of clomipra- Indian J Pharmacol. 2016;48(4):453–4.
- Locci-Molina N, Wang A, Kroumpouzos G. Melasma improving spontaneously upon switching from a combined oral contraceptive to a hormone-releas- ing intrauterine device: a report of four cases. Acta Derm 2015;95(5):624–5.
- Prabha N, Mahajan VK, Mehta KS, Chauhan PS, Gupta
- Cosmetic contact sensitivity in patients with melasma: results of a pilot study. Dermatol Res Pract. 2014;2014: 316219.
- Holmo NF, Ramos GB, Salomao H, Werneck RI, Mira MT, Miot LDB, et al. Complex segregation analysis of facial melasma in Brazil: evidence for a genetic susceptibility with a dominant pattern of Arch Dermatol Res. 2018;310(10): 827–31.
- Grimes Melasma Etiologic and therapeutic considerations. Arch Dermatol. 1995;131(12): 1453–7.
- Lima PB, Dias JAF, Cassiano DP, Esposito ACC, Miot LDB, Bagatin E, et Efficacy and safety of topical isobutylamido thiazolyl resorcinol (Thiamidol) vs. 4% hydroquinone cream for facial melasma: an evaluator- blinded, randomized controlled trial. J Eur Acad Dermatol Venereol. 2021;35(9):1881–7.
- Lima PB, Dias JAF, Cassiano D, Esposito ACC, Bagatin E, Miot LDB, et al. A comparative study of topical 5% cysteamine versus 4% hydroquinone in the treatment of facial melasma in Int J Dermatol. 2020;59(12):1531–6.
- Kligman AM, Willis A new formula for depig- menting human skin. Arch Dermatol. 1975;111(1): 40–8.
- Cestari T, Arellano I, Hexsel D, Ortonne JP. Mel- asma in Latin America: options for therapy and treatment J Eur Acad Dermatol Venereol. 2009;23(7):760–72.
- Ferreira Cestari T, Hassun K, Sittart A, de Lourdes VM. A comparison of triple combination cream and hydroquinone 4% cream for the treatment of moderate to severe facial J Cosmet Der- matol. 2007;6(1):36–9.
- Ahmad Nasrollahi S, Sabet Nematzadeh M, Samadi A, Ayatollahi A, Yadangi S, Abels C, et al. Evaluation of the safety and efficacy of a triple combination cream (hydroquinone, tretinoin, and fluocinolone) for treatment of melasma in Middle Eastern skin. Clin Cosmet Investig 2019;12:437–44.
- Pennitz A, Kinberger M, Avila Valle G, Passeron T, Nast A, Werner Self-applied topical interven- tions for melasma: a systematic review and meta- analysis of data from randomized, investigator- blinded clinical trials. Br J Dermatol. 2022:(ahead of print).
- Lima PB, Dias JAF, Esposito ACC, Miot LDB, Miot French maritime pine bark extract (pyc- nogenol) in association with triple combination cream for the treatment of facial melasma in women: a double-blind, randomized, placebo-con- trolled trial. J Eur Acad Dermatol Venereol. 2021;35(2):502–8.
- Levitt J. The safety of hydroquinone: a dermatolo- gist’s response to the 2006 Federal J Am Acad Dermatol. 2007;57(5):854–72.
- Bhawan J, Grimes P, Pandya AG, Keady M, Byers HR, Guevara IL, et al. A histological examination for skin atrophy after 6 months of treatment with flu- ocinolone acetonide 0.01%, hydroquinone 4%, and tretinoin 0.05% Am J Dermatopathol. 2009;31(8):794–8.
- O’Donoghue JL, Beevers C, Buard A. Hvdroquinone: assessment of genotoxic potential in the in vivo alkaline comet Toxicol Rep. 2021;8:206–14.
- Farshi S. Comparative study of therapeutic effects of 20% azelaic acid and hydroquinone 4% cream in the treatment of melasma. J Cosmet Dermatol. 2011;10(4):282–7.
- Gehring W. Nicotinic acid/niacinamide and the skin. J Cosmet 2004;3(2):88–93.
- Zhu W, Gao J. The use of botanical extracts as topical skin-lightening agents for the improvement of skin pigmentation disorders. J Investig Dermatol Symp Proc. 2008;13(1):20–4.
- Kimball AB, Kaczvinsky JR, Li J, Robinson LR, Matts PJ, Berge CA, et al. Reduction in the appearance of facial hyperpigmentation after use of moisturizers with a combination of topical niacinamide and N-acetyl glucosamine: results of a randomized, double-blind, vehicle-controlled Br J Derma- tol. 2010;162(2):435– 41.
- Navarrete-Solis J, Castanedo-Cazares JP, Torres- Alvarez B, Oros-Ovalle C, Fuentes-Ahumada C, Gonzalez FJ, et al. A double-blind, randomized clinical trial of niacinamide 4% versus hydro- quinone 4% in the treatment of Dermatol Res Pract. 2011;2011: 379173.
- Farshi S, Mansouri P, Kasraee Efficacy of cys- teamine cream in the treatment of epidermal mel- asma, evaluating by Dermacatch as a new measurement method: a randomized double blind placebo controlled study. J Dermatolog Treat. 2018;29(2):182–9.
- Mansouri P, Farshi S, Hashemi Z, Kasraee B. Evalu- ation of the efficacy of cysteamine 5% cream in the treatment of epidermal melasma: a randomized double- blind placebo-controlled Br J Derma- tol. 2015;173(1):209–17.
- Nguyen J, Remyn L, Chung IY, Honigman A, Gourani- Tehrani S, Wutami I, et al. Evaluation of the efficacy of cysteamine cream compared to hydroquinone in the treatment of melasma: a ran- domised, double-blinded Australas J Dermatol. 2021;62(1):e41–6.
- Vachiramon V, Kositkuljorn C, Leerunyakul K, Chanprapaph Isobutylamido thiazolyl resorcinol for prevention of UVB-induced hyperpigmentation. J Cosmet Dermatol. 2021;20(3):987–92.
- Cohen PR. Approach to skin lightening in patients with J Drugs Dermatol. 2018;17(9):1018.
- Espinal-Perez LE, Moncada B, Castanedo-Cazares A double-blind randomized trial of 5% ascorbic acid vs. 4% hydroquinone in melasma. Int J Dermatol. 2004;43(8):604–7.
- Zachary CM, Wang JV, Saedi N. Kojic acid for mel- asma: popular ingredient in skincare products. 2020;18(5):271–3.
- Boo YC. Arbutin as a skin depigmenting agent with antimelanogenic and antioxidant properties. Antioxidants (Basel). 2021;10(7):1129.
- Bergfeld W, Tung R, Vidimos A, Vellanki L, Remzi B, Stanton-Hicks U. Improving the cosmetic appear- ance of photoaged skin with glycolic acid. J Am Acad Dermatol. 1997;36(6 Pt 1):1011–3.
- Draelos ZD, Yatskayer M, Bhushan P, Pillai S, Ore- sajo
- Evaluation of a kojic acid, emblica extract, and glycolic acid formulation compared with hydroquinone 4% for skin lightening. Cutis. 2010;86(3):153–8.
- Sarkar R, Bhalla M, Kanwar A comparative study of 20% azelaic acid cream monotherapy versus a sequential therapy in the treatment of melasma in dark-skinned patients. Dermatology. 2002;205(3): 249–54.
- Kanwar AJ, Dhar S, Kaur Treatment of melasma with potent topical corticosteroids. Dermatology. 1994;188(2):170.
- Kanechorn Na Ayuthaya P, Niumphradit N, Manosroi A, Nakakes A. Topical 5% tranexamic acid for the treatment of melasma in Asians: a double- blind randomized controlled clinical J Cosmet Laser Ther. 2012;14(3):150–4.
- El-Husseiny R, Rakha N, Sallam M. Efficacy and safety of tranexamic acid 5% cream vs hydro- quinone 4% cream in treating melasma: a split-face comparative clinical, histopathological, and antera 3D camera study. Dermatol 2020;33(6): e14240.
- Janney MS, Subramaniyan R, Dabas R, Lal S, Das NM, Godara SK. A randomized controlled study comparing the efficacy of topical 5% tranexamic acid solution versus 3% hydroquinone cream in melasma. J Cutan Aesthet Surg. 2019;12(1):63–7.
- Sahu PJ, Singh AL, Kulkarni S, Madke B, Saoji V, Jawade Study of oral tranexamic acid, topical tranexamic acid, and modified Kligman’s regimen in treatment of melasma. J Cosmet Dermatol. 2020;19(6):1456–62.
- Lehraiki A, Abbe P, Cerezo M, Rouaud F, Regazzetti C, Chignon-Sicard B, et al. Inhibition of melano- genesis by the antidiabetic J Invest Dermatol. 2014;134(10):2589–97.
- AboAlsoud ES, Eldahshan RM, AbouKhodair Mohammed H, Elsaie ML. Safety and efficacy of topical metformin 30% cream versus triple combi- nation cream (Kligman’s formula) in treating mel- asma: a randomized controlled study. J Cosmet 2022;21(6):2508– 15.
- Jia X, Qi B, Li Y, Yan H, Guo J, Mu Commentary on ‘‘Metabolic Syndrome in Melasma: A case-con- trol study’’. J Cosmet Dermatol. 2022.
- Kasraee B, Safaee Ardekani GH, Parhizgar A, Hand- jani F, Omrani GR, Samani M, et Safety of topical methimazole for the treatment of melasma. Trans- dermal absorption, the effect on thyroid function and cutaneous adverse effects. Skin Pharmacol Physiol. 2008;21(6):300– 5.
- Gheisari M, Dadkhahfar S, Olamaei E, Moghimi HR, Niknejad N, Najar NN. The efficacy and safety of topical 5% methimazole vs 4% hydroquinone in the treatment of melasma: a randomized controlled J Cosmet Dermatol. 2020;19(1):167–72.
- Juhasz MLW, Levin MK. The role of systemic treat- ments for skin J Cosmet Dermatol. 2018;17(6):1144–57.
- Sarkar R, Devadasan S, Choubey V, Goswami Melatonin and oxidative stress in melasma – an unexplored territory; a prospective study. Int J Dermatol. 2020;59(5):572–5.
- Hamadi SA, Mahammed MM, Aljaf AN, Ali The role of topical and oral melatonin in management of melasma patients. J Assoc Arab Univ Bas Appl Sc. 2010;8:30–42.
- Sampaio Xerfan EM, Andersen ML, Tomimori J, Tufik S, da Silva FA. Melasma and the possible interaction with sleep J Clin Aesthet Der- matol. 2020;13(11):12.
- Grimes P, Bhawan J, Howell M, Desai S, Coryell E, Einziger M, et al. Histopathological changes induced by malassezin: a novel natural microbiome indole for treatment of facial hyperpigmentation. J Drugs Dermatol. 2022;21(2):141–5.
- Grimes PE, Bhawan J, Howell MD, Desai S, Coryell E, Nashawati R, et A novel proof-of-concept study assessing the lightening effects and safety of malassezin for treatment of facial hyperpigmenta- tion. J Am Acad Dermatol. 2022:(ahead of print).
- Cohen PR. Melasma treatment: A novel approach using a topical agent that contains an anti-estrogen and a vascular endothelial growth factor Med Hypotheses. 2017;101:1–5.
- Cohen Topical anti-estrogen therapy to treat melasma. J Clin Aesthet Dermatol. 2017;10(6):16.
- Cohen PR. Melasma treatment with combined chemical peels and a novel topical agent containing an antiestrogen and a vascular endothelial growth factor Dermatol Surg. 2018;44(4):592–3.
- Tan AWM, Sen P, Chua SH, Goh Oral tranex- amic acid lightens refractory melasma. Australas J Dermatol. 2017;58(3):e105–8.
- Wohltmann W. JAAD Game Changers: Random- ized, placebo-controlled, double-blind study of oral tranexamic acid in the treatment of moderate-to- severe melasma. J Am Acad 2019;81(6): 1458.
- Del Rosario E, Florez-Pollack S, Zapata L Jr, Her- nandez K, Tovar-Garza A, Rodrigues M, et Ran- domized, placebo-controlled, double-blind study of oral tranexamic acid in the treatment of moderate- to-severe melasma. J Am Acad Dermatol. 2018;78(2):363–9.
- Cohen PR. Systemic treatments for melasma: adju- vant therapy with a novel topical Int J Der- matol. 2018;57(3):e20–1.
- Cohen Melasma treatment with oral tranexamic acid and a novel adjuvant topical therapy. Cutis. 2018;102(2):106.
- Cassiano D, Esposito ACC, Hassun K, Bagatin E, Lima M, Lima EVA, et al. Efficacy and safety of microneedling and oral tranexamic acid in the treatment of facial melasma in women: an open, evaluator-blinded, randomized clinical J Am Acad Dermatol. 2020;83(4):1176–8.
- Zhu CY, Li Y, Sun QN, Takada A, Kawada A. Analysis of the effect of different doses of oral tranexamic acid on melasma: a multicentre prospective Eur J Dermatol. 2019;29(1):55–8.
- Chowdhary B, Mahajan VK, Mehta KS, Chauhan PS, Sharma V, Sharma A, et Therapeutic efficacy and safety of oral tranexamic acid 250 mg once a day versus 500 mg twice a day: a comparative study. Arch Dermatol Res. 2021;313(2):109–17.
- Lee HC, Thng TG, Goh CL. Oral tranexamic acid (TA) in the treatment of melasma: a retrospective J Am Acad Dermatol. 2016;75(2):385–92.
- Bala HR, Lee S, Wong C, Pandya AG, Rodrigues M. Oral tranexamic acid for the treatment of melasma: a Dermatol Surg. 2018;44(6):814–25.
- Ni Z, Mu Y, Gulati O. Treatment of melasma with Phytother Res. 2002;16(6):567–71.
- Pinto CAS, Delfes MFZ, Reis LM, Garbers LE, Torre DS, Passos The use of pycnogenol in the treatment of melasma. Surg Cosm Dermatol. 2015;7(3):218–22.
- Middelkamp-Hup MA, Pathak MA, Parrado C, Goukassian D, Rius-Diaz F, Mihm MC, et Oral Polypodium leucotomos extract decreases ultravio- let- induced damage of human skin. J Am Acad Dermatol. 2004;51(6):910–8.
- Zattra E, Coleman C, Arad S, Helms E, Levine D, Bord E, et al. Polypodium leucotomos extract decreases UV- induced Cox-2 expression and inflammation, enhances DNA repair, and decreases mutagenesis in hairless mice. Am J Pathol. 2009;175(5):1952–61.
- Ahmed AM, Lopez I, Perese F, Vasquez R, Hynan LS, Chong B, et al. A randomized, double-blinded, placebo- controlled trial of oral Polypodium leuco- tomos extract as an adjunct to sunscreen in the treatment of melasma. JAMA 2013;149(8):981–3.
- Goh CL, Chuah SY, Tien S, Thng G, Vitale MA, Delgado-Rubin A. Double-blind, placebo-controlled trial to evaluate the effectiveness of polypodium leucotomos extract in the treatment of melasma in asian skin: a pilot J Clin Aesthet Dermatol. 2018;11(3):14–9.
- Stahl W, Sies H. beta-Carotene and other car- otenoids in protection from Am J Clin Nutr. 2012;96(5):1179S-S1184.
- Arjinpathana N, Asawanonda P. Glutathione as an oral whitening agent: a randomized, double-blind, placebo- controlled J Dermatolog Treat. 2012;23(2):97–102.
- Avianggi HD, Indar R, Adriani D, Riyanto P, Mus- limin M, Afriliana L, et al. The effectiveness of tomato extract on superoxide dismutase (SOD) and severity degree of patients with Ital J Dermatol Venerol. 2022;157(3):262–9.
- Lee KC, Wambier CG, Soon SL, Sterling JB, Landau M, Rullan P, et al. Basic chemical peeling: superficial and medium-depth J Am Acad Dermatol. 2019;81(2):313–24.
- Azzam OA, Leheta TM, Nagui NA, Shaarawy E, Hay RM, Hilal Different therapeutic modalities for treatment of melasma. J Cosmet Dermatol. 2009;8(4):275– 81.
- Ogbechie-Godec OA, Elbuluk N. Melasma: an up-to- date comprehensive review. Dermatol Ther (Hei- delb). 2017;7(3):305–18.
- Rendon MI, Berson DS, Cohen JL, Roberts WE, Starker I, Wang B. Evidence and considerations in the application of chemical peels in skin disorders and aesthetic J Clin Aesthet Dermatol. 2010;3(7):32–43.
- Sarkar R, Bansal S, Garg Chemical peels for melasma in dark-skinned patients. J Cutan Aesthet Surg. 2012;5(4):247–53.
- Erbil H, Sezer E, Tastan B, Arca E, Kurumlu Z. Effi- cacy and safety of serial glycolic acid peels and a topical regimen in the treatment of recalcitrant J Dermatol. 2007;34(1):25–30.
- Sharquie KE, Al-Tikreety MM, Al-Mashhadani SA. Lactic acid chemical peels as a new therapeutic modality in melasma in comparison to Jessner’s solution chemical peels. Dermatol Surg. 2006;32(12):1429–36.
- Singh R, Goyal S, Ahmed QR, Gupta N, Singh Effect of 82% lactic acid in treatment of melasma. Int Sch Res Notices. 2014;2014: 407142.
- Cuce LC, Bertino MC, Scattone L, Birkenhauer MC. Tretinoin Dermatol Surg. 2001;27(1):12–4.
- Khunger N, Sarkar R, Jain RK. Tretinoin peels versus glycolic acid peels in the treatment of Melasma in dark- skinned Dermatol Surg. 2004;30(5): 756–60; discussion 60.
- Raminelli ACP, Rodrigues-Oliveira AF, Yokota R, Sumita JM, Oliveira-Silva D, Wambier CG, et Cutaneous absorption of tretinoin in 0.05% cream and 5% chemical peel formulas. J Am Acad Der- matol. 2020;83(5):1483–5.
- Rivas S, Pandya Treatment of melasma with topical agents, peels and lasers: an evidence-based review. Am J Clin Dermatol. 2013;14(5):359–76.
- Sarma N, Chakraborty S, Poojary SA, Rathi S, Kumaran S, Nirmal B, et Evidence-based review, grade of recommendation, and suggested treatment recommendations for melasma. Indian Dermatol Online J. 2017;8(6):406–42.
- Liu Y, Wu S, Wu H, Liang X, Guo D, Zhuo Comparison of the efficacy of melasma treatments: a network meta-analysis of randomized controlled trials. Front Med (Lausanne). 2021;8: 713554.
- Safoury OS, Zaki NM, El Nabarawy EA, Farag EA. A study comparing chemical peeling using modified Jessner’s solution and 15% trichloroacetic Acid versus 15% trichloroacetic acid in the treatment of Indian J Dermatol. 2009;54(1):41–5.
- Lima Microneedling in facial recalcitrant mel- asma: report of a series of 22 cases. An Bras Der- matol. 2015;90(6):919–21.
- Cassiano DP, Esposito ACC, Hassun KM, Lima EVA, Bagatin E, Miot Early clinical and histological changes induced by microneedling in facial mel- asma: a pilot study. Indian J Dermatol Venereol Leprol. 2019;85(6):638–41.
- Bailey AJM, Li HO, Tan MG, Cheng W, Dover JS. Microneedling as an adjuvant to topical therapies for melasma: a systematic review and meta-analysis. J Am Acad 2022;86(4):797–810.
- Cassiano DP, Esposito ACC, Hassun KM, Lima M, Lima EVA, Miot LDB, et Histological changes in facial melasma after treatment with triple combi- nation cream with or without oral tranexamic acid and/or microneedling, a randomised clinical trial. Indian J Dermatol Venereol Leprol. 2022:1–10.
- Sasaki GH. Micro-needling depth penetration, presence of pigment particles, and fluorescein- stained platelets: clinical usage for aesthetic con- cerns. Aesthet Surg J. 2017;37(1):71–83.
- Gulfan MCB, Wanitphakdeedecha R, Wongdama S, Jantanapornchai N, Yan C, Rakchart Efficacy and safety of using noninsulated microneedle radiofre- quency alone versus in combination with polynu- cleotides for the treatment of melasma: a pilot study. Dermatol Ther (Heidelb). 2022;12(6): 1325–36.
- Park BJ, Jung YJ, Ro YS, Chang SE, Kim JE. Thera- peutic effects of new pulsed-type microneedling radiofrequency for refractory facial pigmentary dis- Dermatol Surg. 2022;48(3):327–33.
- Jung JW, Kim WO, Jung HR, Kim SA, Ryoo YW. A face-split study to evaluate the effects of micro- needle radiofrequency with Q-switched Nd:YAG laser for the treatment of Ann Dermatol. 2019;31(2):133–8.
- Khalili M, Amiri R, Iranmanesh B, Zartab H, Afla- toonian M. Safety and efficacy of mesotherapy in the treatment of melasma: a review J Cosmet Dermatol. 2022;21(1):118–29.
- Sarkar R, Gupta M. Platelet-rich plasma in melasma- a systematic Dermatol Surg. 2022;48(1): 131–4.
- Trivedi MK, Yang FC, Cho BK. A review of laser and light therapy in Int J Womens Dermatol. 2017;3(1):11–20.
- Micek I, Pawlaczyk M, Kroma A, Seraszek-Jaros A, Urbanska M, Gornowicz-Porowska Treatment of melasma with a low-fluence 1064 nm Q-switched Nd:YAG laser: laser toning in Caucasian women. Lasers Surg Med. 2022;54(3):366–73.
- Brown AS, Hussain M, Goldberg DJ. Treatment of melasma with low fluence, large spot size, 1064-nm Q- switched neodymium-doped yttrium aluminum garnet (Nd:YAG) laser for the treatment of melasma in Fitzpatrick skin types II–IV. J Cosmet Laser 2011;13(6):280–2.
- Tian B. The Asian problem of frequent laser toning for J Clin Aesthet Dermatol. 2017;10(7): 40–2.
- Vachiramon V, Iamsumang W, Triyangkulsri K. Q- switched double frequency Nd:YAG 532-nm nanosecond laser vs. double frequency Nd:YAG 532-nm picosecond laser for the treatment of solar lentigines in Asians. Lasers Med 2018;33(9): 1941–7.
- Lee MC, Lin YF, Hu S, Huang YL, Chang SL, Cheng CY, et al. A split-face study: comparison of picosecond alexandrite laser and Q-switched Nd: YAG laser in the treatment of melasma in Lasers Med Sci. 2018;33(8):1733–8.
- Wanitphakdeedecha R, Manuskiatti W, Siri- phukpong S, Chen TM. Treatment of melasma using variable square pulse Er:YAG laser Dermatol Surg. 2009;35(3):475–81; discussion 81–2.
- Wanitphakdeedecha R, Sy-Alvarado F, Patthamalai P, Techapichetvanich T, Eimpunth S, Manuskiatti W. The efficacy in treatment of facial melasma with thulium 1927- nm fractional laser-assisted topical tranexamic acid delivery: a split-face, double-blind, randomized controlled pilot Lasers Med Sci. 2020;35(9):2015–21.
- Passeron T. Long-lasting effect of vascular targeted therapy of J Am Acad Dermatol. 2013;69(3):e141–2.
- Kunachak S, Leelaudomlipi P, Wongwaisayawan S. Dermabrasion: a curative treatment for Aesthetic Plast Surg. 2001;25(2):114–7.
- Abdel-Motaleb AA, Bakr Microdermabrasion assisted delivery of glycolic acid 70% peel for the treatment of melasma in dark-skinned patients. Dermatol Ther. 2021;34(4): e15025.



