Bài viết Sinh bệnh học về nám là gì? Các yếu tố gây ra nám được dịch bởi Bác sĩ Phạm Tăng Tùng từ Sách “ĐIỀU TRỊ NÁM Ở NGƯỜI CHÂU Á” của các tác giả Evangeline B. Handog, Maria Juliet Enriquez Macarayo.
1. Giới thiệu
Mặc dù yếu tố về gen, tia cực tím, và hormone sinh dục nữ được xem là các yếu tố ảnh hưởng [1-4], tuy nhiên những bằng chứng gần đây cho rằng còn có thêm các yếu tố khác nữa có thể đóng vai trò trong hình thành và tái phát của nám. Các nhà nghiên cứu đã tập trung vào nghiên cứu sự hoạt hóa tế bào sắc tố tại vị trí tổn thương thông qua các chất trung gian cận tiết và tự tiết [5-7]. Một số loại protein và thành phần của tế bào, các yếu tố tăng trưởng, và cơ chế truyền tín hiệu đã được cho là có liên quan chặt chẽ với sinh bệnh học của nám.
Các nhóm chủng tộc khác nhau có sự đa dạng về phân loại ánh sáng của da, về sắc tố và có tỉ lệ nám khác nhau [8]. Do đó, nám có sinh bệnh học rất phức tạp mà đến nay vẫn chưa được làm sáng tỏ. Tuy nhiên, các đặc điểm mô bệnh học khác biệt của nám cung cấp những gợi ý cho quá trình nghiên cứu để hiểu hơn về cơ chế bệnh sinh của rối loạn sắc tố da này.

2. Yếu tố ảnh hưởng chính
2.1. Yếu tố về gen
Gen là yếu tố nguy cơ quan trọng nhất trong nám. Tuy nhiên, chưa có quy luật phân li của Menden nào được xác định [9]. Một trường hợp nám xảy ra ở một cặp sinh đôi đã được báo cáo tại Anh năm 1987. Tình trạng này được khởi phát bởi các kích thích hormone và làm nặng thêm sau khi tiếp xúc với ánh sáng. Tuy nhiên, nám lại không thấy xuất hiện ở một người chị khác (không sinh đôi) của hai người này, điều này giúp củng cố giả thuyết về khả năng tác động của gen đến sự hình thành của nám [10].
Một vài nghiên cứu đã được tiến hành nhằm xác định tỉ lệ nám trong quần thể dân số chung. Tỉ lệ nám được ghi nhận từ khoảng 8.8% trong số các phụ nữ người Hispanis ở Nam Mỹ cho đến tỉ lệ cao 40% ở người châu Á [11, 12]. Trong một khảo sát tự đánh giá của 324 phụ nữ, thì 48% bệnh nhân nám có tiền sử gia đình nám (97% là quan hệ trực hệ). Bệnh nhân có phân loại da type I hoặc II (34%) có tiền sử gia đình nám có tỉ lệ ít hơn so với những người thuộc type da III – VI (57%). Những người có tiền sử nám gia đình thường có da sạm màu hơn (90% type III-VI) so với những người không có tiền sử gia đình (77% type III-VI) [3].

2.2. Yếu tố hormone
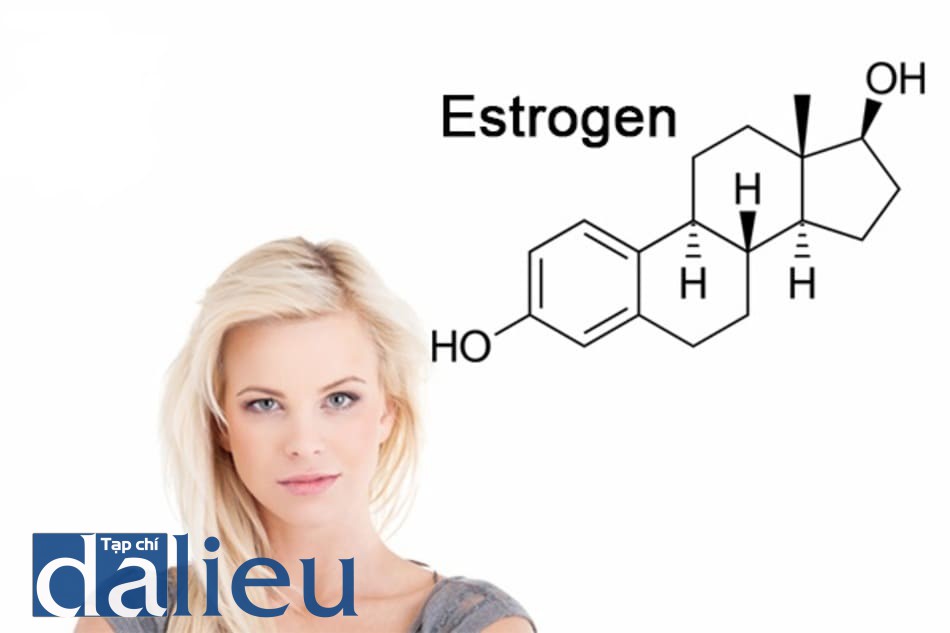
Các hormone sinh dục như estrogen và progesterone là những nhân tố liên quan đến sự điều hòa sắc tố da [13]. Nám phổ biến hơn ở phụ nữ, chiếm khoảng 90% các trường hợp. Các báo cáo ghi nhận có khoảng 50-70% phụ nữ mang thai và 10-20% phụ nữ sử dụng thuốc tránh thai đường uống bị nám [14, 15]. Những bằng chứng lâm sàng này cho thấy estrogen có thể khởi phát nám.
Trong một mô hình nuôi cấy tế bào in vitro, estradiol được cho là có khả năng tăng cường hoạt động enzyme tyrosinase, tyrosinase-related protein (TRP)-1, và bản sao TRP-2 [16]. Quá trình tổng hợp melanin trong tế bào melanocyte nuôi cấy cũng tăng bởi 17β-estradiol [17]. Ngoài ra, biểu hiện thụ thể estrogen (ER)β cũng có xu hướng tăng trong các tổn thương nám so với những vùng da bình thường (trung bình ± độ lệch chuẩn: 0.39 ± 0.17 so với 0.31 ± 0.17, p > 0.05). Ngoài ra số lượng thụ thể progesterone (PR) cũng tăng đáng kể trong các tổn thương nám so với vùng thượng bì bình thường (trung bình ± độ lệch chuẩn: 0.47 ± 0.15 so với 0.36 ± 0.14, p = 0.03) [18]. Điểm thú vị là sự gia tăng hoạt động miễn dịch của ERβ cũng đã được ghi nhận ở da nám, đặc biệt là vùng quanh các mạch máu nhỏ và các tế bào giống nguyên bào sợi so với vùng da lành (1.33 ± 0.82 so với 0.97 ± 0.59, p = 0.04). Tuy nhiên, không có sự khác biệt có ý nghĩa thống kê giữa mức độ biểu hiện của PR giữa vùng tổn thương và vùng da lành (1.24 ± 0.90 so với 0.96 ± 0.68, p = 0.17) [18]. Các kết quả nghiên cứu này cho thấy có thể có mối liên hệ giữa thụ thể hormone và nám.
2.3. Tia UV
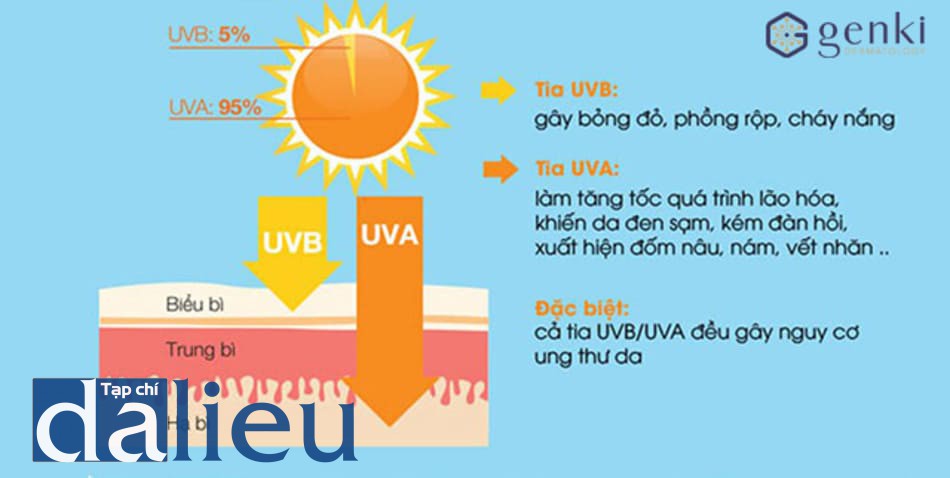
Mức độ thoái hóa mô đàn hồi cao hơn ở trong các tổn thương nám cho thấy tiếp xúc mạn tính với ánh sáng mặt trời là điều kiện cần thiết hình thành nám. Sau khi tiếp xúc với UVB, các tế bào sừng (keratinocyte) sẽ làm tăng sinh tế bào melanocyte (melano- cyte) và quá trình tổng hợp melanin bằng cách tiết ra yếu tố tế bào gốc (SCF), yếu tố tăng trưởng nguyên bào sợi cơ bản (bFGF), interleukin-1, endothelin-1, inducible nitric oxide synthase, hormone kích thích α-melanocyte, và hormone hướng vỏ thượng thận (ACTH) [19-22]. Sự bài tiết prostaglandin E2 sau khi tiếp xúc UVB làm cho các sợi nhánh tế bào melanocyte lớn hơn [23]. Hơn nữa, tổn thương ánh sáng lớp thượng bì có thể gây tiết cytokine tổng hợp melanin như SCF và yếu tố tăng trưởng tế bào gan từ các nguyên bào sợi da, từ đó ảnh hưởng đến sự hình thành sắc tố thượng bì [24, 25]. Nguyên bào sợi da tiết SCF dạng hòa tan trong giai đoạn tăng trưởng nhanh hoặc quá trình viêm. Do đó, quá trình viêm do tích lũy tia UV có thể liên quan đến việc hoạt hóa nguyên bào sợi, là nguyên nhân chính làm tăng cường hoạt động SCF tại vùng da nám. Biểu hiện mRNA của SCR tăng đáng kể trong các tổn thương nám so với các tổn thương bình thương (0.83 ± 0.5 so với 0.51 ± 0.4, p < 0.01). RT-PCR (realtime PCR- phản ứng tổng hợp chuỗi thời gian thực) của c-kit mRNA cũng cho thấy có sự khác biệt lớn trong biểu hiện giữa vùng nám và vùng da thường (0.78 ± 0.7 so với 0.57 ± 0.6, p < 0.01). Do đó, sự gia tăng tổng hợp SCF hòa tan trong vùng da nám là thông qua tính hiệu được tạo bởi c-kit/SCF trong quá trình hoạt hóa melanocyte, dẫn đến sự tăng sinh tế bào melanocyte và tăng tổng hợp melanin [5].
3. Các yếu tố khác
3.1. Thay đổi biểu hiện gen
Nồng độ các yếu tố liên quan đến tạo melainin (tyrosinase, TRP-1, dopachrome tau- tomerase, bạc) tăng trong các tổn thương nám, cho thấy có hoạt động tạo melanin cao hơn ở những tổn thương này. Điểm thú vị khác nữa là các gen liên quan đến chuyển hóa lipid (peroxisome proliferator-activated receptor α (PPAR α), arachidonate 15-lipoxygenase (ALOX15), type B (ALOX15B), diacylglycerol O-acyltransferase2-like 3, và PPAR-γ đồng hoạt hóa 1α) giảm hoạt động trong các tổn thương nám. Điều này được cũng cố bởi sự hạn chế chức năng hàng rào da ở trong các tổn thương này.
Các yếu tố liên quan đến truyền tín hiệu Wnt (yếu tố ức chế Wnt (WIF)-1, secreted frizzled-related protein 2 (SFRP2), và Wnt5a) cũng được cho là có sự tăng cường hoạt động trong các tổn thương nám [26]. Con đường tín hiệu Wnt đóng vai trò rất quan trọng trong hình thành melanocyte thượng bì, và yếu tố sao mã liên quan đến microphthalmia (MITF) là một chất trung gian của con đường này [27, 28]. Nồng độ melanin và hoạt động của tyrosinase trong các tế bào melanocyte thượng bì tăng đáng kể như là kết quả của việc biểu hiện WIF-1 quá mức. Do đó, WIF-1 có thể có chức năng sinh lý trong melanocyte như là một chất điều biến tự tiết hoặc cận tiết của con đường truyền tín hiệu Wnt [29]. Sự gia tăng SFRP2 được quan sát thấy quanh các nguyên bào sợi cũng cho thấy khả năng giao tiếp chéo giữa lớp bì và thượng bì thông qua con đường Wnt trong nám [26].
Một nghiên cứu thú vị khác cho thấy giảm hoạt H19 kích thích tạo melanin ở người bị nám [30]. Gen H19 sao mã ra một RNA 2.3 kb không mã hóa, RNA này được cho là có thể có vai trò trong một số tổn thương ác tính [31, 32]. Bất hoạt H19 trong hệ thống nuôi cấy tế bào hỗn hợp (keratinocyte và melanocyte) đã làm tăng sự biểu hiện của tyrosinase cũng như tăng vận chuyển melanosome vào tế bào sừng (keratinocyte). Phối hợp điều trị estrogen và bất hoạt H19 RNA đã tạo ra hiệu ứng cộng gộp lên sự biểu hiện của tyrosinase trong hệ thống nuôi cấy tế bào hỗn hợp, trong khi đó tia UV không thể làm được điều này. Những điều này cho thấy khi giảm hoạt H19 và sử dụng đủ lượng estrogen có thể liên quan đến sự hình thành nám [30].
3.2. Các yếu tố về mô bệnh học
Tăng sắc tố thượng bì
Đặc điểm mô học đặc trưng nhất của nám là tăng melanin ở lớp thượng bì, và trong một nghiên cứu lâm sàng trên 56 bệnh nhân nám Hàn Quốc thì người ta nhận thấy sắc tố thượng bì tăng trong các tổn thương nám [33]. Các kết quả nghiên cứu tương tự cũng được tìm thấy trong 11 ca nám có phân loại da theo Fitzpatrick từ IV-VI [34].
Liên kết cận tiết giữa các tế bào sừng, nguyên bào sợi, và tế bào melanocyte đóng vai trò quan trọng trong điều hòa quá trình melanin hóa thượng bì [5]. Nhuộm Fontana-Mason cho thấy nồng độ melanin trong da nám cao hơn ở tất cả các lớp tế bào của thượng bì, kể cả lớp sừng [33, 35, 36]. Phân tích hình ảnh trên da của 22 bệnh nhân nám đã phát hiện thấy sự khác biệt lớn về mật độ melanin giữa da nám (0.37±0.02) và da bình thường xung quanh (0.34±0.02) (p<0.01) [37]. Dựa trên những phát hiện này, người ta cho rằng sự hình thành nám có liên quan đến tăng tổng hợp melanin, tăng mức độ vận chuyển melanin vào tế bào sừng, và giảm thoái hóa melanosome [33].
Các báo cáo cho thấy số lượng tế bào melanocyte trong nám không ổn định. Kang và các cộng sự đã phát hiện thấy số hàm lượng melanin và số lượng tế bào melanocyte cao hơn trong da nám. Nghiên cứu này dựa vào phân tích hình ảnh định lượng của 56 lát cắt nhuộm Fontana-Masson. Khi so sánh với vùng da thường xung quanh, thì số lượng tế bào melanocyte trên mỗi milimet chiều cao của thượng bì và trên mỗi milimet của mào thượng bì tăng lần lượt 24% và 27%. Ngoài ra, khảo sát siêu cấu trúc cho thấy có sự gia tăng số lượng melanosome và melanocyte [3].
Ngược lại, một nghiên cứu được tiến hành bởi Grimes lại không tìm thấy sự gia tăng đáng kể số lượng melanocyte trong da nám so với vùng da thường xung quanh trên 22 mẫu da được nhuộm miễn dịch bằng Mel-5 thuộc nhóm bệnh nhân có phân loại Fitzpatrick type IV-VI [34]. Hơn nữa, khi Miot nghiên cứu trên 44 bệnh nhân nám, ông cũng không thấy bất kì sự khác biệt nào về số lượng tế bào melanocyte giữa lam kính da nám và vùng da thường sau khi nhuộm kháng thể Melan-A [37]. Khi quan sát dưới kính hiển vi điện tử, người ta thấy da nám có số lượng hạt melanosome nhiều hơn trong các tế bào sừng (keratocyte) và tế bào melanocyte (melanocyte), và số lượng nhánh của mỗi tế bào sừng trong da nám (7.55 ± 2.53 nhánh mỗi keratocyte) cũng cao hơn nhiều so với trong da bình thường (5.28 ± 1.85 nhánh mỗi keratocyte) (p<0.05) [34]. Hơn nữa, hình ảnh kính hiển vi điện tử đã chứng minh sự gia tăng mức độ hoạt động bên trong melano- cyte ở vùng da nám, điều này được suy ra từ sự gia tăng số lượng các bào quan như ti thể, bộ máy golgi, mạng lưới nội chất, và ribosomes trong tế bào [33].
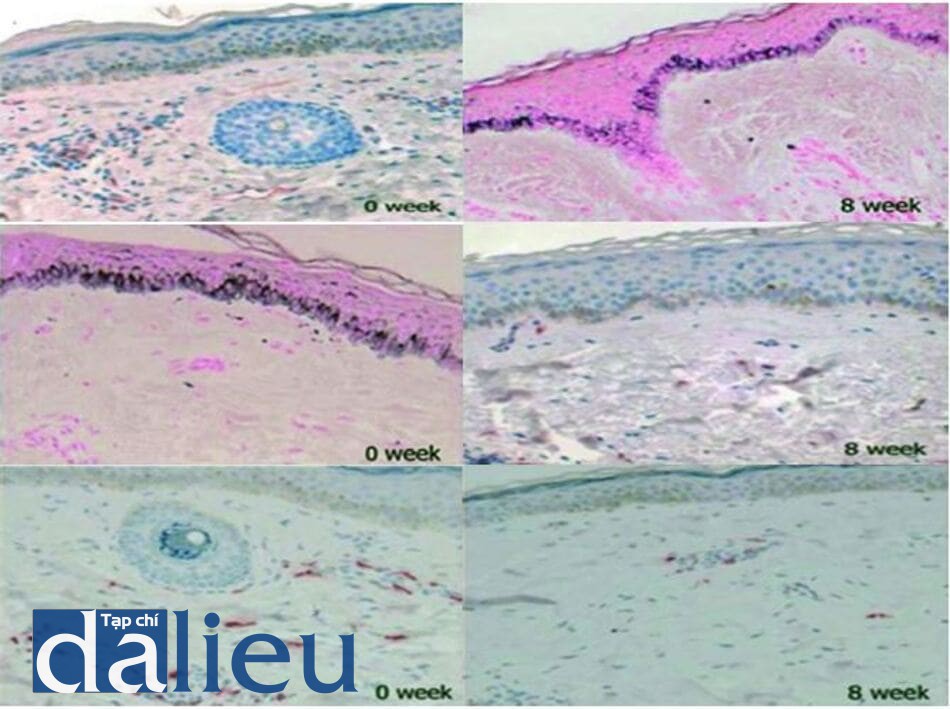
Các bằng chứng hóa mô miễn dịch cho thấy có sự gia tăng các protein liên quan đến tổng hợp melanin. Kỹ thuật hóa mô miễn dịch sử dụng NKI-beteb (kháng thể nhận diện kháng nguyên pmel-17 đặc trưng của melanocyte) cho thấy vùng da nám bắt màu đậm hơn so với vùng da lành khi nhuộm (hình 4.1) [38]. Nhuộm miễn dịch Mel-5 (giúp phát hiện TRP-1), cũng bắt màu đậm hơn trên da nám so với da lành, điều này cho thấy hàm lượng TRP-1 cao hơn trong các tế bào melanocyte ở vùng nám [33]. Hơn nữa, TRP-2 cũng tăng biểu hiện trong nám (hình 4.1). Những kết quả này ủng hộ cho giả thuyết có sự tăng tổng hợp melanin trong sinh bệnh học của nám.
![Hình 4.1 Nhuộm miễn dịch NKI-beteb và tyrosinase-related protein (TRP)-2 trước và sau điều trị với niacinamide và chiết xuất đậu nành trong 8 tuần. Nhuộm miễn dịch (a) NKI- beteb trước điều trị (x100), (b) NKI-beteb sau điều trị (x100), (c) TRP-2 trước điều trị (x100), (d) TRP-2 sau điều trị (x100) [38].](https://tapchidalieu.com/wp-content/uploads/2021/01/sinh_benh_hoc_nam_6.jpg)
Phá vỡ màng đáy
Một số nghiên cứu đã được tiến hành để điều tra về trạng thái của màng đáy ở vùng da nám. Sanchez đã chứng minh có hiện tượng thoái hóa không bào của các tế bào màng đáy và thoái hóa không bào tiêu điểm trên màng đáy ở 3.9% (3/76) mẫu da nám [39]. Ngược lại, Kang đã không hề thấy hiện tượng phá vỡ màng đáy trong nghiên cứu của ông trên các mẫu da được lấy từ 56 bệnh nhân nám Hàn Quốc thông qua nhuộm D-PAS và xem dưới kính hiển vi điện tử [33]. Tuy nhiên, các tác giả này cũng đã thừa nhận rằng melanocyte không ổn định và bất thường màng đáy là một nét đặc trưng của nám [6].
Một nghiên cứu khác trên những bệnh nhân nám có phân loại da type IV và V cho thấy khi nhuộm PAS thì thấy xuất hiện tổn thương màng đáy ở 95.8% các tổn thương nám so với 58.3 % ở vùng da lành, và với kháng thể kháng collagen type IV, kết quả cho thấy có tổn thương ở 83% các tổn thương nám so với 66% vùng da lành.
Phá vỡ màng đáy có thể do tăng nồng độ matrix metalloproteinase (MMP)-2 và MMP-2, những enzyme này làm thoái hóa collagen type IV và VI khi tiếp xúc mạn tính với tia UV [40]. Biểu hiện MMP-2 tăng trong vùng da tổn thương so với vùng da thường (0.018 ± 0.014 so với 0.004 ± 0.005, p= 0.006) [6]. Vì melanin tự do và các túi chứa melanin hiện diện ở lớp bì của da nám, nên sự phá vỡ màng đáy có thể đã khiến các tế bào melanocyte và melanin di chuyển vào lớp bì, điều này phản ánh tính trạng tăng sắc tố cố định của nám [33, 36].
Thoái hóa mô đàn hồi do ánh sáng mặt trời.
Nhiều nghiên cứu quan sát cho rằng tiếp xúc với ánh sáng mặt trời là nguyên nhân khởi phát hàng đầu của nám. Nám đặc biệt xuất hiện ở vùng mặt, vùng phơi bày ánh sáng, và vào mùa nắng nhiều như mùa hè. Thoái hóa mô đàn hồi do ánh sáng mặt trời đặc biệt nổi bật ở vùng da bị nám so với vùng da lành khác [35]. Kang và các cộng sự đã báo cáo có thoái hóa mô đàn hồi ở mức độ từ trung bình đến nặng ở 93% bệnh nhân nám trong nghiên cứu của họ [33]. Vùng da nám trong nghiên cứu có mức độ thoái hóa mô đàn hồi cao hơn so với vùng da lành (83% so với 29%, p <0.05). Hơn nữa, khối lượng vật chất bị thoái hóa cũng cao hơn ở vùng da nám (13.3 ± 2,8% so với 10.2 ± 2.9%, p <0.001). Ngoài ra, tại vùng da nám người ta còn thấy các sợi elastin dày, cong, và vỡ nhiều mảnh hơn khi quan sát lát cắt nhuộm Verhoeff-van Gieson-stained [33].
Tăng sinh mạch máu
Các bằng chứng tích lũy đã cho thấy số lượng mạch máu trong các tổn thương nám cao hơn so với da lành [41-43]. Tăng sinh số lượng mạch máu nổi trội hơn so với tăng kích thước mạch máu. Từ kết quả trên, ta có thể thấy rằng hồng ban thấy ở các bệnh nhân nám có thể là do tăng sinh mạch và giãn mạch gây ra [41]. Trong một nghiên cứu hóa mô miễn dịch kháng nguyên liên quan đến yếu tố VIIIa, người ta thấy có sự tăng sinh, tăng kích thước, và tăng mật độ mạch máu ở vùng da nám so với da lành [41].
Sự tăng biểu hiện của yếu tố tăng trưởng nội mô mạch máu (VEGF) trong các tế bào sừng đã khiến người ta đặt ra giả thuyết rằng VEGF có thể đóng một vai trò quan trọng trong hành vi hoạt động của melanocyte, vì thụ thể chức năng của VEGF đã được chứng minh là có mặt ở tế bào melanocyte trong ống nghiệm [44]. Gia tăng nồng độ c-kit, SCF, và inducible nitric oxide synthase cũng đã được quan sát thấy ở vùng da nám, đây là những chất có thể ảnh hưởng đến quá trình tăng sinh mạch máu [5, 45]. Hơn nữa, các mạch máu hoặc các tế bào nội mô đã bị điều biến bởi tia UV có thể tiết ra các cytokine và các yếu tố hòa tan như plasminogen, đây là chất có thể gây tăng sắc tố trong nám [46].
Tranexamic acid (TXA) ức chế plasmin, đây là chất mấu chốt trong quá trình tăng sinh mạch có khả năng chuyển VEGF liên kết matrix ngoại bào thành dạng tự do của nó [47]. TXA đã được báo cáo là có khả năng ức chế yếu tố tân sinh mạch bFGF [48]. Một thử nghiệm lâm sàng gần đây đã đánh giá hiệu quả của TXA đường uống trong điều trị nám, TXA đã được chứng minh là đã làm giảm đáng kể chỉ số nám và chỉ số hồng ban (melanin index và erythema index) sau khi uống TXA 250 mg, 3 lần mỗi ngày, trong 8 tuần [49]. Nghiên cứu mô học cho thấy có sự giảm đáng kể mức độ tăng sắc tố thượng bì và số lượng bì (Hình 4.2a-d). Những phát hiện này chứng minh được sự mối liên quan giữa tăng sinh mạch máu và melanocyte có thể có ảnh hưởng đến sự hình thành sắc tố trong nám.
Tỉ lệ dưỡng bào
Người ta thấy có nhiều dưỡng bào bên trong vùng da nám hơn là vùng da lành, đặc biệt ở những vùng thoái hóa mô đàn hồi da (hình 4.2 e, f) [49]. Tỉ lệ trung bình của dưỡng bào ở vùng da nám cao hơn rất nhiều so với vùng da lành (173±57% so với 145±57%, p=0,04) [35]. Khi sử dụng kháng thể antitryptase, số lượng dưỡng bào là 58±39.9 tế bào/mm2 ở vùng da nám và so với 37±28.8 tế bào/ mm2 ở vùng da lành (p<0.04) [36].
Vai trò của dưỡng bào trong cơ chế hình thành nám còn chưa được sáng tỏ. Vì tiếp xúc lặp lại với tia UV sẽ tạo ra tryptase dưỡng bào, chất này làm thoái hóa collagen type IV, làm tăng số lượng dưỡng bào và nồng độ tryptase nên có thể làm yếu màng đáy ở vùng da bị nám [50]. Dưỡng bào có thể khởi phát thoái hóa mô đàn hồi ánh sáng bằng cách thúc đẩy tổng hợp elastin từ nguyên bào sợi một cách trực tiếp hoặc thông qua các loại tế bào hoặc cytokines khác [51, 52]. Thoái hóa mô đàn hồi ánh sáng không xuất hiện ở những con chuột thiếu dưỡng bào khi chúng được chiếu UV lặp lại [53]. Tình trạng viêm da mạn tính có thể là nguyên nhân hình thành nám được phản ánh thông qua hiện tượng tăng số lượng dưỡng bào, kết hợp với xâm nhiễm bạch cầu và giãn các mạch máu [35]. Dưỡng bào cũng có thể làm tăng sinh mạch máu bằng cách tiết ra các yếu tố tăng sinh mạch như VEGF, yếu tố tăng trưởng nguyên bào sợi FGF-2, và yếu tố tăng trưởng biến đổi TGF-β [54].
4. Kết luận
Ngoài các yếu tố về gen và phơi bày ánh sáng thì nám còn có mối liên quan với hormone sinh dục/thụ thể hormone sinh dục. Ngoài ra, các nghiên cứu về gen cho thấy nám có thể liên quan đến sự thay đổi biểu hiện gen, đặc biệt là các gen liên quan đến quá trình tạo melanin, con đường truyền tin Wnt và chuyển hóa lipid. Mặc dù nám được đặc trưng bởi tăng sắc tố thượng bì, tuy nhiên lại có nhiều kết quả khác nhau khi nghiên cứu trên mô học như tăng sắc tố thượng bì, phá vỡ màng đáy, thoái hóa mô đàn hồi, tăng sinh mạch máu, và tăng tỉ lệ dưỡng bào. Những kết quả nghiên cứu này cho thấy những yếu tố kể trên đóng vai trò quan trọng trong cơ chế sinh bệnh học của nám.
5. Tài liệu tham khảo
- Pathak MA, Riley FC, Fitzpatrick TB. Melanogenesis in human skin following exposure to long-wave ultraviolet and visible light. J Invest Dermatol. 1962;39:435–43.
- Grimes Melasma. Etiologic and therapeutic considerations. Arch Dermatol. 1995;131:1453–7.
- Ortonne JP, Arellano I, Berneburg M, Cestari T, Chan H, Grimes P, et A global survey of the role of ultraviolet radiation and hormonal influences in the development of melasma. J Eur Acad Dermatol Venereol. 2009;23:1254–62.
- Resnik S. Melasma induced by oral contraceptive drugs. JAMA. 1967;199:601–5.
- Kang HY, Hwang JS, Lee JY, Ahn JH, Kim JY, Lee ES, Kang WH. The dermal stem cell f and c-kit are overexpressed in melasma. Br J Dermatol. 2006;154:1094–9.
- Lee DJ, Park KC, Ortonne JP, Kang Pendulous melanocytes: a characteristic feature of melasma and how it may occur. Br J Dermatol. 2012;166:684–6.
- Lee J, Jung E, Huh S, Boo YC, Hyun CG, Kim YS, Park Mechanisms of mela- nogenesis inhibition by 2,5-dimethyl-4-hydroxy-3(2H)-furanone. Br J Dermatol. 2007;157:242–8.
- Hexsel D, Arellano I, Rendon M. Ethnic considerations in the treatment of Hispanic and Latin- American patients with hyperpigmentation. Br J Dermatol. 2006;156(S1):7–12.
- Miot LD, Miot HA, Silva MG, Marques ME. Physiopathology of melasma. An Bras Dermatol. 2009;84:623–35.
- Hughes BR. Melasma occurring in twin sisters. J Am Acad 1987;17:841.
- Werlinger KD, Guevara IL, Gonzalez CM, Rincon ET, Caetano R, Haley RW, Pandya Prevalence of self-diagnosed melasma among premenopausal Latino women in Dallas and Fort Worth Tex. Arch Dermatol. 2007;143:424–5.
- Sivayathorn Melasma in orientals. Clin Drug Invest. 1995;10(S 2):34–40.
- Verdier-Sevrain S, Bonte F, Gilchrest B. Biology of estrogens in skin: implica- tions for skin aging. Exp Dermatol. 2006;15:83–94.
- Moin A, Jabery Z, Fallah Prevalence and awareness of melasma during preg- nancy. Int J Dermatol. 2006;45:285–8.
- Cestari T, Arellano I, Hexsel D, Ortonne Melasma in Latin America: op- tions for therapy and treatment algorithm. J Eur Acad Dermatol Venereol. 2009;23:760–72.
- Kippenberger S, Loitsch S, Solano F, Bernd A, Kaufmann R. Quantification of tyrosinase, TRP-1, and Trp-2 transcripts in human melanocytes by reverse tran- scriptase-competitive multiplex PCR–regulation by steroid hormones. J Invest Dermatol. 1998;110:364–7.
- McLeod SD, Ranson M, Mason RS. Effects of estrogens on human melanocytes in vitro. J Steroid Biochem Mol Biol. 1994;49:9–14.
- Jang YH, Lee JY, Kang HY, Lee ES, Kim Oestrogen and progesterone receptor expression in melasma: an immunohistochemical analysis. J Eur Acad Dermatol Venereol. 2010;24:1312–6.
- Luger TA, Schwarz Evidence for an epidermal cytokine network. J Invest Dermatol. 1990;95:S100–4.
- Imokawa G, Miyagishi M, Yada Endothelin-1 as a new melanogen: coor- dinated expression of its gene and the tyrosinase gene in UVB-exposed human epidermis. J Invest Dermatol. 1995;105:32–7.
- Schauer E, Trautinger F, Kock A, Schwarz A, Bhardwaj R, Simon M, et al. Proopiomelanocortin- derived peptides are synthesized and released by human keratinocytes. J Clin Invest. 1994;93:2258–62.
- Smit N, Le Poole I, Van Den Wijngaard R, Tigges A, Westerhof W, Das Expres- sion of different immunological markers by cultured humanmelanocytes. Arch Dermatol Res. 1993;285:356–65.
- Tomita Y, Iwamoto M, Masuda T, Tagami Stimulatory effect of prostaglandin E2 on the configuration of normal human melanocytes in vitro. J Invest Dermatol. 1987;89:299–301.
- Imokawa G, Yada Y, Morisaki N, Kimura M. Biological characterization of human fibroblast- derived mitogenic factors for human melanocytes. Biochem 1998;330(Pt 3):1235–9.
- Grichnik JM, Burch JA, Burchette J, Shea CR. The SCF/KIT pathway plays a crit- ical role in the control of normal human melanocyte homeostasis. J Invest Derma- tol. 1998;111:233–8.
- Kang HY, Suzuki I, Lee DJ, Ha J, Reiniche P, Aubert J, et al. Transcriptional profiling shows altered expression of wnt pathway- and lipid metabolism-related genes as well as melanogenesis- related genes in melasma. J Invest Dermatol. 2011;131:1692–700.
- Takeda K, Yasumoto K, Takada R, Takada S, Watanabe K, Udono T, et al. Induc- tion of melanocyte- specific microphthalmia-associated transcription factor by Wnt-3a. J Biol Chem. 2000;275:14013–6.
- Chien AJ, Conrad WH, Moon 2009. A Wnt survival guide: from flies to hu- man disease. J Invest Dermatol. 2009;129:1614–27.
- Park TJ, Kim M, Kim H, Park SY, Park KC, Ortonne JP, Kang Wnt inhibitory factor (WIF)-1 promotes melanogenesis in normal human melanocytes. Pigment Cell Melanoma Res. 2014;27:72–81.
- Kim NH, Lee CH, Lee H19 RNA downregulation stimulated melanogenesis in melasma. Pigment Cell Melanoma Res. 2010;23:84–92.
- Gabory A, Ripoche MA, Yoshimizu T, Dandolo L. The H19 gene: regulation and function of a non-coding RNA. Cytogenet Genome Res. 2006;113:188–93.
- Reese KJ, Bartolomei MS. Establishment and maintenance of H19 imprint- ing in the germline and preimplantation embryo. Cytogenet Genome Res. 2006;113:153–8.
- Kang WH, Yoon KH, Lee ES, Kim J, Lee KB, Yim H, et al. Melasma: histopatho- logical characteristics in 56 Korean patients. Br J Dermatol. 2002;146:228–37.
- Grimes PE, Yamada N, Bhawan Light microscopic, immunohistochemical, and ultrastructural alterations in patients with melasma. Am J Dermatopathol. 2005;27:96–101.
- Hernandez-Barrera R, Torres-Alvarez B, Castanedo-Cazares JP, Oros-Ovalle C,Moncada B.Solar elastosis and presence of mast cells as key features in the- pathogenesis of melasma. Clin Exp Dermatol. 2008;33:305–8.
- Torres-Alvarez B, Mesa-Garza IG, Castanedo-Cazares JP, Fuentes-Ahumada C, Oros-Ovalle C, Navarrete-Solis J, Moncada B. Histochemical and immunohist chemical study in melasma: evidence of damage in the basal membrane. Am J Der- matopathol.2011;33:291–5.
- Miot LD, Miot HA, Polettini J, Silva MG, Marques ME. Morphologic changes and the expression of alpha-melanocytestimulating hormone and melanocor- tin-1 receptor in melasma lesions: a comparative Am J Dermatopathol. 2010;32:676–82.
- Kwon SH, Park Clues to the pathogenesis of melasma from its histologic findings. Pigmentary Disorders. 2014;1:141.
- Sanchez NP, Pathak MA, Sato S, Fitzpatrick TB, Sanchez JL, Mihm MCJ. Melas- ma: a clinical, light microscopic, ultrastructural, and immunofluorescence J Am Acad Dermatol. 1981;4:698–710.
- Inomata S, Matsunaga Y, Amano S, Takada K, Kobayashi K, Tsunenaga M, et al. Possible involvement of gelatinases in basement membrane damage and wrinkle formation in chronically ultraviolet B-exposed hairless mouse. J Invest 2003;120:128–34.
- Kim EH, Kim YC, Lee ES, Kang The vascular characteristics of melasma. J Dermatol Sci. 2007;46:111–6.
- Kang HY, Bahadoran P, Suzuki I, Zugaj D, Khemis A, Passeron T, et al. In vivo reflectance confocal microscopy detects pigmentary changes in melasma at a cel- lular level resolution. Exp Dermatol. 2010;19:e228–33.
- Passeron Long-lasting effect of vascular targeted therapy of melasma. J Am Acad Dermatol. 2013;69:e141–2.
- Kim EJ, Park HY, Yaar M, Gilchrest BA. Modulation of vascular endothelial growth factor receptors in melanocytes. Exp Dermatol. 2005;14:625–33.
- Jo HY, Kim CK, Suh IB, Ryu SW, Ha KS, Kwon YG, Kim YM. Co-localization of inducible nitric oxide synthase and phosphorylated Akt in the lesional skins of patients with melasma. J Dermatol. 2009;36:10–6.
- Navid F, Kolbe L, Stab F, Korff T, Neufang G. UV radiation induces the release of angiopoietin- 2 from dermal microvascular endothelial cells. Exp Dermatol. 2012;21:147–53.
- Ferrara Binding to the extracellular matrix and proteolytic processing: two key mechanisms regulating vascular endothelial growth factor action. Mol Biol Cell. 2010;21:687–90.
- Bastaki M, Nelli EE, Dell’era P, Rusnati M, Molinari-Tosatti MP, Parolini S, et al. Basic fibroblast growth factor-induced angiogenic phenotype in mouse endotheli- um. A study of aortic and microvascular endothelial cell lines. Arterioscler Thromb Vasc Biol. 1997;17:454–64.
- Na JI, Choi SY, Yang SH, Choi HR, Kang HY, Park Effect of tranexamic acid on melasma: a clinical trial with histological evaluation. J Eur Acad Dermatol Venere- ol. 2013;27:1035–9.
- Iddamalgoda A, Le QT, Ito K, Tanaka K, Kojima H, Kido H. Mast cell tryptase and photoaging: possible involvement in the degradation of extra cellular matrix and basement membrane proteins. Arch Dermatol Res. 2008;300(S1):S69–76.
- Lavker RM, Kligman AM. Chronic heliodermatitis: a morphologic evaluation of chronic actinic dermal damage with emphasis on the role of mast cells. J Invest Dermatol. 1988;90:325–30.
- Grimbaldeston MA, Simpson A, Finlay-Jones JJ, Hart The effect of ultravio- let radiation exposure on the prevalence of mast cells in human skin. Br J Derma- tol. 2003;148:300–6.
- Gonzalez S, Moran M, Kochevar Chronic photodamage in skin of mast cell-deficient mice. Photochem Photobiol. 1999;70:248–53.
- Crivellato E, Nico B, Ribatti Mast cells and tumour angiogenesis:
Tham khảo thêm một số bài viết cùng chủ đề: