Bài viết Tìm hiểu về liệu pháp phẫu thuật và xạ trị cho sẹo lồi và sẹo phì đại-Tải file pdf tại đây
Tác giả: Rei Ogawa
Dịch: Bs. Trương Tấn Minh Vũ
11.1 Giới thiệu
Trong 10 năm qua, hiểu biết của chúng ta về cơ chế sinh bệnh của sẹo bệnh lý, bao gồm sẹo lồi và sẹo phì đại, đã tăng lên đáng kể. Do đó, sẹo lồi và sẹo phì đại hiện tại được coi là bệnh có thể điều trị được. Tuy nhiên, các phương pháp điều trị hiện có vẫn cần được cải thiện. Phẫu thuật và xạ trị nên đóng vai trò nổi bật hơn trong các chiến lược điều trị sẹo bệnh lý hiện tại. Chương này thảo luận về lý do cho điều này. Các phác đồ điều trị phẫu thuật và xạ trị tối ưu và các tác dụng phụ có thể xảy ra của xạ trị cũng được thảo luận.
11.2 Phẫu thuật cắt bỏ sẹo lồi và sẹo phì đại
Quan điểm chính trong điều trị sẹo lồi và sẹo phì đại là các tổn thương này do tình trạng viêm ở lớp bì lưới thúc đẩy. Hơn nữa, ở mỗi cá nhân, mức độ viêm được phát triển bởi sự tương tác giữa các yếu tố gây bệnh bên ngoài và bên trong. Các yếu tố này bao gồm các yếu tố của da tại chỗ, đặc biệt là sức căng cơ học trên vết thương/sẹo. Sức căng này đặc biệt mạnh ở một số vùng nhất định của cơ thể như ngực trước, nơi có xu hướng phát triển sẹo bệnh lý. Các yếu tố khác bao gồm các yếu tố toàn thân (như tăng huyết áp, hormone sinh dục và tình trạng viêm toàn thân) và/hoặc các yếu tố di truyền. Mức độ viêm và các yếu tố gây bệnh đều phải được xem xét trước khi quyết định cách điều trị sẹo bệnh lý.
Phẫu thuật cắt bỏ về cơ bản sẽ loại bỏ toàn bộ hoặc hầu hết khối lượng bị viêm, để đưa tình trạng viêm của vết thương trở lại mức dễ kiểm soát hơn (“khái niệm tái thiết lập”). Những khối lượng viêm nhỏ này có thể được loại bỏ bằng xạ trị sau phẫu thuật. Theo sau là các biện pháp phòng ngừa chống lại các kích thích gây bệnh (ví dụ: sức căng trên vết thương/sẹo) có thể làm bùng phát tình trạng viêm mất kiểm soát và dẫn đến tái phát.
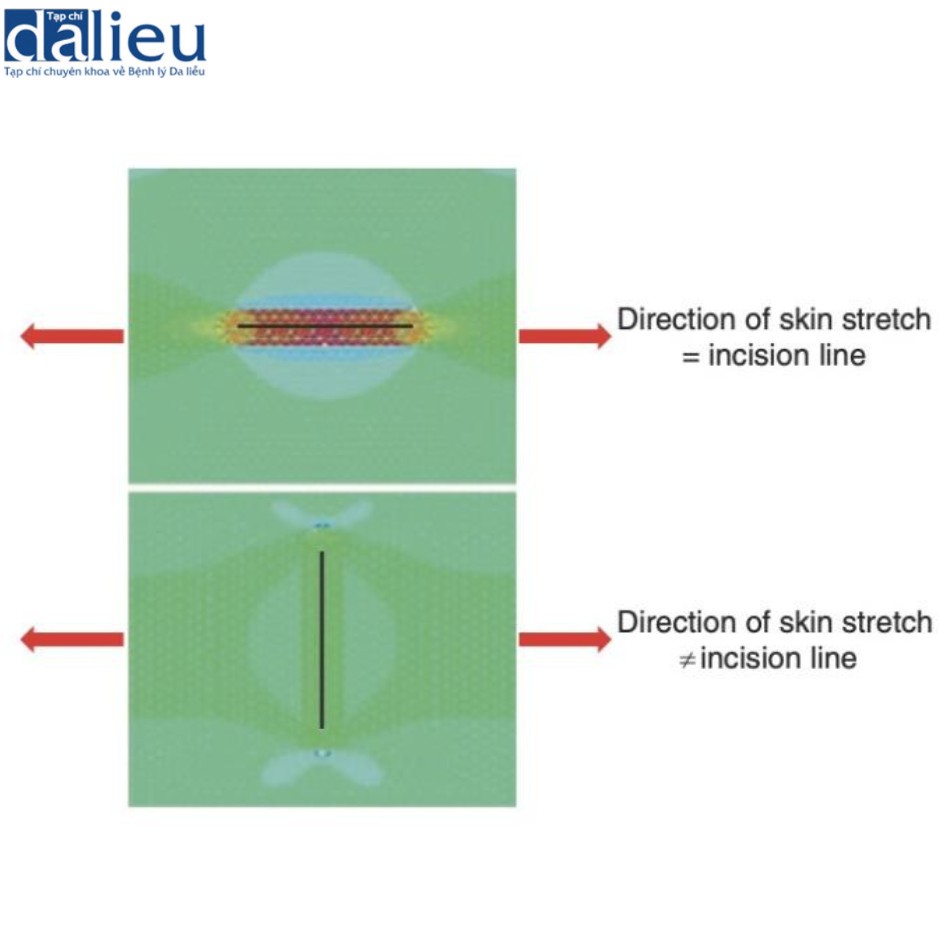
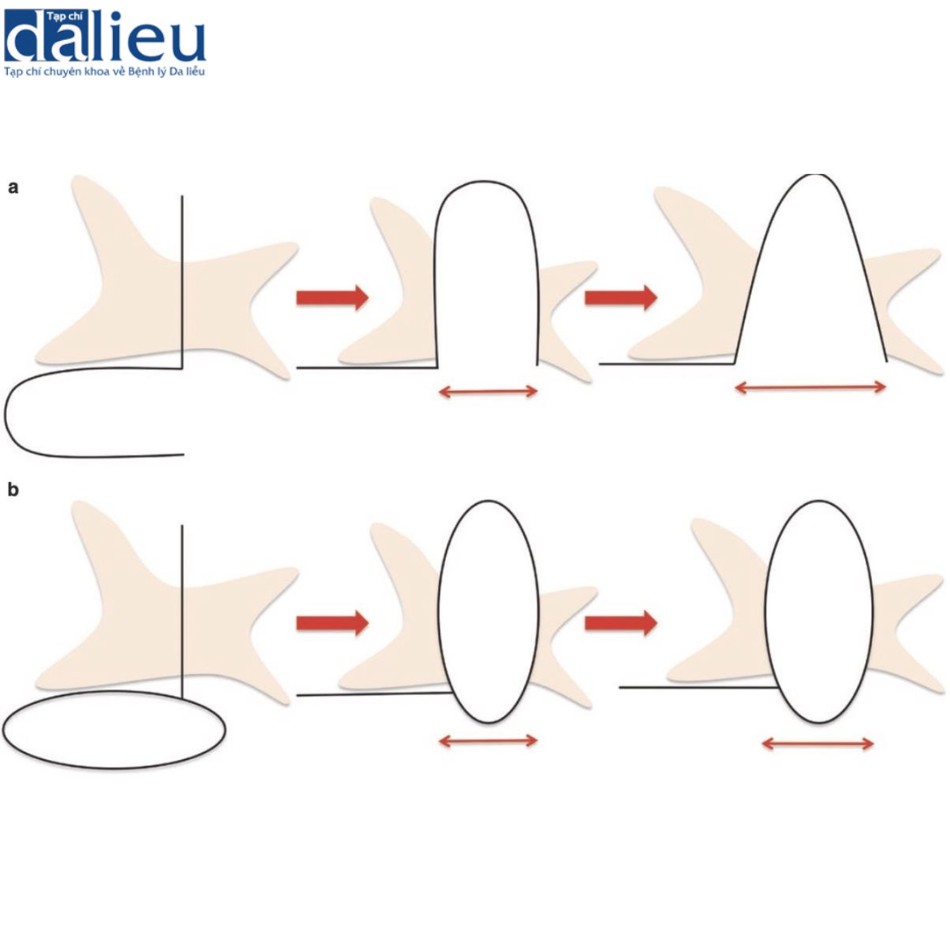
Nếu sẹo lồi và sẹo phì đại không được cắt bỏ cẩn thận, nguy cơ tái phát sẽ rất cao. Tệ hơn nữa, các tổn thương tái phát thường lớn hơn nhiều so với các tổn thương ban đầu. Trong khi xạ trị sau phẫu thuật làm giảm đáng kể nguy cơ tái phát, một số kỹ thuật phẫu thuật nhất định cũng có thể hạn chế mạnh mẽ nguy cơ này. Có hai nguyên tắc phẫu thuật cơ bản cần được cân nhắc cẩn thận khi thực hiện bất kỳ ca phẫu thuật nào (đặc biệt là ở những vùng cơ thể có độ căng da cao) nhưng đặc biệt là khi cắt bỏ sẹo bệnh lý: thứ nhất, hướng cắt và thứ hai, độ sâu của vết cắt. Liên quan đến nguyên tắc thứ nhất, nếu hướng cắt trùng với hướng căng da ưu thế, nguy cơ hình thành sẹo bệnh lý sẽ tăng lên. Nguyên nhân là do sẹo trở nên cứng và kém đàn hồi hơn nhiều so với vùng da xung quanh sau phẫu thuật. Do đó, khi sẹo nằm theo hướng căng da, việc kéo căng da (ví dụ như do chuyển động của cơ thể) sẽ kéo theo toàn bộ chiều dài của sẹo (Hình 11.1). Điều này sẽ cản trở quá trình lành thương bình thường từ giai đoạn viêm sang giai đoạn tái cấu trúc da, do đó làm tăng tình trạng viêm và tích tụ collagen, dẫn đến sẹo phát triển. Tuy nhiên, nếu hướng rạch không trùng với hướng căng da, thì sức căng do chuyển động của da gây ra sẽ bị phân tán và không xuất hiện vùng căng da cao (Hình 11.1).
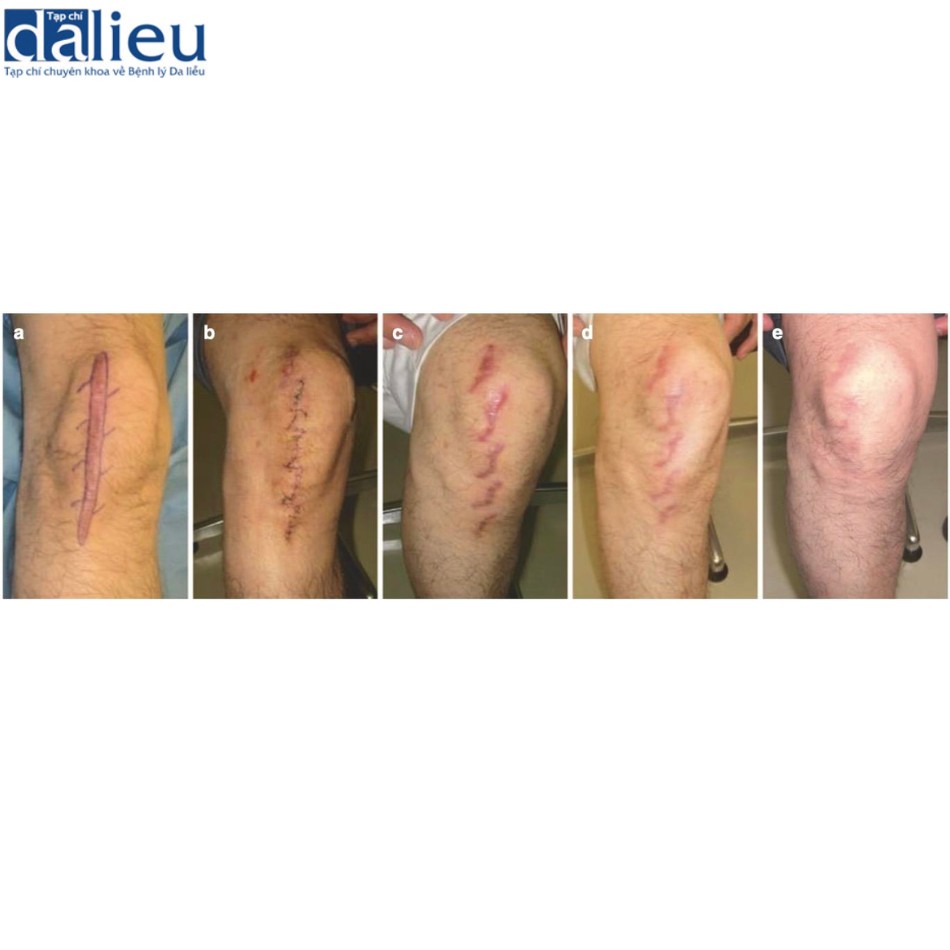
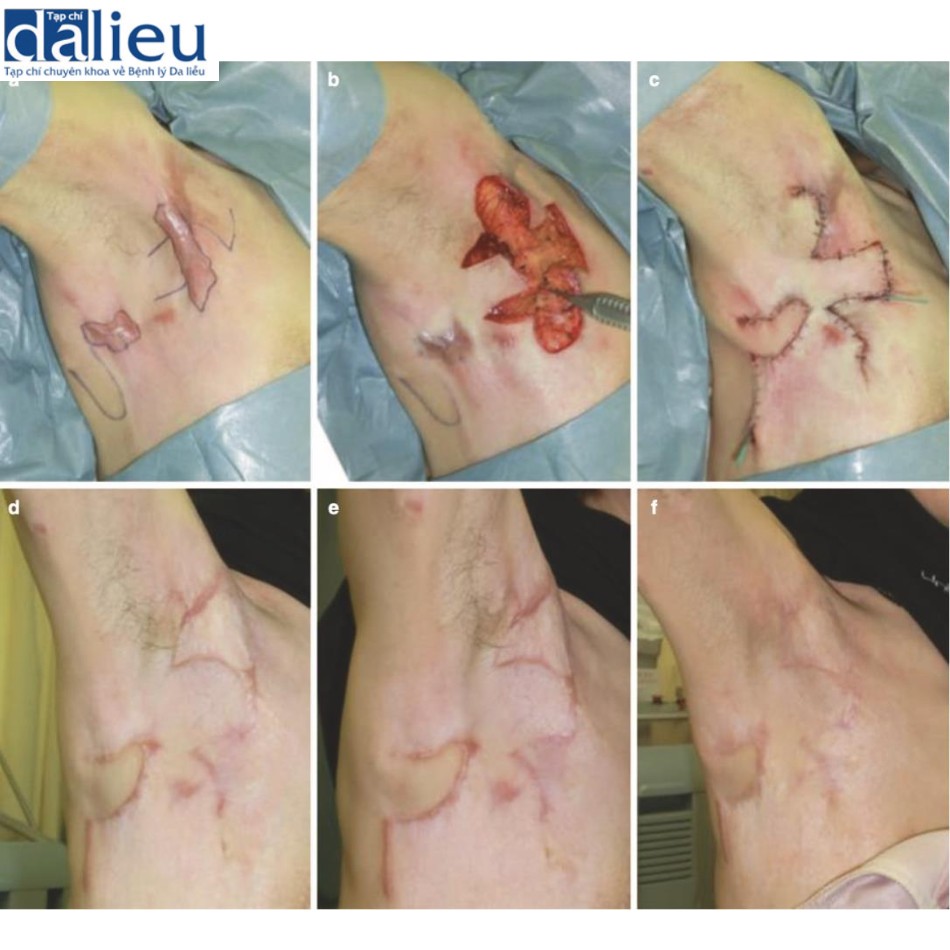
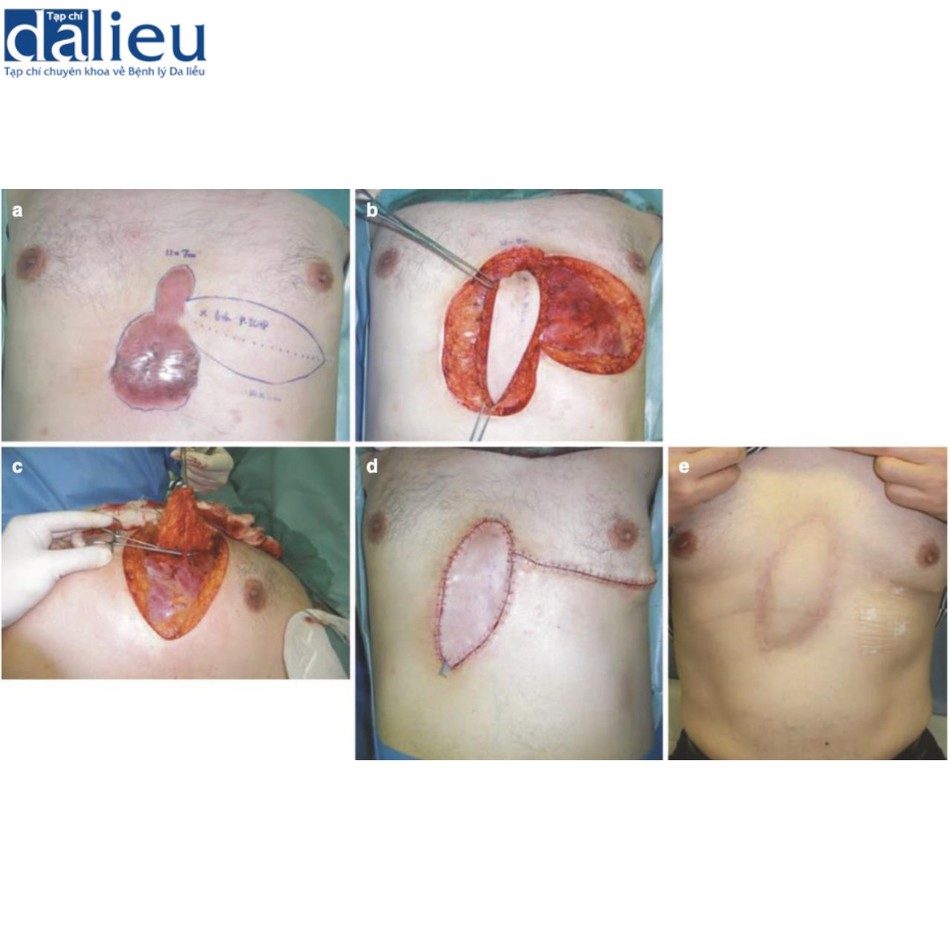
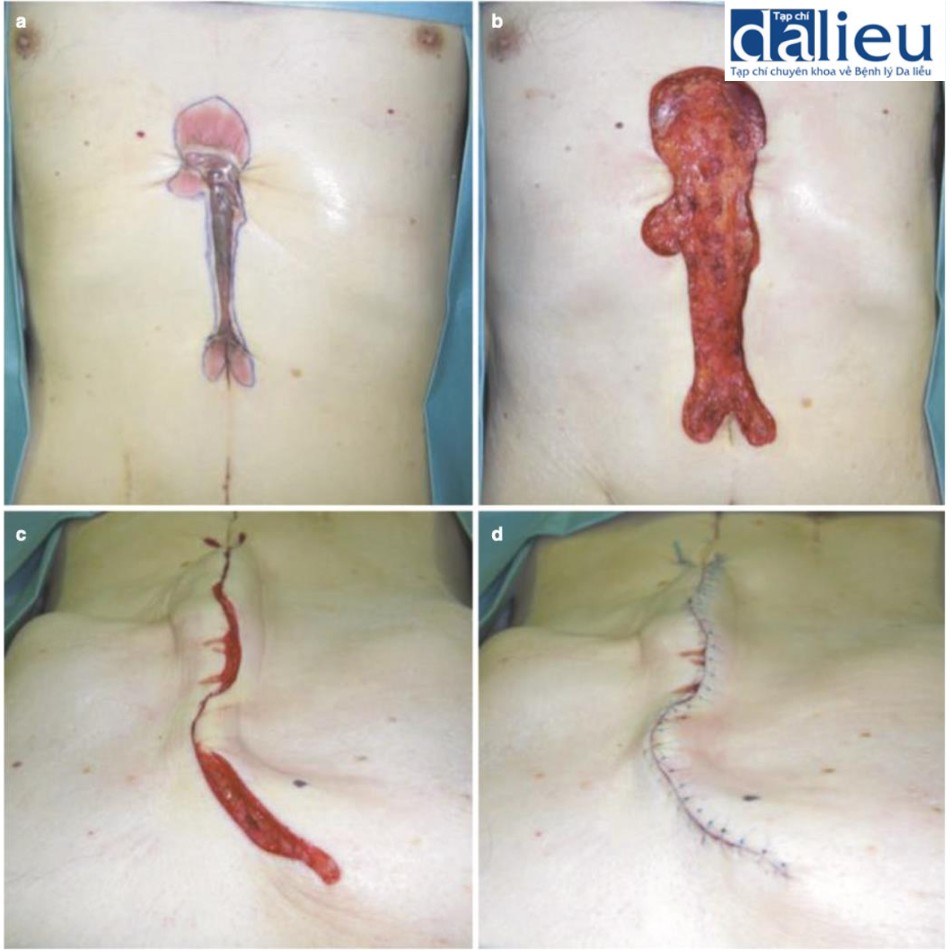
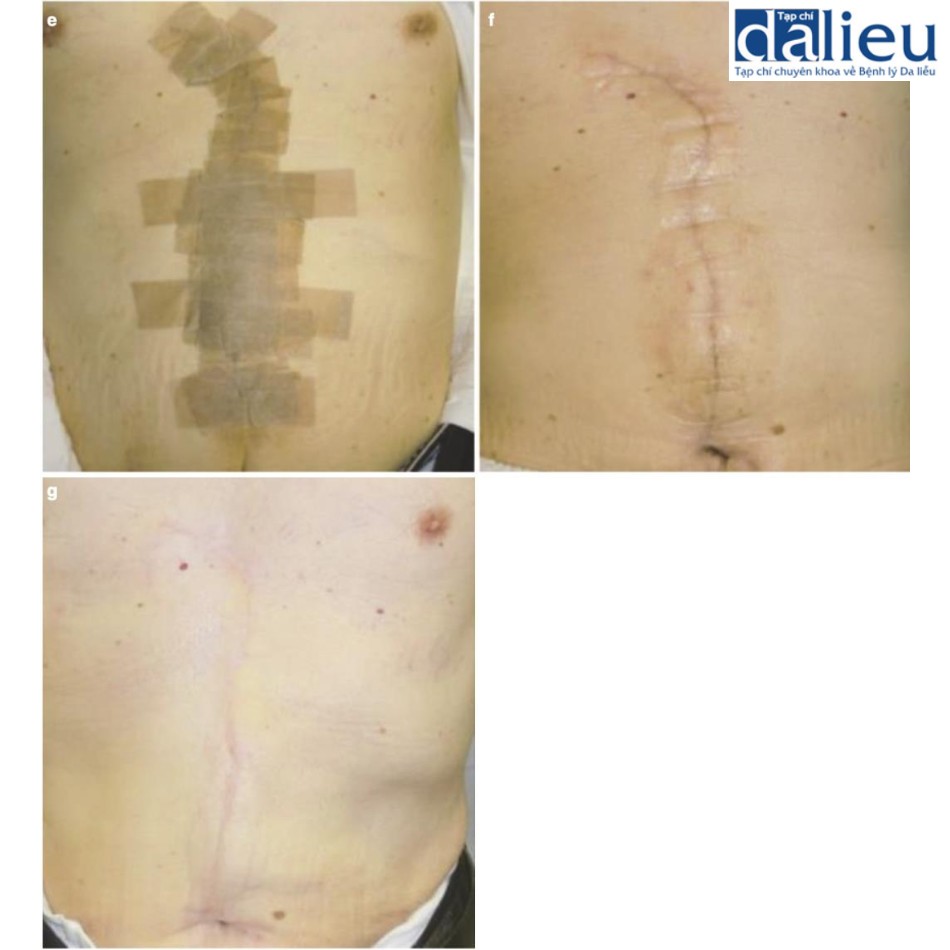
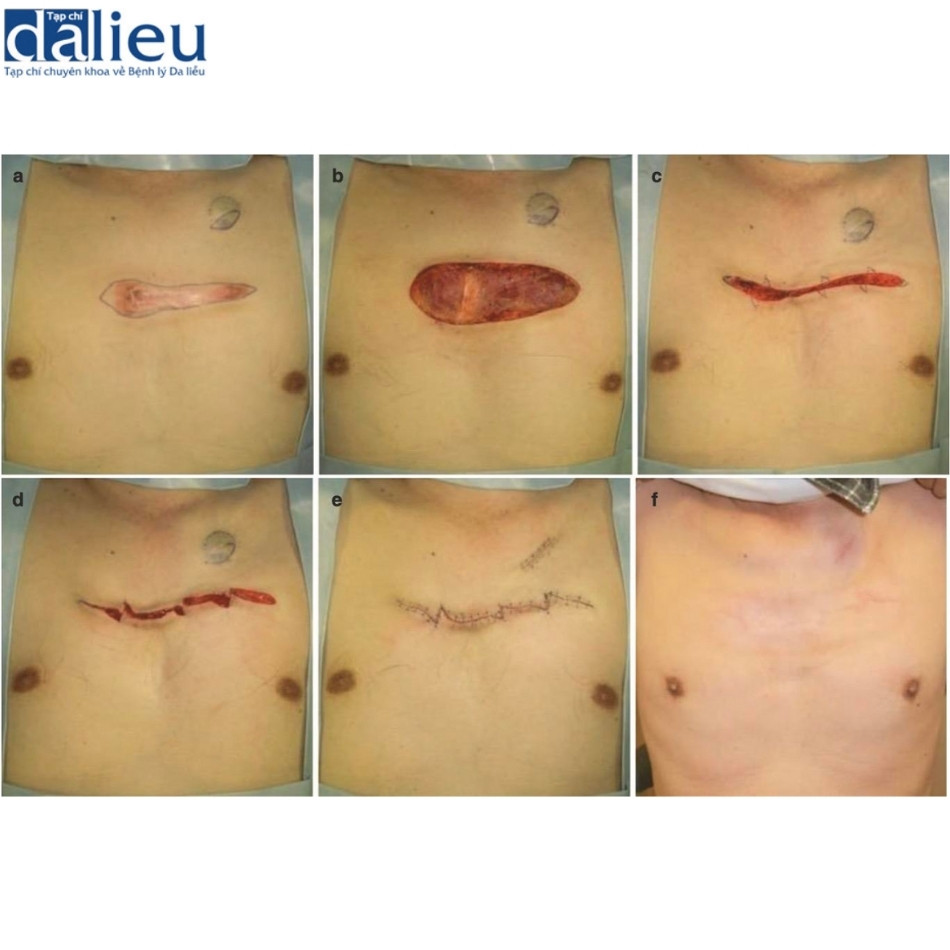
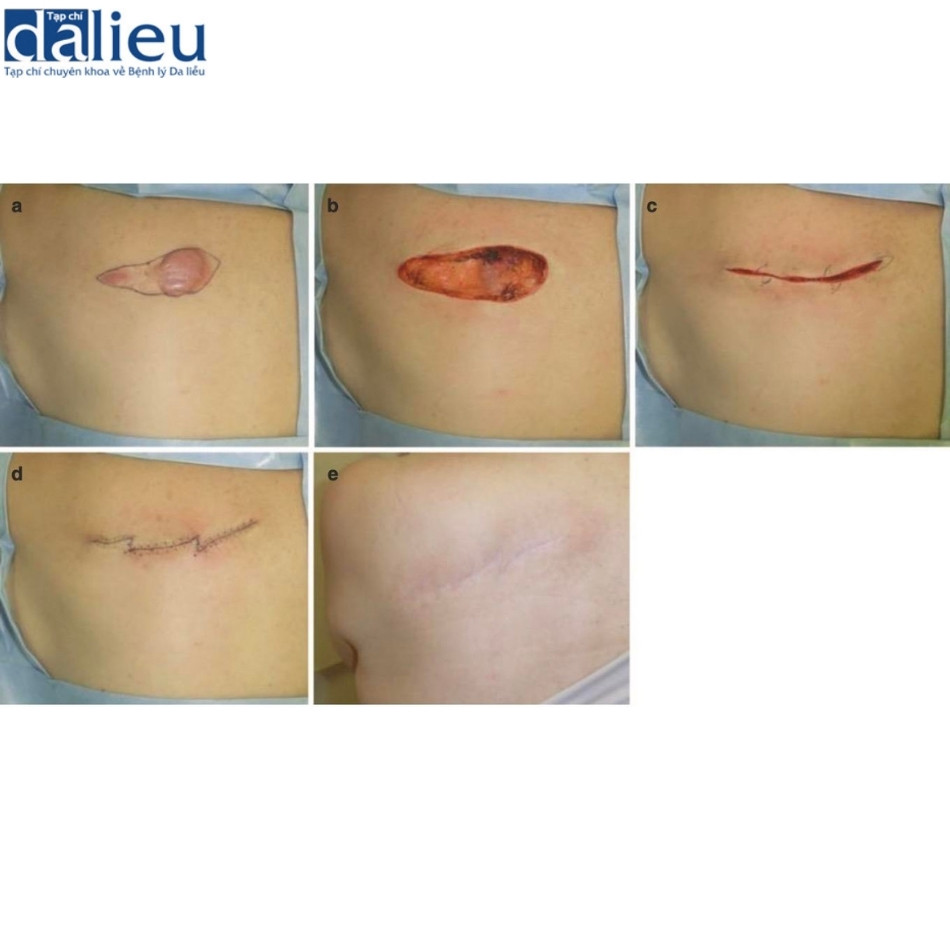
Xét về phương pháp phẫu thuật loại bỏ sẹo bệnh lý, sẹo thường kéo dài song song với hướng căng trong nhiều trường hợp. Trong những trường hợp như vậy, bác sĩ phẫu thuật nên cân nhắc chia sức căng bằng mũi khâu zíc zắc, bao gồm cả phẫu thuật z-plasty: các phương thức phẫu thuật này tốt trong giảm bớt sự co cứng và sức căng của sẹo thẳng . Một lợi ích lớn khác là sẹo phân đoạn sẽ trưởng thành nhanh hơn sẹo thẳng dài. Phẫu thuật tạo hình chữ Z đặc biệt phù hợp với các vết sẹo đi qua khớp: khớp là vùng đặc biệt di động của cơ thể và các vết sẹo đi qua khớp dễ bị phì đại do tình trạng kéo căng liên tục. Cắt và khâu zíc zắc sẽ giúp giảm nguy cơ tái phát sẹo bệnh lý (Hình 11.2). Nhiều vạt da tại chỗ khác nhau cũng hữu ích để chia sức căng của sẹo. Chúng cũng ngăn ngừa tình trạng co cứng vì chúng giãn ra tự nhiên sau phẫu thuật (Hình 11.3). Ghép da ít phù hợp hơn để chia sức căng của sẹo vì chúng không giãn ra. Trên thực tế, chúng có xu hướng tạo ra sự co rút thứ phát dẫn đến sẹo bệnh lý hình tròn xung quanh da được ghép. Về phẫu thuật tạo vạt, vạt có cuống da tốt hơn vạt đảo, bao gồm vạt tự do, vì da khỏe mạnh của cuống da có thể giãn ra từng chút sau phẫu thuật; điều này làm giảm hiệu quả sức căng trên vạt (Hình 11.4) [9]. Vạt tự do không có đặc điểm này (Hình 11.4). Tuy nhiên, nếu sẹo lớn, có thể chọn vạt đảo có cuống xuyên (vạt cánh quạt) hoặc vạt tự do (Hình 11.5).
Liên quan đến nguyên tắc phẫu thuật thứ hai, cụ thể là độ sâu của vết cắt, sẹo lồi và sẹo phì đại phát sinh từ lớp bì lưới. Do đó, sau bất kỳ vết cắt phẫu thuật nào, bao gồm cả việc cắt bỏ sẹo bệnh lý, điều quan trọng là phải hạn chế sức căng trên lớp bì lưới. Một cách để đảm bảo điều này là chỉ sử dụng chỉ khâu da sau khi các cấu trúc sâu hơn (cụ thể là cân nông và cân sâu) đã được tiếp cận và khâu lại (Hình 11.6). Kiểu khâu này sẽ nâng các mép vết thương lên một cách liền lạc, do đó cho phép chúng dính vào nhau tự nhiên (Hình 11.7). Chỉ khi đó mới nên khâu da và khâu nông. Do đó, khâu da không nên được sử dụng như là “khâu giảm sức căng “. Đây là một khái niệm quan trọng để ngăn ngừa sự hình thành (và tái phát) của sẹo bệnh lý sau phẫu thuật.
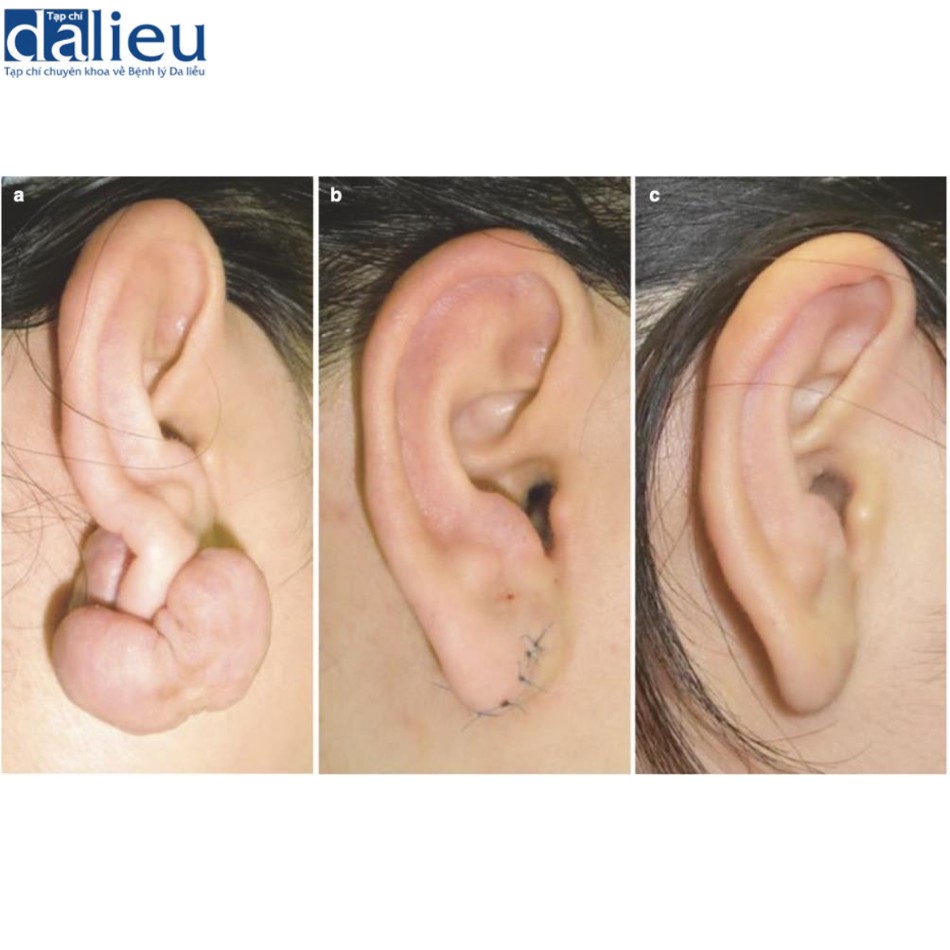
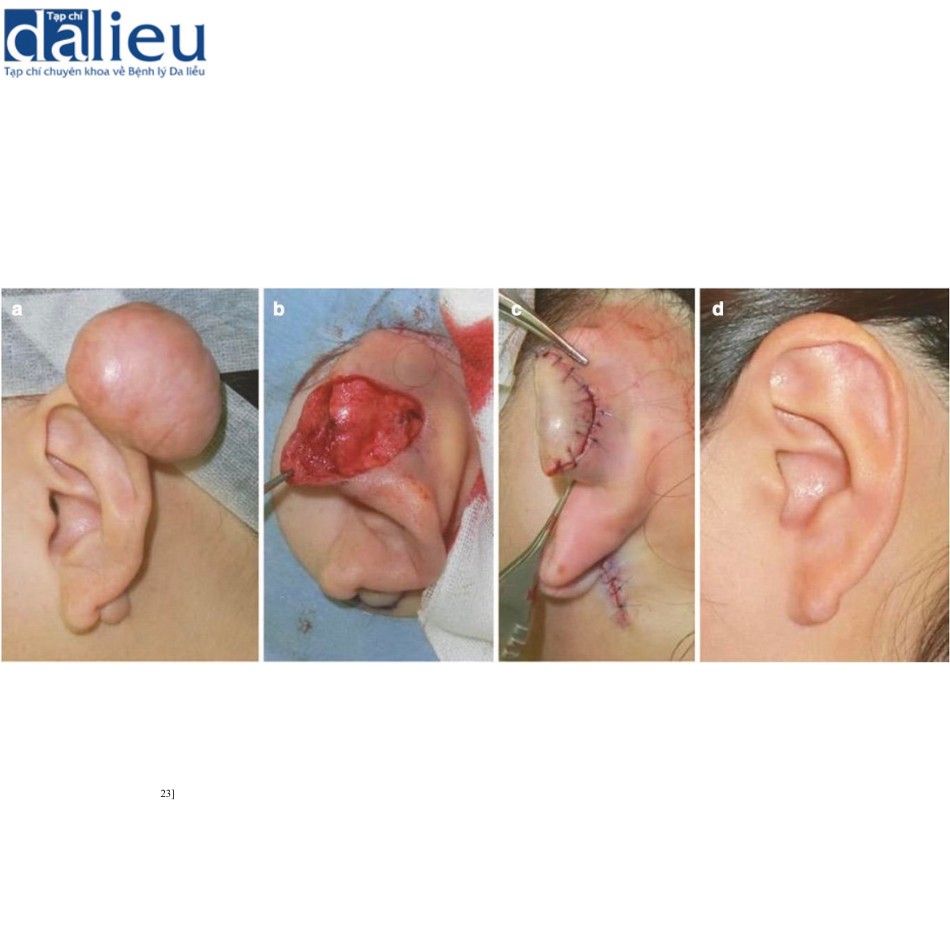
Các kỹ thuật phẫu thuật đặc biệt như cắt bỏ hình nêm (Hình 11.8) và cắt bỏ lõi (Hình 11.9) có thể được sử dụng cho các vết sẹo bệnh lý ở các vùng cụ thể như tai.

11.3 Xạ trị
Sẹo lồi đã được điều trị bằng xạ trị trong một thế kỷ. Freund báo cáo vào năm 1898, 3 năm sau khi tia X lần đầu tiên được Wilhelm Conrad Röntgen phát hiện, rằng các sẹo phì đại có thể được phục hồi thành da bình thường bằng phương pháp điều trị Roentgen. Sau đó, vào năm 1901, Harris báo cáo rằng việc phơi nhiễm với tia X cũng có thể giải quyết sẹo lồi. Năm 1909, Freund mô tả phác đồ điều trị kết hợp đầu tiên bao gồm phẫu thuật và điều trị Roentgen sau phẫu thuật. Sau đó, các phác đồ xạ trị khác nhau được phát triển để điều trị sẹo lồi. Một số phác đồ bao gồm chiếu xạ bên ngoài bằng cách sử dụng tia X bề mặt và tia X trực giao (photon) và tia β (chùm tia electron). Những phương pháp khác là liệu pháp xạ trị áp sát sử dụng tia β (32P hoặc 90Sr/90Y) và tia γ (60Co hoặc 192Ir). Các phác đồ xạ trị này được sử dụng như một liệu pháp đơn trị mà không cần phẫu thuật, kết hợp với liệu pháp bổ trợ không phẫu thuật và sau phẫu thuật. Tuy nhiên, người ta thường tin rằng sẹo lồi được điều trị tốt nhất bằng cách kết hợp phẫu thuật và xạ trị sau phẫu thuật vì cần xạ trị tương đối ít để loại bỏ tình trạng viêm còn lại sau phẫu thuật, do đó ngăn ngừa tái phát. Ngược lại, có vẻ như cần xạ trị liều cao hơn khi được sử dụng đơn trị.
Nhiều nghiên cứu đánh giá tác động của xạ trị sau phẫu thuật đối với tình trạng tái phát sẹo lồi. Mặc dù khó có thể so sánh các nghiên cứu này vì sự khác biệt về chủng tộc, độ tuổi và giới tính của bệnh nhân, diện tích và kích thước sẹo lồi, nguồn và liều bức xạ, chiến lược đánh giá kết quả và thời gian theo dõi, tỷ lệ đáp ứng xạ trị sau phẫu thuật được báo cáo (tỷ lệ tái phát bất kể mức độ hài lòng của bệnh nhân) thường nằm trong khoảng từ 67% đến 98%.
Tính an toàn và hiệu quả của xạ trị đã được cải thiện hơn nữa trong những năm gần đây. Do đó, xạ trị dưới dạng xạ trị áp sát liều cao (HDR-SB) hoặc xạ trị chùm tia electron hiện được sử dụng thường quy như một liệu pháp hỗ trợ sau phẫu thuật có hiệu quả cao (Hình 11.10). Tùy thuộc vào hình dạng của sẹo phẫu thuật, đầu chiếu HDR-SB có thể được sử dụng để đảm bảo chiếu xạ đều và phù hợp vào bề mặt vết thương. Điều này làm cho phương pháp điều trị còn hiệu quả hơn. Các tài liệu về việc sử dụng xạ trị áp sát hiệu quả đối với sẹo lồi ngày càng được báo cáo nhiều hơn.
![Hình 11.10 Chùm tia electron (a) xạ trị áp sát (b). Tính an toàn và hiệu quả của xạ trị đã được cải thiện trong những năm gần đây và xạ trị bằng xạ trị áp sát liều cao (HDR-SB) hoặc xạ trị bằng chùm tia electron hiện được sử dụng thường quy như một liệu pháp hỗ trợ sau phẫu thuật có hiệu quả cao sau khi cắt bỏ sẹo lồi Sử dụng khái niệm tuyến tính-bậc hai để tính toán liều hiệu quả sinh học (biologically effective dose, BED) cho nhiều phác đồ xạ trị khác nhau để điều trị sẹo lồi cho thấy khi BED vượt quá 30 Gy, tỷ lệ tái phát thấp hơn 10% . BED được tính là BED = tổng liều xạ trị x [1 + liều xạ trị một lần/(α/β)]. Giá trị α/β của sẹo lồi được coi là 10 vì chúng là vùng viêm. Tuy nhiên, cần có thêm các nghiên cứu xác định giá trị này chính xác hơn](https://tapchidalieu.com/wp-content/uploads/2024/12/hinh-11-lieu-phap-phau-thuat-va-xa-tri-cho-seo-loi-va-seo-phi-dai.jpg)
Vì nguy cơ gây ung thư thứ phát giảm khi BED được đặt dưới 30 Gy, chúng tôi đề xuất rằng liều xạ trị sau phẫu thuật tối đa cho sẹo lồi là BED 30 Gy. Có thể đạt được BED 30 Gy theo một số cách: liều một phần duy nhất 13 Gy, hai phần 8 Gy, ba phần 6 Gy hoặc bốn phần 5 Gy.
Về phác đồ xạ trị sau phẫu thuật, chúng tôi sử dụng phác đồ thống nhất 15 Gy trước năm 2002. Trong phác đồ này, tất cả các sẹo lồi, bất kể chúng nằm ở đâu, đều được điều trị với 15 Gy được cung cấp trong ba ngày liên tiếp với liều hàng ngày là 5 Gy. Chúng tôi thấy rằng phác đồ này liên quan đến tỷ lệ tái phát khoảng 30%. Sau đó, chúng tôi phát triển một phác đồ với liều tùy chỉnh trong đó các vị trí khác nhau trên cơ thể được điều trị bằng các lượng bức xạ khác nhau. Do đó, các vùng có nguy cơ cao, gồm thành ngực trước và vùng bả vai và bụng dưới, được điều trị với 20 Gy được cung cấp trong bốn ngày liên tiếp với liều hàng ngày là 5 Gy. Ngược lại, dái tai, là vùng có nguy cơ thấp, được điều trị với 10 Gy được cung cấp trong hai ngày liên tiếp với liều hàng ngày là 5 Gy. Các vùng khác được điều trị theo phác đồ ban đầu (tức là 15 Gy được cung cấp trong 3 ngày với liều hàng ngày là 5 Gy). Sự thay đổi trong phác đồ này làm giảm tỷ lệ tái phát tổng thể xuống còn 12,3% [29] .
Sau đó, chúng tôi sửa đổi thêm phác đồ này và hiện đang thử nghiệm tác động của nó đối với sự tái phát. Phác đồ này như sau: các vùng có nguy cơ cao nhận 18 Gy/3 phần/3 ngày, các vùng có nguy cơ trung bình nhận 15 Gy/2 phần/2 ngày và các vùng có nguy cơ thấp nhận 8 Gy/1 phần/1 ngày. Cho đến nay, chúng tôi quan sát thấy kết quả tốt (Hình 11.11 và 11.12).
Về mặt tác dụng phụ của xạ trị, trong 10.000 người từ 18 đến 64 tuổi, 670 người (6,7%) phát triển ung thư da nếu chịu chiếu xạ toàn thân 1 Gy. Nhìn chung, ung thư da giết chết 1 trong 500 bệnh nhân. Do đó, tỷ lệ tử vong liên quan đến 1 Gy chiếu xạ toàn thân sẽ là 6,7% × 1/500 = 0,0134%, tức là 1 trong 7500 người. Nếu những tổng này được áp dụng cho xạ trị sẹo lồi dái tai, trong đó 0,05% da toàn thân được chiếu xạ 10 Gy, thì tỷ lệ ung thư liên quan đến phương pháp điều trị này sẽ là 6,7% × 10 Gy × 0,05%/100 = 0,0335%, tức là 1 trong 3000 bệnh nhân sẹo lồi. Tỷ lệ tử vong do ung thư thứ phát khi điều trị sẹo lồi dái tai là 0,0335/500 = 0,000067%, tức là 1 trên 1.500.000 người. Chúng tôi tin rằng có thể bỏ qua tỷ lệ này trên lâm sàng nếu bệnh nhân đồng ý sau khi được thông báo về lợi ích và tác dụng phụ của loại điều trị này.
Tuy nhiên, cần nhớ rằng tuyến giáp và tuyến vú rất nhạy cảm với bức xạ và nằm gần da. Do đó, cần phải nỗ lực bảo vệ những vùng này khỏi bức xạ. Hơn nữa, trẻ sơ sinh và trẻ em dưới 20 tuổi không nên được xạ trị vì các tế bào của chúng vẫn đang tăng sinh mạnh mẽ và do đó chúng cũng rất nhạy cảm với bức xạ.
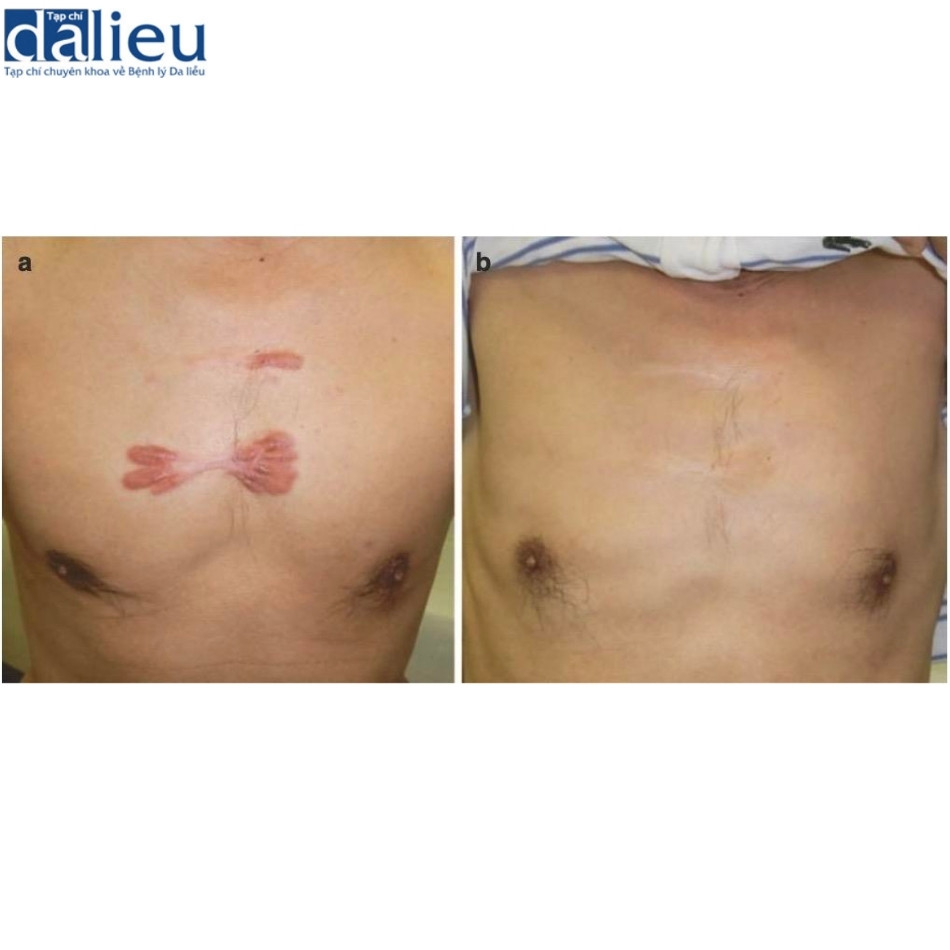
Chúng tôi cũng sử dụng liệu pháp xạ trị sơ cấp (liệu pháp xạ trị đơn lẻ) để điều trị cho những bệnh nhân lớn tuổi hoặc những bệnh nhân sẹo lồi nặng mà phẫu thuật rất khó thực hiện. Trong những trường hợp này, tổng liều bức xạ phải cao hơn liều dùng cho liệu pháp xạ trị sau phẫu thuật vì sẹo lồi dày. Do đó, để ngăn ngừa ung thư thứ phát do xạ trị, cần phải sử dụng bức xạ một cách cẩn thận. Điều quan trọng nữa là phải có được sự đồng thuận. Tuy nhiên, lợi ích của xạ trị sơ cấp là rất lớn: các triệu chứng chủ quan như đau và ngứa giảm ngay lập tức, màu sắc và độ dày của sẹo dần trở lại bình thường sau một năm (Hình 11.13).
11.4 Theo dõi dài hạn và giáo dục
Điều quan trọng là những bệnh nhân bị sẹo lồi và sẹo phì đại được điều trị tuần tự phải được theo dõi trong thời gian dài và được giáo dục đầy đủ về cách quản lý sẹo. Điều này là do nếu bệnh nhân có xu hướng phát triển sẹo bệnh lý, họ có thể dễ bị sẹo tái phát hoặc dễ hình thành sẹo mới khi có kích thích nhỏ. Nếu những bệnh nhân như vậy được giáo dục về cách tự quản lý (bao gồm cả việc sử dụng băng/miếng dán steroid trong giai đoạn đầu phát triển sẹo), thì sẹo của họ có xu hướng cải thiện khá nhanh.
11.5 Kết luận
Do sợ tái phát sau khi cắt bỏ sẹo lồi (thường dẫn đến sẹo thậm chí còn tệ hơn), các bác sĩ phẫu thuật thẩm mỹ và bác sĩ da liễu lo ngại về việc điều trị sẹo lồi tích cực. Tuy nhiên, hiện nay có bằng chứng đáng kể cho thấy phẫu thuật và theo sau là xạ trị có thể điều trị thành công sẹo lồi và sẹo phì đại với mức độ tái phát thấp. Việc phát triển một phác đồ chuẩn quốc tế để điều trị sẹo bệnh lý dựa trên bằng chứng này là cần thiết.
Tài liệu tham khảo
1. Huang C, Murphy GF, Akaishi S, Ogawa R. Keloids and hypertro- phic scars: update and future directions. Plast Reconstr Surg Glob Open. 2013;1(4):e25.
2. Ogawa R. Keloid and hypertrophic scars are the result of chronic inflammation in the reticular dermis. Int J Mol Sci. 2017;18(3):E606.
3. Ogawa R, Akaishi S, Kuribayashi S, Miyashita T. Keloids and hypertrophic scars can now be cured completely: recent progress in our understanding of the pathogenesis of keloids and hypertrophic scars and the most promising current therapeutic strategy. J Nippon Med Sch. 2016;83(2):46–53.
4. Ogawa R. The most current algorithms for the treatment and prevention of hypertrophic scars and keloids. Plast Reconstr Surg. 2010;125(2):557–68.
5. Ogawa R, Akaishi S. Endothelial dysfunction may play a key role in keloid and hypertrophic scar pathogenesis—keloids and hypertrophic scars may be vascular disorders. Med Hypotheses. 2016;96:51–60.
6. Ogawa R. Mechanobiology of scarring. Wound Repair Regen. 2011;19(Suppl 1):s2–9.
7. Mandy SH. The practical use of Z-plasty. J Dermatol Surg. 1975;1(4):57–60.
8. Ogawa R, Akaishi S, Huang C, Dohi T, Aoki M, Omori Y, Koike S, Kobe K, Akimoto M, Hyakusoku H. Clinical applications of basic research that shows reducing skin tension could prevent and treat abnormal scarring: the importance of fascial/subcutaneous tensile reduction sutures and flap surgery for keloid and hypertrophic scar reconstruction. J Nihon Med Sch. 2011;78(2):68–76. ab
9. Yoshino Y, Kubomura K, Ueda H, Tsuge T, Ogawa R. Extension of flaps associated with burn scar reconstruction: a key difference between island and skin-pedicled flaps. Burns. 2018;44:683–91.
10. Jacobsson F. The treatment of keloids at Radiumhemmet, 1921– 1941. Acta Radiol. 1948;29(3):251–67.
11. Levy DS, Salter MM, Roth RE. Postoperative irradiation in the pre- vention of keloids. AJR Am J Roentgenol. 1976;127(3):509–10.
12. Enhamre A, Hammar H. Keloids with excision and postoperative X-ray irradiation. Dermatologica. 1983;167(2):90–3.
13. Borok TL, Bray M, Sinclair I, Plafker J, LaBirth L, Rollins C. Role of ionizing irradiation for 393 keloids. Int J Radiat Oncol Biol Phys. 1988;15(4):865–70.
14. Kovalic JJ, Perez CA. Radiation therapy following keloidectomy: a 20-year experience. Int J Radiat Oncol Biol Phys. 1989;17(1):77–80.
15. Doornbos JF, Stoffel TJ, Hass AC, Hussey DH, Vigliotti AP, Wen BC, Zahra MK, Sundeen V. The role of kilovoltage irradiation in the treatment of keloids. Int J Radiat Oncol Biol Phys. 1990;18(4):833–9.
16. Chaudhry MR, Akhtar S, Duvalsaint F, Garner L, Lucente FE. Ear lobe keloids, surgical excision followed by radiation therapy: a 10-year experience. Ear Nose Throat J. 1994;73(10):779–81.
17. Norris JE. Superficial X-ray therapy in keloid management: a ret- rospective study of 24 cases and literature review. Plast Reconstr Surg. 1995;95(6):1051–5.
18. Sclafani AP, Gordon L, Chadha M, Romo T 3rd. Prevention of earlobe keloid recurrence with postoperative corticosteroid injec- tions versus radiation therapy: a randomized, prospective study and review of the literature. Dermatol Surg. 1996;22(6):569–74.
19. Ragoowansi R, Cornes PG, Glees JP, Powell BW, Moss AL. Ear- lobe keloids: treatment by a protocol of surgical excision and immediate postoperative adjuvant radiotherapy. Br J Plast Surg. 2001;54(6):504–8.
20. Malaker K, Vijayraghavan K, Hodson I, Al Yafi T. Retrospective analysis of treatment of unresectable keloids with primary radiation over 25 years. Clin Oncol (R Coll Radiol). 2004;16(4):290–8.
21. Klumpar DI, Murray JC, Anscher M. Keloids treated with excision followed by radiation therapy. J Am Acad Dermatol. 1994;31(2 Pt 1):225–31.
22. Caccialanza M, Piccinno R, Schiera A. Postoperative radio- therapy of keloids: a twentyyear experience. Eur J Dermatol. 2002;12(1):58– 62.
23. Speranza G, Sultanem K, Muanza T. Descriptive study of patients receiving excision and radiotherapy for keloids. Int J Radiat Oncol Biol Phys. 2008;71(5):1465–9.
24. Lo TC, Seckel BR, Salzman FA, Wright KA. Single-dose electron beam irradiation in treatment and prevention of keloids and hyper- trophic scars. Radiother Oncol. 1990;19(3):267–72.
25. Chen HC, Ou SY, Lai YL. Combined surgery and irradiation for treatment of hypertrophic scars and keloids. Zhonghua Yi Xue Za Zhi (Taipei). 1991;47(4):249–5.
26. Maarouf M, Schleicher U, Schmachtenberg A, Ammon J. Radiotherapy in the management of keloids. Clinical experience with electron beam irradiation and comparison with X-ray therapy. Strahlenther Onkol. 2002;178(6):330–5.
27. Bischof M, Krempien R, Debus J, Treiber M. Postoperative elec- tron beam radiotherapy for keloids: objective findings and patient satisfaction in self-assessment. Int J Dermatol. 2007;46(9): 971–5.
28. Ogawa R, Mitsuhashi K, Hyakusoku H, Miyashita T. Postoperative electron-beam irradiation therapy for keloids and hypertrophic scars: retrospective study of 147 cases followed for more than 18 months. Plast Reconstr Surg. 2003;111(2):547–53. discussion 554–5.
29. Ogawa R, Miyashita T, Hyakusoku H, Akaishi S, Kuribayashi S, Tateno A. Postoperative radiation protocol for keloids and hypertrophic scars: statistical analysis of 370 sites followed for over 18 months. Ann Plast Surg. 2007;59(6):688–91.
30. Vivante H, Salgueiro MJ, Ughetti R, Nicolini J, Zubillaga M. 32P-patch contact brachyradiotherapy in the management of recalcitrant keloids and hypertrophic scars. Indian J Dermatol Venereol Leprol. 2007;73(5):336–9.
31. Supe SS, Supe SJ, Rao SM, Deka AC, Deka BC. Treatment of keloids by 90Sr-90Y beta-rays. Strahlenther Onkol. 1991;167(7):397–402.
32. Fraunholz IB, Gerstenhauer A, Böttcher HD. Results of postopera- tive (90)Sr radiotherapy of keloids in view of patients’ subjective assessment. Strahlenther Onkol. 2005;181(11):724–9.
33. Malaker K, Zaidi M, Franka MR. Treatment of earlobe keloids using the cobalt 60 teletherapy unit. Ann Plast Surg. 2004;52(6):602–4.
34. Malaker A, Ellis F, Paine CH. Keloid scars: a new method of treat- ment combining surgery with interstitial radiotherapy. Clin Radiol. 1976;27(2):179–83.
35. Escarmant P, Zimmermann S, Amar A, Ratoanina JL, Moris A, Azaloux H, Francois H, Gosserez O, Michel M, G’Baguidi R. The treatment of 783 keloid scars by iridium 192 interstitial irradiation after surgical excision. Int J Radiat Oncol Biol Phys. 1993;26(2):245–51.
36. Clavere P, Bedane C, Bonnetblanc JM, Bonnafoux-Clavere A, Rousseau J. Postoperative interstitial radiotherapy of keloids by iridium 192: a retrospective study of 46 treated scars. Dermatology. 1997;195(4):349–52.
37. Guix B, Henríquez I, Andrés A, Finestres F, Tello JI, Martínez A. Treatment of keloids by high-doserate brachytherapy: a seven- year study. Int J Radiat Oncol Biol Phys. 2001;50(1):167–72.
38. Garg MK, Weiss P, Sharma AK, Gorla GR, Jaggernauth W, Yaparpalvi R, Delrowe J, Beitler JJ. Adjuvant high dose rate brachytherapy (Ir-192) in the management of keloids which have recurred after surgical excision and external radiation. Radiother Oncol. 2004;73(2):233–6.
39. Narkwong L, Thirakhupt P. Postoperative radiotherapy with high dose rate iridium 192 mould for prevention of earlobe keloids. J Med Assoc Thai. 2006;89(4):428–33.
40. Veen RE, Kal HB. Postoperative high-dose-rate brachytherapy in the prevention of keloids. Int J Radiat Oncol Biol Phys. 2007;69(4):1205–8.
41. Kuribayashi S, Miyashita T, Ozawa Y, Iwano M, Ogawa R, Akaishi S, Dohi T, Hyakusoku H, Kumita S. Post-keloidectomy irradia- tion using high-dose-rate superficial brachytherapy. J Radiat Res. 2011;52(3):365–8.
42. Ogawa R, Huang C, Akaishi S, Dohi T, Sugimoto A, Kuribayashi S, Miyashita T, Hyakusoku H. Analysis of surgical treatments for ear- lobe keloids: analysis of 174 lesions in 145 patients. Plast Reconstr Surg. 2013;132(5):818e–25e.
43. Ogawa R, Akaishi S, Dohi T, Kuribayashi S, Miyashita T, Hyakusoku H. Analysis of the surgical treatments of 63 keloids on the cartilaginous part of the auricle: effectiveness of the core exci- sion method. Plast Reconstr Surg. 2015;135(3):868–75.
44. Ogawa R, Ono S, Akaishi S, Dohi T, Iimura T, Nakao J. Reconstruction after anterior chest wall keloid resection using internal mammary artery perforator propeller flaps. Plast Reconstr Surg Glob Open. 2016;4(9):e1049.
45. Kal HB, Veen RE. Biologically effective doses of postoperative radiotherapy in the prevention of keloids. Dose-effect relationship. Strahlenther Onkol. 2005;181:717–23.
46. Preston DL, Ron E, Tokuoka S, Funamoto S, Nishi N, Soda M, Mabuchi K, Kodama K. Solid cancer incidence in atomic bomb survivors: 1958– 1998. Radiat Res. 2007;168(1):1–64.