Bài viết Tìm hiểu về các kiến thức trong chẩn đoán lâm sàng và bệnh lý của sẹo – Tải file PDF Tại đây.
Tác giả: Rei Ogawa
Dịch: Bs. Trương Tấn Minh Vũ
Sẹo da thường thấy ở các phòng khám da liễu, có thể là do chấn thương hoặc phẫu thuật, đôi khi nguyên nhân không được biết rõ. Cho đến gần đây, hầu hết các nghiên cứu về nguyên nhân gây sẹo da đều xem xét các nguyên nhân di truyền, nội tiết, miễn dịch và dinh dưỡng tiềm ẩn. Sự tập trung này thay đổi gần đây khi nhiều bằng chứng từ nhiều lĩnh vực khác nhau cho thấy cơ chế tại chỗ, rối loạn chức năng nội mô và chuyển hóa lipid cũng có thể góp phần gây sẹo. Tuy nhiên, trong khi những nỗ lực được thực hiện để làm sáng tỏ các cơ chế phân tử, các yếu tố căn nguyên thúc đẩy sẹo, thì các cơ chế này hiện chủ yếu được hỗ trợ bởi bằng chứng giả thuyết gián tiếp hơn là dữ liệu cứng. Những nguyên nhân gây sẹo không chắc chắn này có nghĩa là sự lựa chọn giữa các phương thức điều trị khác nhau cho từng vết sẹo hiện nay vẫn phụ thuộc vào chẩn đoán sẹo hiện tại, dựa trên đánh giá lâm sàng của bác sĩ và dấu hiệu dưới kính hiển vi. Chương này cung cấp tổng quan về các loại sẹo khác nhau hiện có. Cụ thể, các biểu hiện của các loại sẹo riêng biệt, cách chẩn đoán và phân biệt chúng với nhau, cũng như các biến chứng của chúng được mô tả chi tiết.
7.1 Phân loại sẹo da
Sẹo da về cơ bản là kết quả của quá trình lành thương bất thường gây ra sự tích tụ quá mức các thành phần tế bào và ngoại bào. Tùy thuộc vào sự chú trọng của bác sĩ, sẹo có thể được phân loại theo nhiều cách khác nhau. Cụ thể, sẹo có thể được phân loại theo nguyên nhân ban đầu (ví dụ: chấn thương, bỏng, mụn trứng cá, tiêm vaccin và vết cắt), hình dạng và biểu hiện (ví dụ: sẹo tuyến tính và sẹo màng), các biến dạng làm suy yếu chức năng gây ra (ví dụ: dính và co rút), mức độ nghiêm trọng chung (ví dụ: thoái hóa và phì đại) và các biến chứng tiềm ẩn (ví dụ: loét và ác tính). Trong chương này, chúng tôi phân loại sẹo theo các đặc điểm lâm sàng và bệnh lý của sẹo thành sẹo bình thường, sẹo teo, sẹo phì đại, sẹo lồi và loét ác tính của sẹo.
7.2 Thang điểm đánh giá sẹo được dùng để đánh giá mức độ nghiêm trọng của sẹo
Bất kể hệ thống phân loại sẹo nào được chọn, nó cần phải đánh giá chính xác mức độ nghiêm trọng của từng vết sẹo, vì điều này sẽ giúp bác sĩ lựa chọn chiến lược điều trị phù hợp nhất. Smith và cộng sự báo cáo kỹ thuật đo lường mức độ nghiêm trọng của sẹo đầu tiên vào năm 1988: họ báo cáo rằng khi các nhóm gồm bốn hoặc nhiều nhân viên bệnh viện xem trình chiếu các bức ảnh màu, họ đánh giá đáng tin cậy các biến số về mức độ nghiêm trọng của sẹo như biến dạng thẩm mỹ theo các khía cạnh bất thường, độ dày và đổi màu. Sau đó, nhiều thang điểm đánh giá sẹo khác nhau được đề xuất và trong một số trường hợp được điều chỉnh thêm. Các thang điểm này bao gồm thang điểm đánh giá sẹo Vancouver (VSS), thang điểm Seattle, thang điểm Manchester, thang điểm Hamilton, thang điểm đánh giá sẹo của bệnh nhân và người quan sát (POSAS), công cụ đánh giá phù hợp giữa sẹo và ảnh chụp (MAPS), thang điểm Stony Brook (SBSES) và thang điểm “4P” của Đại học Bắc Carolina (UNC4P). Ưu điểm và nhược điểm tương đối của từng thang điểm được thảo luận kỹ lưỡng và được trình bày chi tiết trong một số bài đánh giá cụ thể. Các thang điểm được sử dụng rộng rãi nhất là VSS và POSAS. Điểm VSS dựa trên ước tính bán định lượng của các bác sĩ về sắc tố sẹo, mạch máu, độ mềm dẻo và độ cao/độ dày. Điểm POSAS dựa trên ước tính của cả bệnh nhân và người quan sát. Do đó, thang điểm đánh giá sẹo của bệnh nhân (P-SAS) được sử dụng để ước tính mức độ đau và ngứa cũng như màu sắc, độ cứng, độ dày và độ bất thường của sẹo so với da bình thường, trong khi thang điểm đánh giá sẹo của người quan sát (O-SAS) được sử dụng để đánh giá mức độ mạch máu hóa, sắc tố, độ dày, độ nổi bật và độ mềm dẻo. Ngoài ra, vào năm 2015, chúng tôi phát triển một hệ thống tính điểm mới tại Hội thảo về sẹo Nhật Bản. Thang điểm sẹo JSW này được sử dụng để chẩn đoán cụ thể các vết sẹo bệnh lý và dựa trên quan niệm rằng sẹo phì đại và sẹo lồi đại diện cho các giai đoạn viêm da tồi tệ hơn liên tiếp.
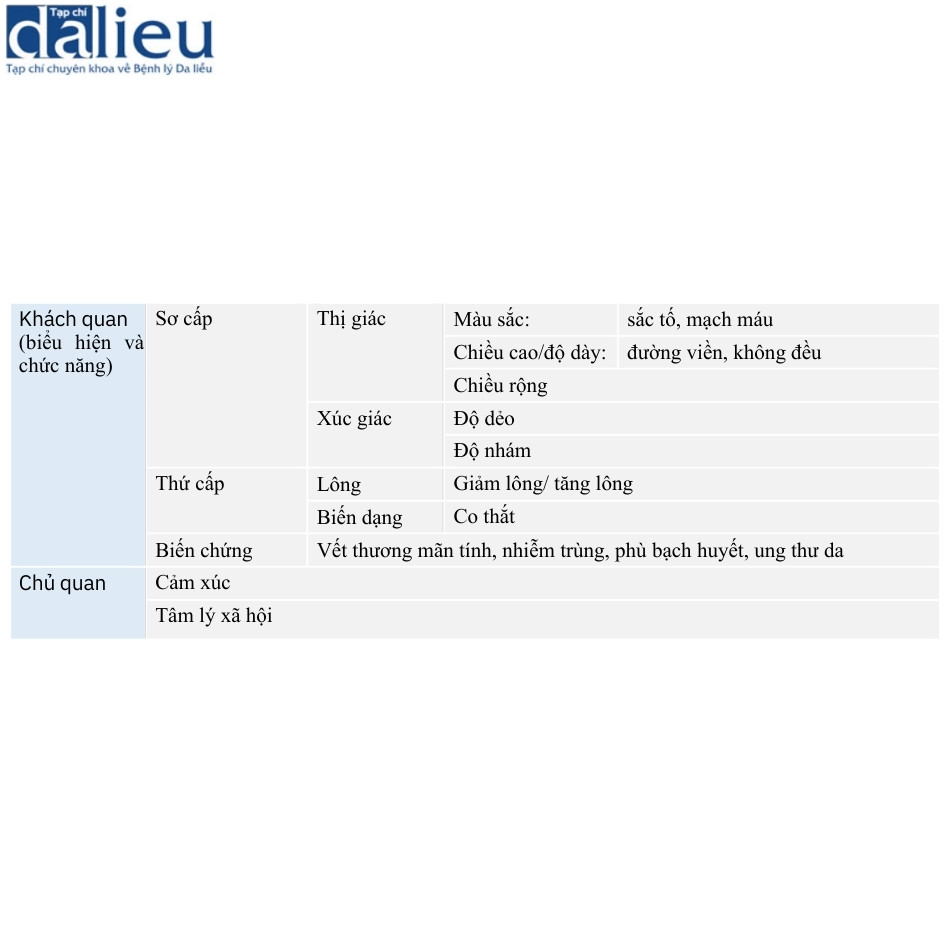
Các thang đo sẹo khác nhau này và kinh nghiệm lâm sàng của chúng tôi cho thấy rằng một số biến số chính quyết định mức độ nghiêm trọng của sẹo. Cùng với nguyên nhân gây sẹo, tuổi và vị trí của sẹo, tất cả các biến số này đều phải được đánh giá tốt nhất, bất kể loại sẹo nào. Các biến số này liên quan đến biểu hiện khách quan và suy giảm chức năng do sẹo gây ra và tác động chủ quan của sẹo, theo trải nghiệm của bệnh nhân, lên cảm xúc và các khía cạnh tâm lý xã hội. Đánh giá khách quan bao gồm các biến số thị giác và xúc giác chính, bao gồm màu sắc (sắc tố và mạch máu), chiều cao hoặc độ dày, chiều rộng, độ mềm dẻo và độ thô ráp bề mặt. Đánh giá khách quan cũng kiểm tra tác động của sẹo lên sự phát triển của lông thứ cấp (thiếu lông hoặc tăng lông) và biến dạng (ví dụ: co thắt) và các biến chứng liên quan đến sẹo, bao gồm vết thương mãn tính, nhiễm trùng, phù bạch huyết và ung thư da. Trong đánh giá chủ quan, bệnh nhân được hỏi xem có đau, ngứa hoặc loạn cảm giác không và liệu sẹo có để lại hậu quả về mặt tâm lý xã hội không (Bảng 7.1). Các biến số này có thể được đo lường theo cách định tính (ví dụ: có hoặc không), được phân loại theo cách bán định lượng (ví dụ: nhẹ, trung bình và nặng) hoặc ước tính định lượng (ví dụ: mm hoặc mm2 ).
Bất kể thang độ sẹo, công cụ hoặc phương pháp nào được chọn, mức độ nghiêm trọng của sẹo nên được đánh giá với mục đích xác định liệu pháp phù hợp nhất dựa trên kỳ vọng của bệnh nhân (như được chỉ ra bởi các biến số chủ quan) và khả năng thực hiện trên lâm sàng (như được xác định bởi các đánh giá khách quan của bác sĩ).
7.3 Chẩn đoán lâm sàng và bệnh lý của sẹo
Trong chương này, sẹo da được phân loại thành sẹo bình thường, sẹo teo, sẹo phì đại, sẹo lồi và loét ác tính của sẹo. Mặc dù từng bệnh nhân có thể có nhiều loại sẹo khác nhau (thậm chí trong cùng một vết sẹo), nhưng các loại sẹo khác nhau này được thảo luận ở đây như các tổn thương độc lập có thể được chẩn đoán phân biệt dựa trên các biểu hiện lâm sàng của chúng (ví dụ: tiền sử, triệu chứng, dấu hiệu và đặc điểm) và các đặc điểm bệnh lý (ví dụ: thay đổi chất nền tế bào và ngoại bào). Chúng tôi cũng thảo luận về cách phân biệt sẹo lồi với sẹo phì đại, đảm bảo phương pháp điều trị phù hợp nhất cho cả hai loại sẹo.
7.3.1 Sẹo bình thường
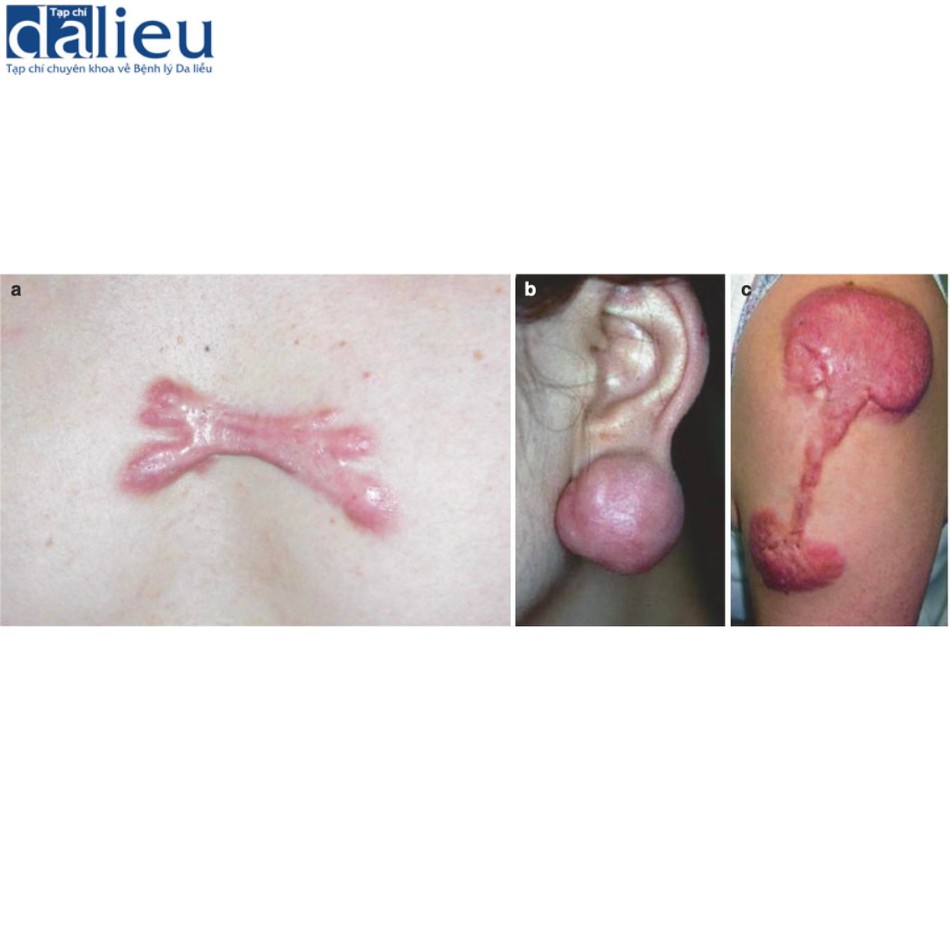
Sẹo bình thường (còn gọi là sẹo trưởng thành) thường biểu hiện dưới dạng sẹo nông và trưởng thành có kết cấu mềm dẻo và bề ngoài phẳng hoặc hơi nhô lên. Có thể có hoặc không có thay đổi về sắc tố. Tổn thương ban đầu thường xảy ra cách một hoặc nhiều năm. Về mặt lâm sàng, có thể có hình dạng tuyến tính (Hình 7.1a) hoặc hình cái cầu (Hình 7.1b) và không gây suy giảm chức năng hoặc lo ngại đáng kể về mặt thẩm mỹ. Tình trạng giảm sắc tố của các sẹo bình thường như vậy có thể rất nhẹ đến mức ngay cả các bác sĩ cũng khó phân biệt được ranh giới chính xác của chúng với vùng da bình thường lân cận. Tuy nhiên, khi so sánh với da bình thường ở cấp độ bệnh lý, có những thay đổi rõ ràng. Đầu tiên, lớp biểu bì của sẹo bình thường mỏng hơn và có các gờ rete phẳng. Thứ hai, các bó collagen ở lớp bì rộng hơn và có nhiều khả năng được sắp xếp song song với lớp biểu bì. Thứ ba, collagen ở lớp bì sâu biểu hiện sự phân mảnh rõ ràng làm khó phân biệt lớp bì nhú/nông với lớp bì lưới/sâu. Thứ tư, các sợi đàn hồi ở lớp bì nông biểu hiện có đường kính nhỏ hơn các sợi đàn hồi ở da bình thường (0,54 so với 1,08 μm); điều này cũng được quan sát thấy ở lớp bì sâu (1,16 so với 1,99 μm).
Điều này được hỗ trợ bởi phân tích lập thể cho thấy hệ thống đàn hồi, bao gồm fibrillin1 và elastin, bị phá vỡ trong các vết sẹo bình thường. Cụ thể, ở cả lớp bì nông và sâu, các sợi chứa fibrillin-1 trong các vết sẹo bình thường chiếm ít thể tích hơn (như thể hiện bằng mật độ thể tích fibillin-1 thấp hơn) so với các sợi trong da bình thường. Tuy nhiên, mật độ thể tích fibrillin-1 ở lớp bì trong các vết sẹo bình thường cao hơn trong các vết sẹo phì đại và sẹo lồi. Kiểu hình này cũng được thấy đối với các sợi chứa elastin trong lớp bì nông (tức là mật độ thể tích elastin: da bình thường > sẹo bình thường > sẹo phì đại ≈ sẹo lồi). Tuy nhiên, ở lớp bì sâu, da bình thường, sẹo bình thường và sẹo phì đại có thể tích sợi elastin tương tự nhau, mặc dù tất cả đều có mật độ thể tích elastin thấp hơn ở lớp bì sâu so với sẹo lồi.
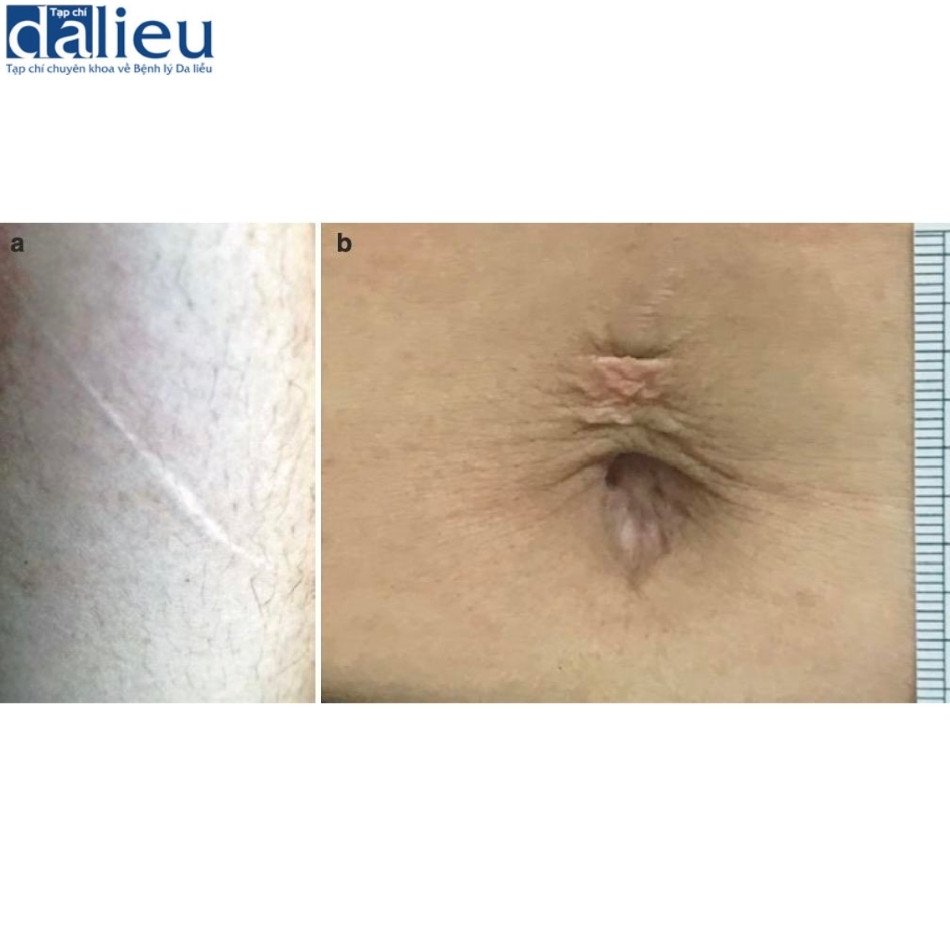
7.3.2 Sẹo teo
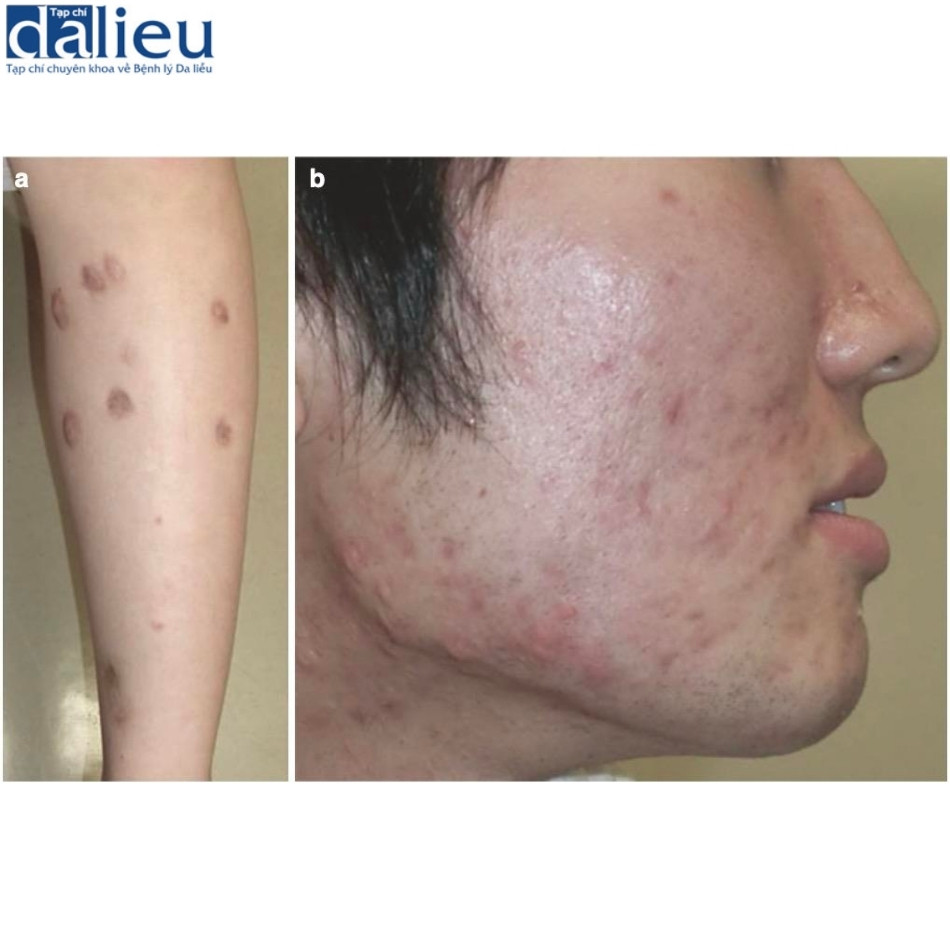
Sẹo teo (còn được gọi là sẹo lõm) là sẹo có biểu hiện lõm trong da bên dưới mức mô xung quanh, có thể có tình trạng tăng sắc tố hoặc giảm sắc tố, thường do mụn bọc, phẫu thuật, bỏng và chấn thương gây ra. Về mặt lâm sàng, sẹo teo thường gặp nhất ở mặt và đầu và vùng da nằm phía trên xương chày. Biểu hiện lõm rõ ràng của những vết sẹo này có liên quan phần nào đến tổn thương collagen hoặc bất thường trong quá trình sản xuất collagen và chấn thương, teo hoặc thiếu hụt mô dưới da bên dưới. Sẹo teo thường được thấy ở sẹo mụn trên mặt và sẹo phía trên xương chày (Hình 7.2). Goodman đề xuất rằng sẹo teo sau mụn có thể được chia thành ba phân nhóm dựa trên độ sâu và mức độ viêm, cụ thể là sẹo dát nông, sẹo bì sâu hơn và sẹo quanh nang lông. Các phân nhóm này được đặc trưng bởi các dát đổi màu, sẹo có thành sắc cạnh/ nhọn/ rãnh và sẹo sẩn giảm sắc tố. Thông thường, sẹo teo nằm gần xương bên dưới (như sẹo nằm trên xương chày) có xu hướng có da mỏng và dễ vỡ nên dễ bị ma sát tổn thương. Sự bất ổn này làm tăng nguy cơ loét tái phát hoặc loét mãn tính thứ phát, trường hợp sau có thể dẫn đến biến đổi ác tính (xem Mục 7.4).
Về mặt bệnh lý, sẹo teo được đặc trưng bởi sự co vào trong của biểu mô, lớp bì teo quá mức và teo lớp mỡ bên dưới. Các bó collagen bị teo rõ ràng dưới kính hiển vi và các sợi elastin mỏng, bị phá vỡ và phân mảnh (Hình 7.3). Các mô hình bệnh lý này có thể phản ánh những thay đổi trong quá trình phân giải gelatin: phân tích ELISA và gelatin zymography của các dạng hoạt động và tiền hoạt động của metalloproteinase chất nền (MMP)-2 trong da người bình thường và nhiều loại sẹo khác nhau cho thấy sẹo teo có mức MMP-2 thấp hơn nhiều (0,006 ng/mg protein) so với da bình thường (0,216 ng/mg protein), sẹo phì đại (0,407 ng/mg protein) và sẹo lồi (1,223 ng/mg protein). Do đó, sẹo teo có tỷ lệ hoạt động/tiền hoạt động của MMP-2 thấp hơn (0,48) so với da bình thường (0,54), sẹo phì đại (0,69) và sẹo lồi (0,97). MMP2 thường có biểu hiện ban đầu trong nhiều tế bào không viêm và đóng vai trò duy trì trong lớp bì bình thường. Những phát hiện này cho thấy sự tham gia của hoạt động phân giải gelatin bị rối loạn trong giai đoạn tái cấu trúc ở sẹo teo.
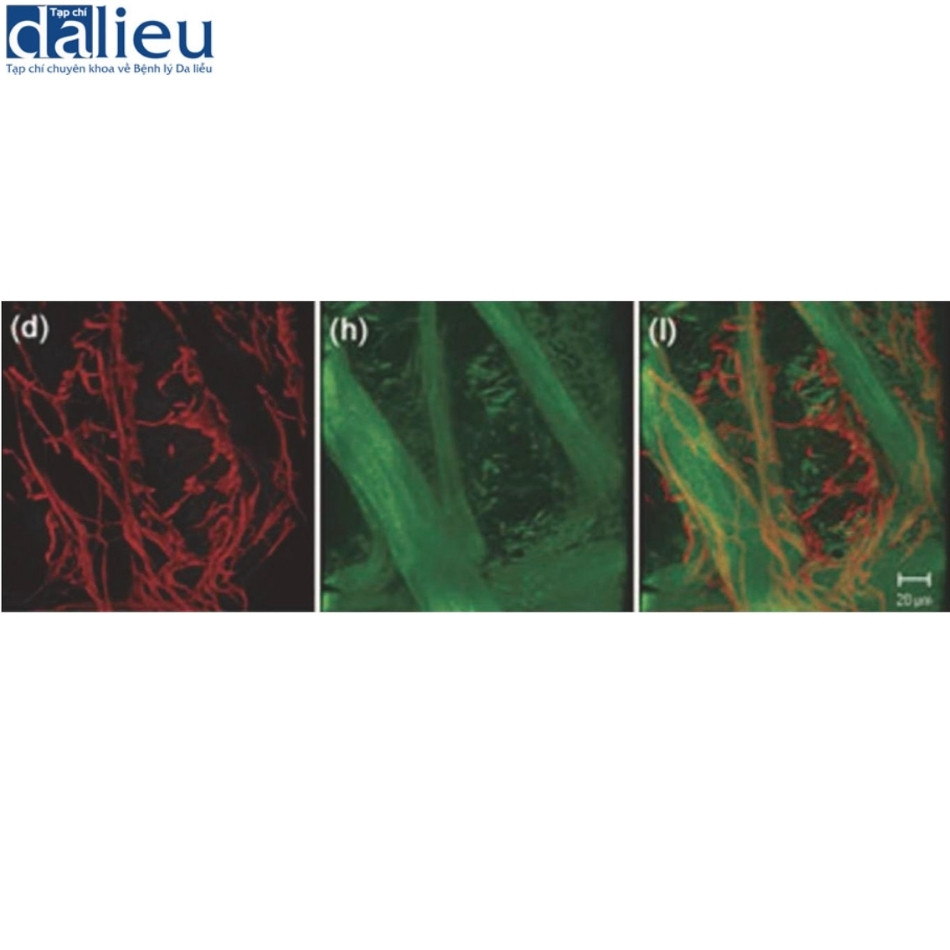
7.3.3 Sẹo phì đại
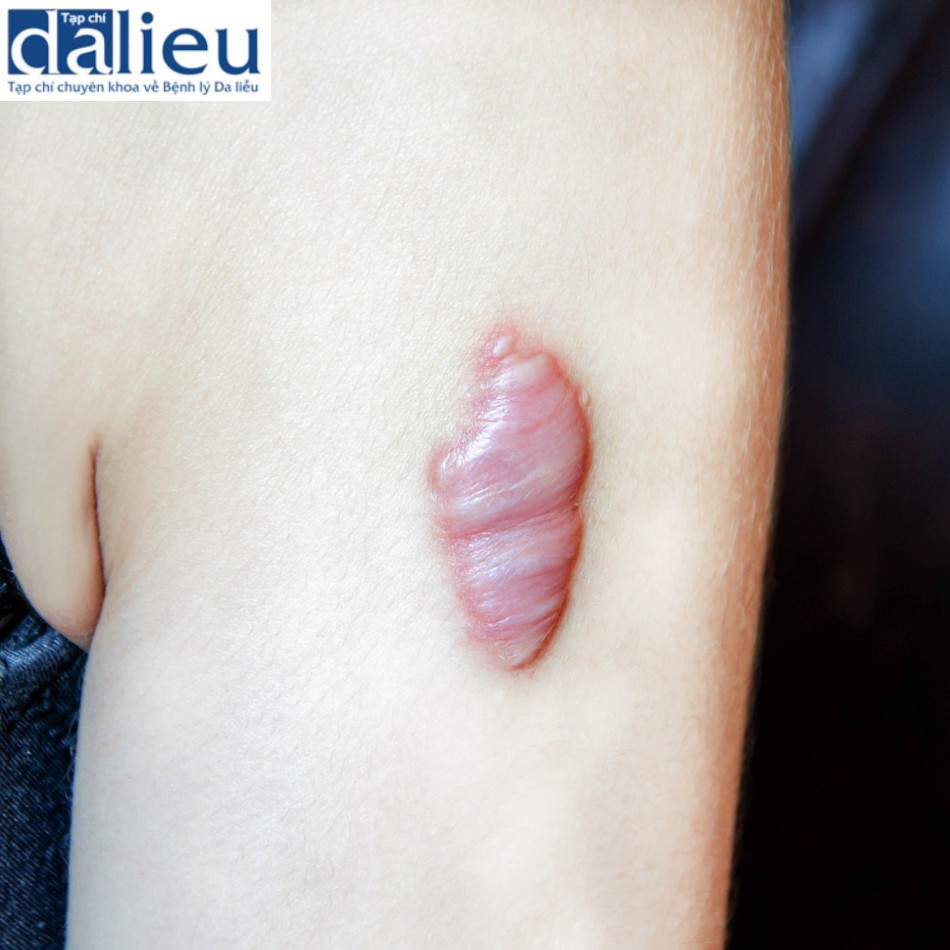
Sẹo phì đại là sẹo bệnh lý nhô lên phát triển ngay lập tức hoặc trong vòng vài tháng từ các vết thương thấy được do bỏng, chấn thương hoặc vết cắt. Khối lượng của các vết sẹo này thường nằm trong ranh giới của vết thương ban đầu và có thể tự phẳng sau 1–2 năm kể từ khi chúng xuất hiện (Hình 7.4a). Những vết sẹo này không đẹp về mặt thẩm mỹ và có thể gây ra hậu quả về mặt tâm lý khi chúng nằm trên các bộ phận bộc lộ của cơ thể. Hơn nữa, nếu chúng nằm trên hoặc gần khớp, chúng có thể làm suy yếu chức năng khớp do co cứng (Hình 7.4b). Trong những trường hợp như vậy, cần phải phẫu thuật để giải phóng tình trạng co cứng để phục hồi chức năng khớp.
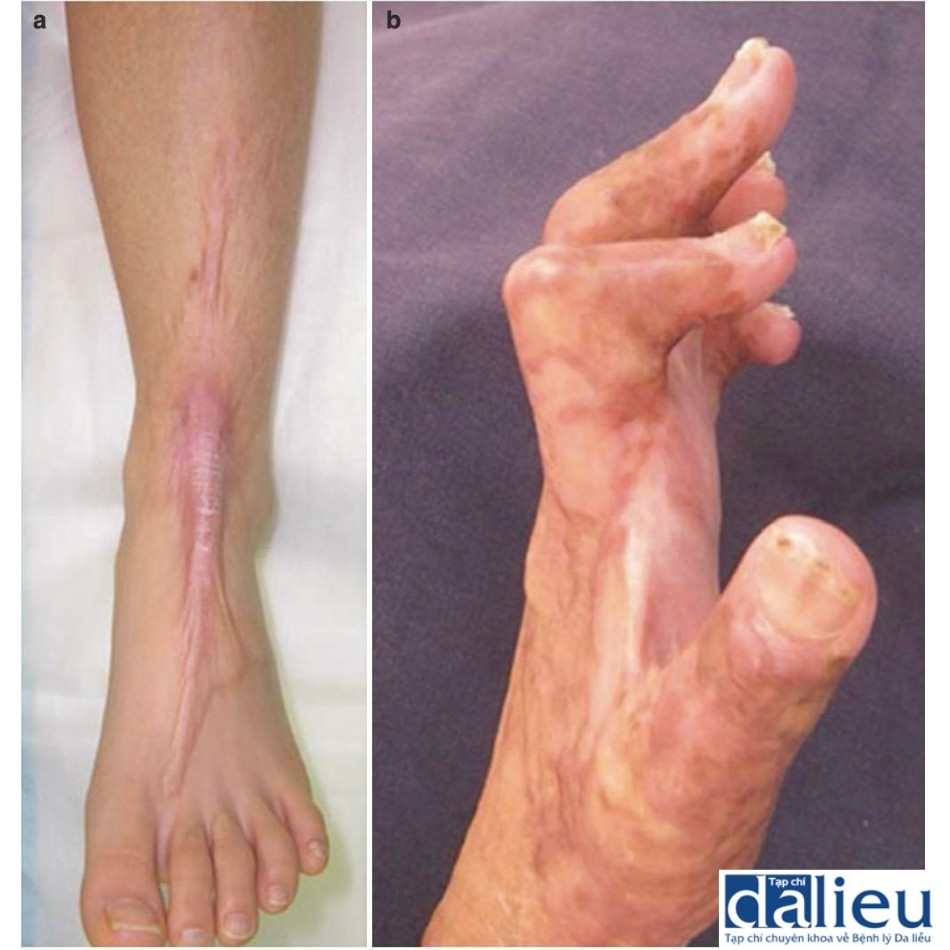
Ở cấp độ bệnh lý, từ lâu người ta vẫn cho rằng sẹo phì đại được phân biệt với các loại sẹo khác, bao gồm sẹo lồi, bằng sự hiện diện của các nốt ở lớp bì. Các nốt được phân định rõ ràng này bao gồm các tập hợp cục bộ của nguyên bào sợi và các sợi collagen định hướng ngẫu nhiên. Chẩn đoán bệnh lý của sẹo phì đại được hỗ trợ thêm bởi kiểu biểu hiện của actin cơ trơn α (α-SMA); sẹo phì đại được cho rằng có biểu hiện lan tỏa của α-SMA trong khi sẹo lồi biểu hiện ít hoặc chỉ biểu hiện tập trung của α-SMA. Đáng chú ý, so với sẹo bình thường, lớp biểu bì của sẹo phì đại biểu hiện sự biểu hiện tăng cường của keratin K6 và K16. Điều này biểu thị sự hoạt hóa của tế bào sừng, có thể làm chậm quá trình tái biểu mô và kéo dài tình trạng viêm biểu bì. Thật vậy, sẹo phì đại biểu hiện tăng số lượng tế bào Langerhans, tăng biểu hiện interleukin-4 biểu bì và giảm biểu hiện interleukin-1α biểu bì. Hơn nữa, Rossiello và cộng sự chỉ ra rằng lớp biểu bì của sẹo phì đại biểu hiện mức cyclooxygenase-1 cao hơn lớp biểu bì của da bình thường và các mẫu sẹo lồi. Những phát hiện này ủng hộ quan điểm cho rằng tín hiệu viêm/miễn dịch quá mức, kéo dài và/hoặc bất thường từ lớp biểu bì có thể thúc đẩy quá trình tái cấu trúc lớp bì bất thường và do đó góp phần hình thành sẹo phì đại.
Lớp bì của sẹo phì đại mở rộng đáng kể so với lớp bì của da bình thường và các bó collagen gợn sóng xếp lỏng lẻo phẳng hơn, ít phân định rõ ràng hơn, hơi phân mảnh và ngắn hơn so với các bó collagen ở da bình thường. Tuy nhiên, phần lớn các bó collagen vẫn chạy song song với bề mặt biểu mô và Friedman và cộng sự cho thấy tỷ lệ collagen loại I/III trung bình là 7,73, tương tự như tỷ lệ ở da bình thường (6,28) hoặc sẹo bình thường (5,97) và thấp hơn nhiều so với tỷ lệ ở sẹo lồi (17,28). Hyaluronan, là một thành phần ECM, phân bố nhiều ở khắp lớp bì nhú ở da bình thường và mỏng hơn ở sẹo trưởng thành, chỉ xuất hiện dưới dạng một dải hẹp ở sẹo phì đại. Sẹo lồi thậm chí còn biểu hiện ít hyaluronan ở lớp bì nhú hơn. Fibronectin ở lớp bì, giảm dần ở sẹo trưởng thành, vẫn tồn tại ở sẹo phì đại dưới dạng các đường lan tỏa hoặc cuộn. Tuy nhiên, sẹo phì đại không biểu hiện nhiều tế bào mast hơn sẹo bình thường.
7.3.4 Sẹo lồi
Sẹo lồi là sẹo bệnh lý là kết quả của quá trình lành thương quá mức. Từ “quá mức” ở đây phù hợp với các đặc điểm lâm sàng nổi bật của chúng. Thứ nhất, ngay cả những vết thương nhỏ như ‘vết muỗi đốt’ hoặc viêm nang lông nhỏ tại chỗ cũng có thể dẫn đến sẹo lồi. Thứ hai, sẹo lồi phát triển liên tục do tình trạng viêm kéo dài và nghiêm trọng, đặc biệt là ở rìa tiến triển, thường có ban đỏ. Thứ ba, sẹo lồi phát triển vượt ra ngoài ranh giới vết thương ban đầu, do đó khiến chúng nhô vào vùng da khỏe mạnh lân cận. Chúng không bao giờ thoái triển theo thời gian và việc cắt bỏ bằng phẫu thuật hiếm khi ngăn chặn được sự phát triển của sẹo và liên quan thực sự đến tỷ lệ tái phát cao. Tuy nhiên, vì các triệu chứng lâm sàng về mặt không gian và thời gian chẩn đoán của sẹo lồi cần thời gian để biểu hiện nên các bác sĩ phải mất từ 3 tháng đến 1 năm sau khi bị thương mới có thể phân biệt được những vết sẹo này với các vết sẹo bình thường, thường trưởng thành vào khoảng thời gian này.
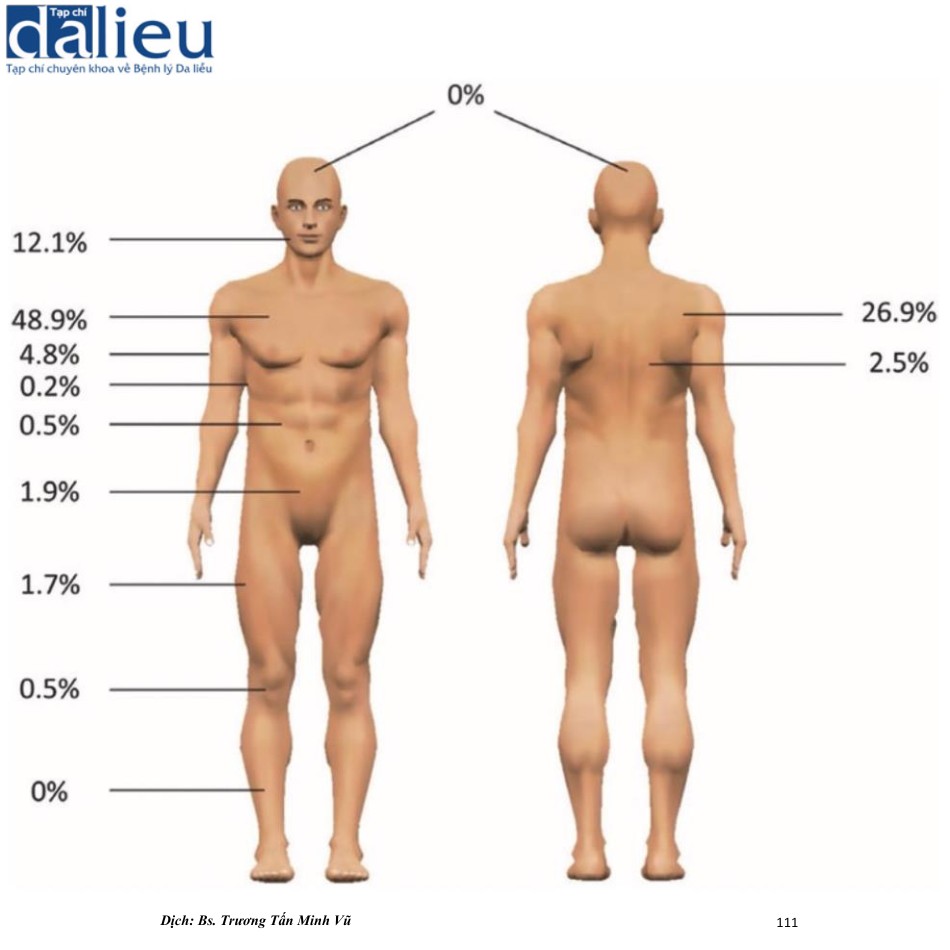
Tỷ lệ mắc sẹo lồi thay đổi từ 0,09% ở Vương quốc Anh đến 16% ở Congo. Dữ liệu dịch tễ học của chúng tôi về 1500 vùng giải phẫu ở 483 bệnh nhân Nhật Bản cho thấy sẹo lồi chủ yếu xuất hiện ở vùng ngực trước (48,9%), vùng xương bả vai (26,9%) và vùng hàm dưới-cổ (12,1%) (Hình 7.5). Đáng chú ý là những vùng này rất dễ di động và/hoặc tiếp xúc với sức căng kéo cao; ngược lại, sẹo lồi hiếm khi phát triển ở những vùng như vùng đỉnh hoặc vùng trước cẳng chân, nơi hiếm có sự kéo căng/co da. Hơn nữa, sẹo lồi thường có hình dạng điển hình ở những vùng cụ thể của cơ thể. Ví dụ, sẹo lồi ở ngực giống hình càng cua, sẹo lồi ở vùng xương bả vai có hình con bướm hoặc hình quả tạ, và sẹo lồi ở dái tai có hình quả bóng. Phân tích cơ học tại chỗ cho thấy những hình dạng này phần lớn được xác định bởi hướng và sự phân bố lực căng của da ưu thế đặc trưng cho những vùng khác nhau này của cơ thể (Hình 7.6). Khái niệm này được hỗ trợ thêm bởi một nghiên cứu trong ống nghiệm cho thấy rằng các nguyên bào sợi lớp bì, có số lượng lớn trong sẹo lồi, rất nhạy cảm với mô hình kéo giãn theo chu kỳ: khi được kích thích theo cách này, chúng trở nên đề kháng với sự chết theo chương trình apotosis và nhanh chóng di chuyển và tái định hướng theo hướng vuông góc với hướng kéo giãn.
Về mặt bệnh lý, đặc điểm bệnh lý đặc trưng nhất của sẹo lồi là sự hiện diện của collagen hyalin hóa ở lớp bì lưới. Hơn nữa, so với sẹo bình thường hoặc da bình thường, sẹo lồi biểu hiện sự thâm nhiễm rõ rệt của các tế bào viêm, cụ thể là tế bào T, tế bào B và đại thực bào thay thế (M2). Đáng chú ý, chúng có số lượng tế bào Langerhans trong biểu bì bình thường. Sẹo lồi cũng biểu hiện hoạt hóa tế bào mast, được chỉ ra bởi biểu hiện điều hoà tăng của dấu hiệu hoạt hóa đặc hiệu MC βtryptase. Một số nghiên cứu đề xuất rằng, giống như trong sẹo phì đại, tương tác biểu mô-trung mô có thể góp phần vào quá trình sinh bệnh của sẹo lồi. Đầu tiên, các nghiên cứu trong ống nghiệm cho thấy rằng các tế bào sừng từ lớp biểu bì sẹo lồi thúc đẩy các nguyên bào sợi tiết ra yếu tố tăng trưởng mô liên kết theo cách cận tiết. Yếu tố này làm tăng xơ hóa bằng cách hoạt động như một đồng yếu tố hoặc một chất trung gian hạ lưu của yếu tố tăng trưởng chuyển dạng β. Thứ hai, Rossiello phát hiện ra rằng lớp biểu bì sẹo lồi biểu hiện mức cyclooxygenase-2 cao hơn lớp biểu bì của da bình thường và sẹo phì đại. Phân tích biểu hiện kháng nguyên nhân tế bào tăng sinh của các mẫu da cho thấy các nguyên bào sợi trong lớp bì sẹo lồi tăng sinh nhiều hơn (75,1% ± 8,1%) so với các nguyên bào sợi trong sẹo phì đại (45,6% ± 10,6%, p < 0,01) và da bình thường (38,8% ± 6,3%, p < 0,01). Hơn nữa, như đề cập ở trên, Friedman chỉ ra rằng sẹo lồi có tỷ lệ collagen loại I/III cao hơn nhiều so với da bình thường (17,28 so với 6,28). Uitto ghi nhận tỷ lệ mRNA procollagen loại I/III lớn hơn ở sẹo lồi (22,1 ± 7,8) so với nuôi cấy tế bào da người bình thường (5,2 ± 2,1), do tăng biểu hiện mRNA procollagen loại I và không thay đổi biểu hiện mRNA procollagen III. Sẹo lồi cũng biểu hiện fibronectin cao hơn da bình thường và hyaluronan chủ yếu được phát hiện ở các lớp hạt và gai dày của lớp biểu bì và ít nhất ở lớp bì nhú.
Nhìn chung, không khó để chẩn đoán sẹo lồi nếu bệnh nhân có tiền sử lâm sàng điển hình, tổn thương nằm ở vùng dễ hình thành sẹo lồi và tổn thương ngứa hoặc đau. Tuy nhiên, đôi khi bác sĩ nhầm sẹo lồi với các bệnh khác có hình dạng tương tự, chẳng hạn như u nang sụn. Sai lầm này càng gia tăng do thực tế là bác sĩ hiếm khi gợi ý sinh thiết các tổn thương giống sẹo lồi. Hơn nữa, đôi khi bác sĩ không nhận ra rằng một số phản ứng sẹo lồi phát sinh do bệnh nhân mắc bệnh lý viêm không ngờ (ví dụ: xơ cứng bì dạng nốt/sẹo lồi). Những chẩn đoán sai có hại nhất trong số này là khi tổn thương thực sự là khối u ác tính (ví dụ: u xơ da ác tính protuberans-DFSP) hoặc bệnh truyền nhiễm (ví dụ: bệnh nấm lobomycosis). Điều này gây ra vấn đề vì điều trị các tổn thương này bằng cách tiêm steroid, phương pháp điều trị phổ biến đối với sẹo lồi, không chỉ làm chậm chẩn đoán chính xác mà còn có thể làm trầm trọng thêm bệnh.
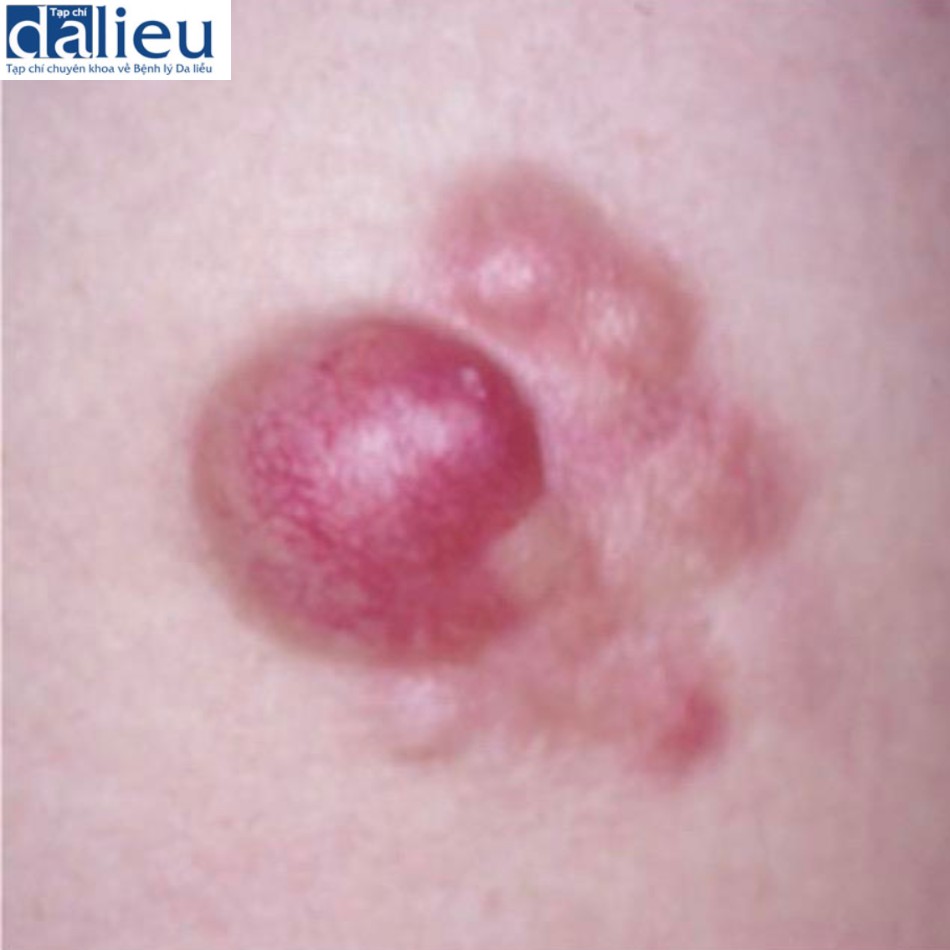
Liên quan đến các bệnh được chẩn đoán nhầm, DFSP là khối u tế bào hình thoi ở lớp bì giống với sẹo lồi, đặc biệt là loại xơ cứng hoặc teo (Hình 7.7). Chẩn đoán phân biệt phụ thuộc vào các dấu hiệu điển hình của DSFP, cụ thể là các tế bào hình thoi đơn hình được sắp xếp theo kiểu “dệt” trong mô đệm xơ và nhuộm miễn dịch mô học để phát hiện biểu hiện CD34: sẹo lồi không biểu hiện CD34, trong khi 75% tế bào khối u DFSP biểu hiện.
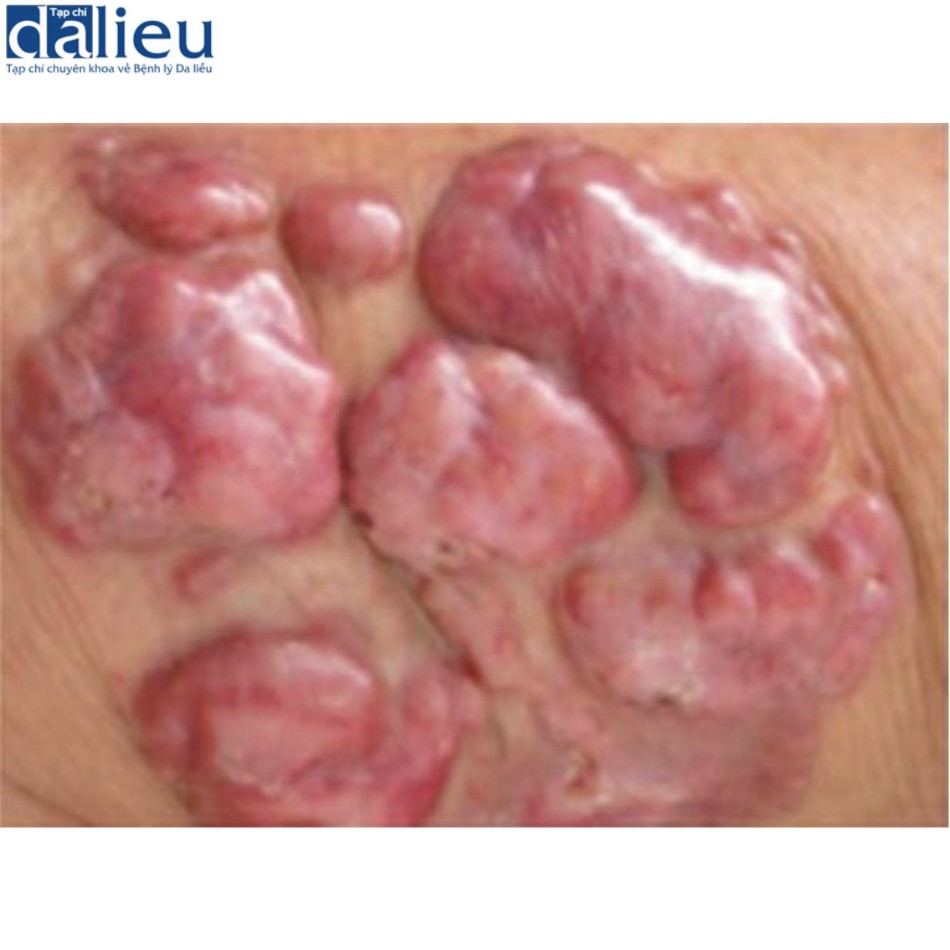
Lobomycosis (còn gọi là lacaziosis hoặc keloidal blastomycosis) là một bệnh nhiễm nấm da mãn tính do Lacazia loboi, bệnh này lưu hành ở các vùng nông thôn ở Nam/Trung Mỹ (Hình 7.8). Biểu hiện lâm sàng là các nốt trên da sau chấn thương hoặc các tổn thương giống sẹo lồi ban đầu biểu hiện dưới dạng mảng, sẩn hoặc nốt đơn lẻ ở các vùng tiếp xúc nhiều sau nhiều năm tiếp xúc và ủ bệnh ban đầu. Việc chẩn đoán phân biệt các tổn thương này với sẹo lồi càng trở nên khó khăn hơn do thực tế là nhiễm nấm được nghi ngờ là một yếu tố góp phần gây bệnh sẹo lồi. Tuy nhiên, chẩn đoán bệnh lobomycosis có thể dễ dàng được thiết lập bằng cách cạo tổn thương và xác định xem nấm và/hoặc các cấu trúc nấm khác (ví dụ: phân bố dạng chuỗi hạt catenular hoặc Rosario) có thể được trực tiếp quan sát dưới kính hiển vi hay không.
7.3.5 Sự giống và khác nhau giữa sẹo phì đại và sẹo lồi
Sẹo phì đại và sẹo lồi đều là sẹo bệnh lý. Tuy nhiên, sẹo lồi khác với sẹo phì đại ở chỗ chúng không bao giờ ngừng phát triển và có tỷ lệ tái phát cao sau khi điều trị. Đặc biệt, tình trạng sẹo lồi kháng trị này khiến các bác sĩ và nhà nghiên cứu bệnh học phải dành nhiều công sức để phân biệt giữa sẹo phì đại và sẹo lồi: hy vọng rằng điều này sẽ dẫn đến các hướng dẫn có thứ tự và hiệu quả để điều trị hai loại sẹo bệnh lý này. Tuy nhiên, những tiến bộ gần đây trong lĩnh vực này đã đảo ngược quan niệm cho rằng sẹo phì đại và sẹo lồi là các loại sẹo khác nhau: thay vào đó, ngày càng có nhiều bằng chứng cho thấy sẹo phì đại và sẹo lồi thực sự là các giai đoạn khác nhau của cùng một rối loạn tăng sinh xơ da. Thực sự có những khác biệt rõ rệt về mặt lâm sàng giữa sẹo phì đại và sẹo lồi cổ điển. Sẹo phì đại thường xuất phát từ một chấn thương xác định, trong khi sẹo lồi có thể phát triển từ những vết thương nhỏ như ‘vết muỗi đốt’, tiêm vaccin hoặc viêm nang lông; trên thực tế, đôi khi chúng dường như xuất hiện mà không có bất kỳ tổn thương da nào. Sẹo phì đại không có vị trí ưa thích cụ thể trên cơ thể, mặc dù chúng được biết là gây co thắt xuyên khớp làm suy yếu chức năng khớp và cần phải phẫu thuật tái cấu trúc. Ngược lại, sẹo lồi xuất hiện ở các vùng cơ thể tiếp xúc với yếu tố cơ học tại chỗ rõ rệt. Sẹo phì đại cũng giới hạn sự phát triển của chúng trong vết thương ban đầu, trong khi sẹo lồi phát triển vượt ra ngoài vết thương ban đầu. Hơn nữa, sẹo phì đại có xu hướng ngừng phát triển dần dần và tỷ lệ tái phát sau phẫu thuật thấp. Ngược lại, sẹo lồi không bao giờ tự thoái triển và thường tái phát sau phẫu thuật (Bảng 7.2).
Các nhà nghiên cứu bệnh học cũng đề xuất một số đặc điểm bệnh lý phân biệt sẹo phì đại với sẹo lồi, cụ thể là α-SMA (lan tỏa trong sẹo phì đại, ít hoặc tập trung trong sẹo lồi), các nốt ở da (có trong sẹo phì đại, không có trong sẹo lồi) và collagen hyalin hóa (có trong sẹo lồi, không có trong sẹo phì đại). Tuy nhiên, nhiều bằng chứng cho thấy những sự khác biệt về bệnh lý này không rõ ràng như người ta từng tin. Đầu tiên, liên quan đến α-SMA, người ta thấy rằng các nốt collagen của một số vết sẹo phì đại không chứa nguyên bào sợi cơ biểu hiện α-SMA, trong khi 45% sẹo lồi biểu hiện nó. Vết nhuộm mạnh và lan tỏa nhất thực sự được thấy trong sẹo lồi nhưng không phải trong sẹo phì đại. Hơn nữa, sẹo bệnh lý có thể biểu hiện cả vết nhuộm α-SMA+ trong các nốt lớp bì (đặc điểm của sẹo phì đại) và lượng lớn collagen hyalin hóa (đặc điểm của sẹo lồi). Những phát hiện này cho thấy rằng vết nhuộm α-SMA thực sự không thể được coi là dấu hiệu bệnh lý của sẹo phì đại.
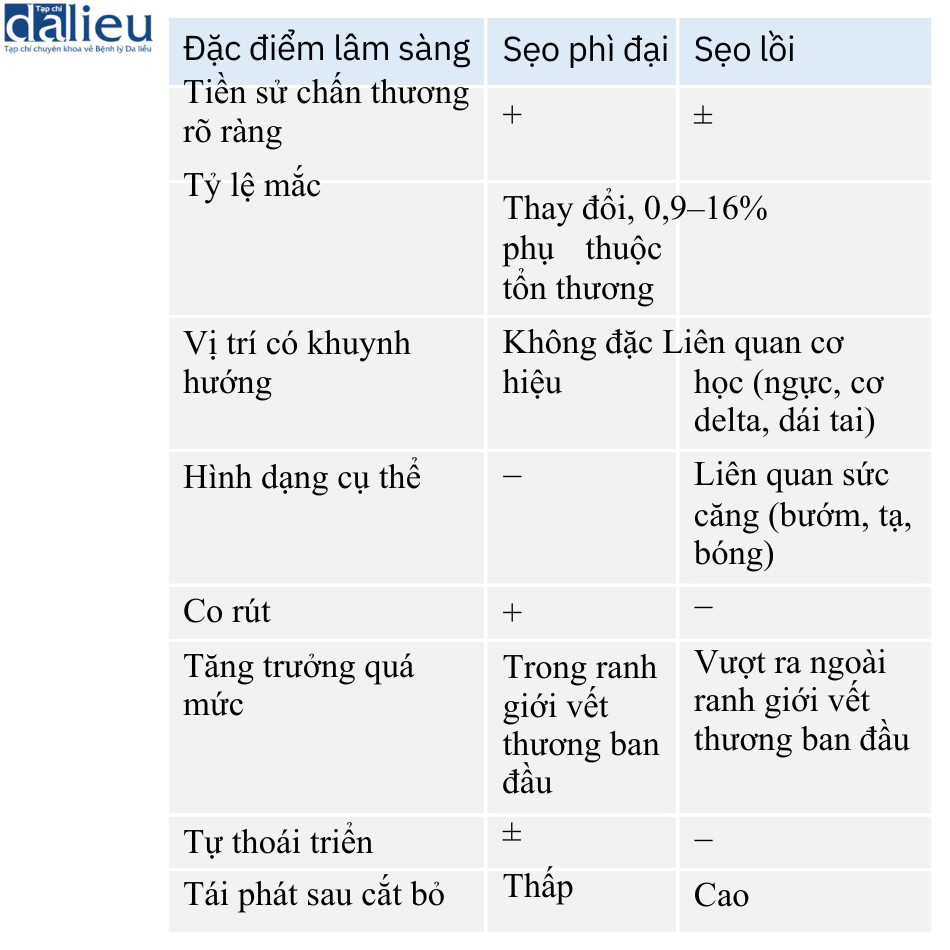
Quan niệm cho rằng collagen hyalin hóa là dấu hiệu bệnh lý của sẹo lồi cũng bị nghi ngờ: Lee chỉ phát hiện ra dấu hiệu chẩn đoán này ở 55% mẫu sẹo lồi của họ. Hơn nữa, trong nhiều trường hợp, các sợi sẹo lồi hyalin hóa có thể biểu hiện các đặc điểm khá khác nhau trong cùng một mẫu sẹo lồi. Do đó, ở trung tâm sẹo lồi, các sợi thường lớn và dày và cho thấy nhuộm ái toan mạnh và thẳng hàng song song với bề mặt biểu mô. Hơn nữa, các sợi xen kẽ collagen mỏng và phân tán thưa thớt. Ngược lại, ở ngoại vi sẹo lồi, các collagen thường không được hyalin hóa và chúng có đường kính mỏng, mật độ thấp và định hướng ngẫu nhiên. Ngoài ra, các sợi xen kẽ collagen bình thường hơn các sợi ở trung tâm.
Đặc biệt quan trọng, cùng một mẫu sẹo lồi cũng có thể có cả collagen hyalin hóa sẹo lồi và các nốt bì được coi là đặc trưng của sẹo phì đại, ví dụ trong Hình 7.9a. Điều thú vị là chúng tôi quan sát thấy trong nhiều trường hợp rằng các tổn thương mơ hồ này biểu hiện sự chuyển đổi không gian từ các đặc điểm sẹo phì đại sang các đặc điểm sẹo lồi. Đầu tiên, như mô tả ở trên, các sợi collagen hyalin hóa chiếm ưu thế ở trung tâm của tổn thương và ngày càng thưa thớt hơn về phía ngoại vi của tổn thương. Ngược lại, trong khi các nốt bì tăng dần kích thước về phía ngoại vi của tổn thương và trở nên kém phân định rõ ràng hơn cho đến khi chúng trở thành đặc điểm nổi bật (Hình 7.9a). Thứ hai, bản thân các nốt bì thường gồm các tập hợp nguyên bào sợi khu trú chứa các sợi collagen định hướng ngẫu nhiên. Tuy nhiên, các nốt cũng chứa các sợi hyalin hóa có hình dạng thay đổi khi chúng ta chuyển góc nhìn từ gốc sang đỉnh của nốt. Do đó, các sợi hyalin hóa ở gốc nốt ngắn, lượn sóng, định hướng ngẫu nhiên và không ưa eosin. Ngược lại, các sợi hyalin hóa ở đỉnh nốt dài, thẳng, định hướng song song với lớp biểu bì và có tính ưa eosin mạnh (Hình 7.9b).
Những phát hiện này khiến chúng tôi đưa ra giả thuyết rằng sẹo phì đại và sẹo lồi là các giai đoạn kế tiếp của cùng một rối loạn tăng sinh xơ da (Hình 7.9). Có thể kết quả của vết thương (tức là sẹo phì đại hoặc sẹo lồi) phụ thuộc vào mức độ viêm được tạo ra. Điều này được hỗ trợ bởi thực tế là sẹo lồi có nhiều tế bào viêm hoạt động hơn (ví dụ: đại thực bào) và tỷ lệ CD4/CD8 cao hơn da bình thường. Quan niệm này cũng được hỗ trợ bởi thực tế là tình trạng viêm rõ rệt cũng liên quan đến một đặc điểm đặc biệt nguy hiểm của sẹo lồi, cụ thể là chúng phát triển vào mô bình thường xung quanh, vì viền ngoài của chúng thường biểu hiện tình trạng viêm lớn hơn nhiều (cũng như ban đỏ và ngứa) so với lõi của chúng.
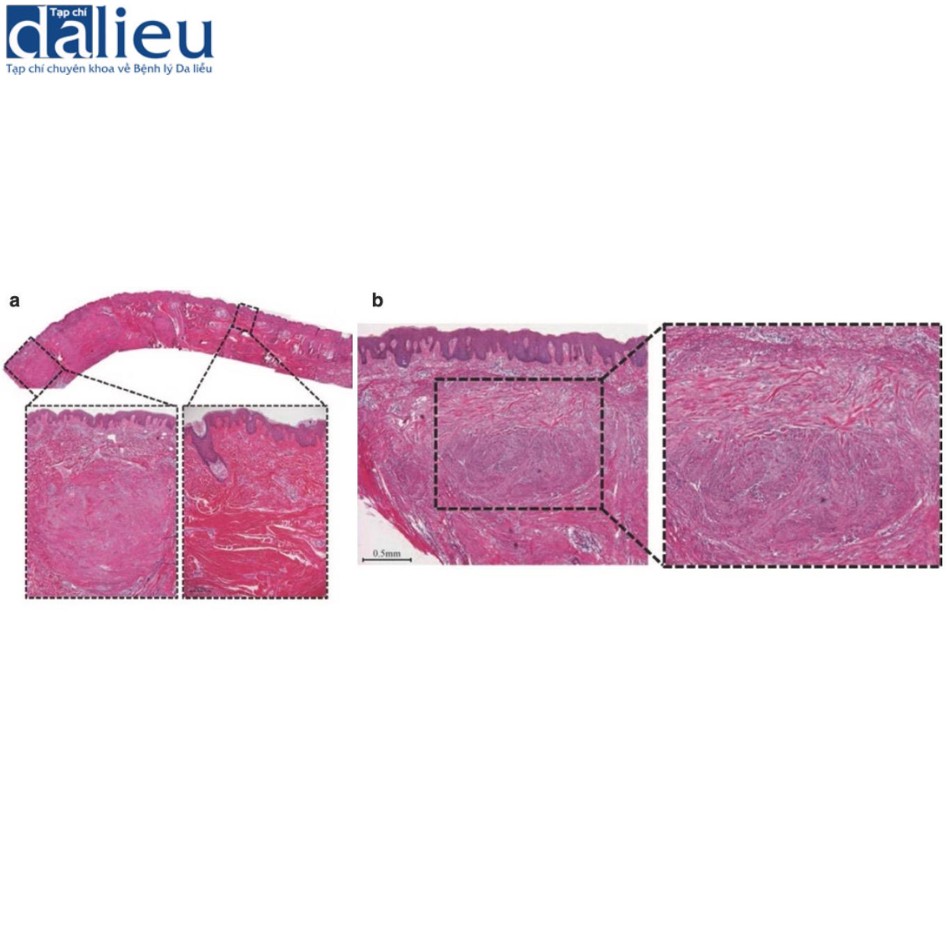
(a) Cùng một mẫu sẹo lồi có thể mang cả collagen sẹo lồi và các nốt bì. Tấm nhuộm HE cho thấy mặt cắt ngang của một tổn thương được cắt bỏ từ một bệnh nhân sẹo lồi. Trung tâm của tổn thương nằm ở giữa và bên phải của phần cắt, trong khi ngoại vi của tổn thương nằm ở bên trái. Lớp bì lưới của sẹo lồi này mở rộng rất nhiều, như thường lệ đối với sẹo lồi. Collagen sẹo lồi hyalin hóa chiếm ưu thế ở trung tâm của tổn thương và ngày càng thưa thớt hơn về phía ngoại vi của tổn thương. Ngược lại, các nốt bì cho thấy kích thước và số lượng tế bào của nốt tăng lên, đường viền nốt kém rõ ràng hơn và số lượng và độ dày của collagen giảm ở ngoại vi của mẫu.
(b) Các nốt bì, bao gồm các tập hợp nguyên bào sợi tập trung và các sợi collagen định hướng ngẫu nhiên, có collagen hyalin hóa nằm rải rác ở phía trên của chúng. Bản chất của các sợi collagen hyalin hóa này thay đổi tùy theo vị trí: ở gốc nốt, các sợi ngắn, lượn sóng và có hướng ngẫu nhiên so với lớp biểu bì. Chúng cũng không ưa eosin. Ngược lại, các sợi ở phía trên nốt dài, thẳng và nằm song song với lớp biểu bì. Chúng cũng ưa eosin mạnh.
7.4 Loét ác tính
Loét ác tính phát sinh trong các vết sẹo có từ trước được gọi là loét Marjolin. Chúng là thứ phát sau loét mãn tính ở các vết sẹo (Hình 7.10). Các yếu tố nguy cơ liên quan đến sẹo đối với loét ác tính sau sẹo bao gồm sẹo dễ vỡ làm tăng nguy cơ chấn thương và hình dạng không đều khiến việc làm sạch sẹo trở nên khó khăn và làm tăng nguy cơ loét và nhiễm trùng. Thời gian tiềm ẩn giữa vết thương ban đầu và tình trạng ác tính thay đổi từ ít nhất là 6 tuần đến dài tới 70 năm: thời gian tiềm ẩn trung bình là khoảng 35 năm. Sự chuyển đổi ác tính như vậy xảy ra ở gần 2% sẹo bỏng. Sự tắc nghẽn bạch huyết trong sẹo có thể làm chậm phần nào quá trình phát tán của các tế bào khối u, do đó ức chế di căn tại chỗ và toàn thân. Tuy nhiên, nếu các tế bào ác tính trong loét Marjolin đến các mạch bạch huyết, khối u sẽ lan rộng nhanh chóng.
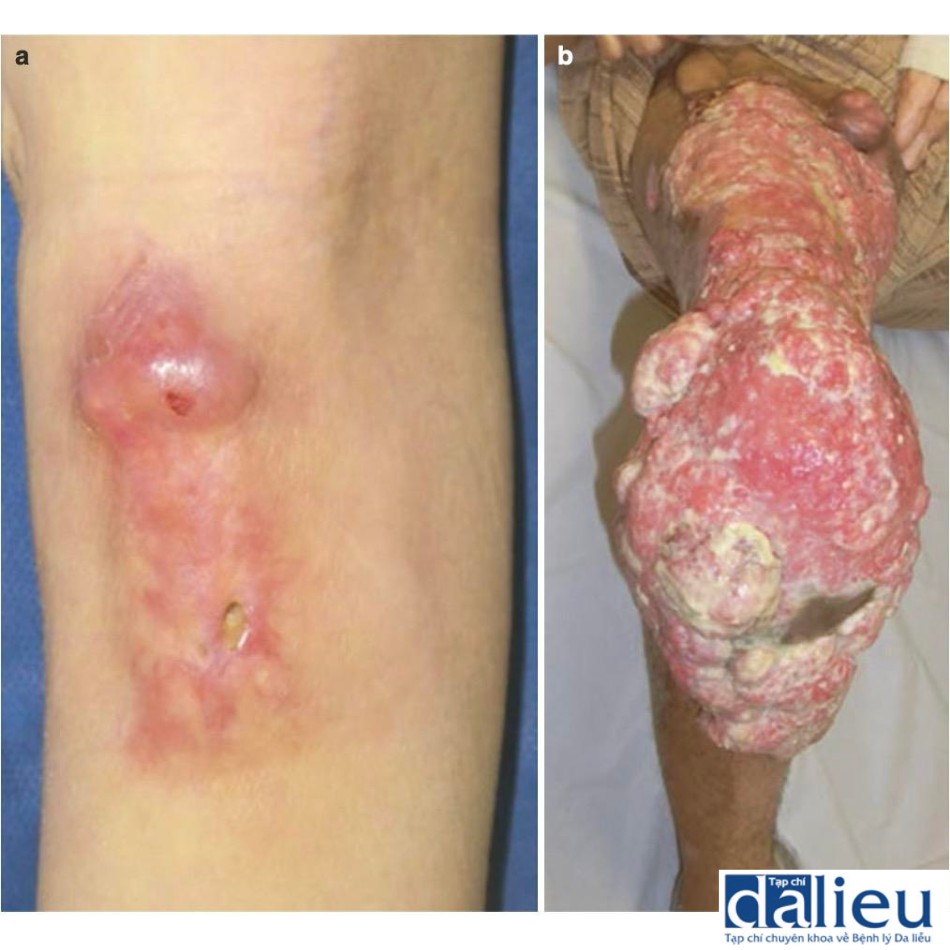
(a) Loét Marjolin sau bỏng, phát triển từ một vết sẹo ở chi dưới bên phải.
(b) Loét Marjolin, phát triển từ các vết sẹo bỏng rộng ở chân phải
Các vết loét mãn tính phát sinh trước đó hơn 6 tuần nên được sinh thiết để xác định xem loét Marjolin đã phát triển hay chưa. Chẩn đoán phụ thuộc vào tiền sử sẹo và loét cũng như các kiểm tra lâm sàng và xét nghiệm, như sau:
- Tiền sử: Bệnh nhân có loét mãn tính ở rìa sẹo trong hơn 3 tháng.
- Bộ ba triệu chứng: Hình thành nốt, cứng và loét.
- Dấu hiệu lâm sàng: Mô hạt quá mức, rìa vết thương cuộn/lộn ra ngoài, chảy máu khi tiếp xúc, mủ có mùi hôi, đóng mài, tăng kích thước, và đau.
- Phân loại và giai đoạn: Loét Marjolin có thể được xếp hạng dựa trên tần suất tế bào biệt hóa. Độ I = >75%, Độ II = 75–25% và Độ III = <25%. Độ cao hơn liên quan đến nguy cơ di căn cao hơn và tiên lượng xấu hơn.
- Các dạng hình thái: Dạng phổ biến là biến thể phẳng, chắc, thâm nhiễm, loét với sự biệt hóa kém. Dạng ít gặp hơn là dạng nhú, lồi ra ngoài, được phân biệt rõ và liên quan đến tiên lượng tốt hơn.
- Các loại bệnh lý: Khối u thường thấy nhất trong loét Marjolin là ung thư biểu mô tế bào vảy (71%), tiếp theo là ung thư biểu mô tế bào đáy (12%), u tế bào hắc tố (6%), sarcoma (5%) và các khối u hiếm gặp khác như u xơ, u mỡ và DFSP.
7.5 Tóm tắt
Với giai đoạn nghiên cứu về sẹo hiện nay, các loại sẹo thường thấy trong phòng khám có thể được chia thành sẹo bình thường, sẹo teo, sẹo phì đại và sẹo lồi. Các biến số lâm sàng khách quan và chủ quan trong các đo lường sẹo và công cụ khác nhau có thể được sử dụng để chẩn đoán sẹo và để xác định phương pháp điều trị đảm bảo kết quả tốt nhất về mặt hình dạng và chức năng tại chỗ cũng như tránh các biến chứng như loét ác tính. Tuy nhiên, sinh thiết là cách tốt nhất để đưa ra chẩn đoán xác định. Ở cấp độ bệnh lý, sự kiện tích tụ collagen lớp bì do quá trình lành thương quá mức là đặc điểm chung của sẹo da. Tuy nhiên, sẹo cũng có thể khác nhau về thành phần tế bào và ECM, từ đó dẫn đến các đặc điểm bệnh lý riêng biệt. Ví dụ, các sợi hyalin hóa thường thấy ở sẹo lồi, trong khi các nốt bì thường thấy ở sẹo phì đại. Tuy nhiên, trong khi các đặc điểm này từng được cho là đặc trưng của sẹo lồi và sẹo phì đại, thì ngày càng có nhiều bằng chứng cho thấy sự khác biệt này không rõ ràng như người ta từng tin. Đặc biệt, cùng một mẫu sẹo bệnh lý có thể mang cả sợi collagen hyalin hóa và các nốt bì. Hơn nữa, vì các mẫu không rõ ràng như vậy thường biểu hiện sự chuyển đổi không gian ở các đặc điểm này, chúng tôi đề xuất rằng sẹo phì đại và sẹo lồi có thể là các giai đoạn khác nhau trong cùng một bệnh tăng sinh xơ hóa mô mềm.
Hiện tại, không có ngưỡng lâm sàng hoặc bệnh lý hoặc các dấu hiệu xác định khác cho phép bác sĩ phân biệt giữa các loại sẹo khác nhau với sự tự tin hoàn toàn, đặc biệt là ở giai đoạn đầu của quá trình lành thương. Tình trạng này có thể phức tạp hơn nữa do thực tế là một số bệnh nhân có nhiều hơn một loại sẹo cùng lúc, mỗi loại đều biểu hiện các mức độ viêm tại chỗ khác nhau (Hình 7.11). Chúng tôi khuyên cáo nên thực hiện sinh thiết nếu có bất kỳ nhầm lẫn nào. Hơn nữa, chúng tôi nhấn mạnh rằng sẹo, đặc biệt là những loại có biến chứng, nên được chẩn đoán với mục đích xác định liệu pháp cải thiện tốt nhất các khiếm khuyết về chức năng và thẩm mỹ và do đó mang lại chất lượng cuộc sống tốt hơn. Do đó, chẩn đoán và điều trị sẹo không chỉ dựa trên những gì khả thi theo quan điểm của bác sĩ mà còn dựa trên sở thích của bệnh nhân.
Cho đến nay, các nhà nghiên cứu đã nỗ lực đáng kể trong việc xác định các biến số và dấu hiệu lâm sàng và bệnh lý giúp xác định liệu pháp tốt nhất cho từng loại sẹo và bệnh nhân. Tuy nhiên, các biến số và dấu hiệu này có những hạn chế về chẩn đoán. Để cải thiện tình trạng này, cần có thêm nghiên cứu làm sáng tỏ nguyên nhân phân tử của các loại sẹo khác nhau. Nghiên cứu này có thể tiết lộ các dấu ấn sinh học trong phòng thí nghiệm giúp cải thiện chẩn đoán sẹo và/hoặc có thể đóng vai trò là mục tiêu cho dược phẩm điều trị. Một hướng đi đầy hứa hẹn trong lĩnh vực này là vai trò của yếu tố cơ học tại chỗ trong quá trình hình thành sẹo. Tiến bộ hơn nữa trong việc hiểu biết của chúng ta về cơ chế cơ sinh học thúc đẩy các rối loạn tăng sinh xơ mô mềm có thể thúc đẩy việc khám phá ra các chỉ dấu trong phòng thí nghiệm hỗ trợ chẩn đoán sẹo và/hoặc có thể được nhắm mục tiêu trong các can thiệp cơ học trị liệu mới hoạt động ở cấp độ phân tử, tế bào hoặc mô để tạo điều kiện cho sự lành thương bình thường và ngăn ngừa, cải thiện hoặc đảo ngược quá trình hình thành hoặc tiến triển của sẹo bệnh lý.
Tài liệu tham khảo
- Huang C, Murphy GF, Akaishi S, Ogawa R. Keloids and hypertro- phic scars: update and future directions. Plast Reconstr Surg Glob Open. 2013;1(4):e25.
- Huang C, Ogawa R. The link between hypertension and patho- logical scarring: does hypertension cause or promote keloid and hypertrophic scar pathogenesis? Wound Repair Regen. 2014;22(4):462–6.
- Huang C, Liu L, You Z, Wang B, Du Y, Ogawa R. Keloid progression: a stiffness gap hypothesis. Int Wound J. 2017;14(5):764–71.
- Huang C, Liu L, You Z, Zhao Y, Dong J, Du Y, Ogawa R. Endothelial Dysfunction and mechanobiology in pathological cutaneous scarring: lessons learned from soft tissue fibrosis. Br J Dermatol. 2017;177(5):1248–55.
- Huang C, Ogawa R. Roles of lipid metabolism in keloid development. Lipids Health Dis. 2013;12:60.
- Huang C, Akaishi S, Ogawa R. Mechanosignaling pathways in cutaneous scarring. Arch Dermatol Res. 2012;304(8):589–97.
- Smith GM, Tompkins DM, Bigelow ME, Antoon AY. Burn-induced cosmetic disfigurement: can it be measured reliably? J Burn Care Rehabil. 1988;9(4):371–5.
- Sullivan T, Smith J, Kermode J, McIver E, Courtemanche DJ. Rating the burn scar. J Burn Care Rehabil. 1990;11(3):256–60.
- Yeong EK, Mann R, Engrav LH, Goldberg M, Cain V, Costa B, Moore M, Nakamura D, Lee J. Improved burn scar assess- ment with use of a new scar-rating scale. J Burn Care Rehabil. 1997;18(4):353–5.
- Beausang E, Floyd H, Dunn KW, Orton CI, Ferguson MW. A new quantitative scale for clinical scar assessment. Plast Reconstr Surg. 1998;102(6):1954–61.
- Crowe JM, Simpson K, Johnson W, Allen J. Reliability of photographic analysis in determining change in scar appearance. J Burn Care Rehabil. 1998;19(2):183–6.
- Draaijers LJ, Tempelman FR, Botman YA, Tuinebreijer WE, Middelkoop E, Kreis RW, van Zuijlen PP. The patient and observer scar assessment scale: a reliable and feasible tool for scar evalua- tion. Plast Reconstr Surg. 2004;113(7):1960–5.
- Masters M, McMahon M, Svens B. Reliability testing of a new scar assessment tool, Matching Assessment of Scars and Photographs (MAPS). J Burn Care Rehabil. 2005;26(3):273–84.
- Singer AJ, Arora B, Dagum A, Valentine S, Hollander JE. Development and validation of a novel scar evaluation scale. Plast Reconstr Surg. 2007;120(7):1892–7.
- Hultman CS, Friedstat JS, Edkins RE, Cairns BA, Meyer AA. Laser resurfacing and remodeling of hypertrophic burn scars: the results of a large, prospective, before-after cohort study, with longterm follow-up. Ann Surg. 2014;260(3):519–29.
- Hultman CS, Edkins RE, Lee CN, Calvert CT, Cairns BA. Shine on: review of laser- and lightbased therapies for the treatment of burn scars. Dermatol Res Pract. 2012;2012:243651.
- Nguyen TA, Feldstein SI, Shumaker PR, Krakowski AC. A review of scar assessment scales. Semin Cutan Med Surg. 2015;34(1):28–36.
- Idriss N, Maibach HI. Scar assessment scales: a dermatologic overview. Skin Res Technol. 2009;15(1):1–5.
- Ogawa R, Akaishi S, Akita S, Okabe K, Shimizu T, Sunaga A, Tosa Y, Nagao M, Yamawaki S. JSW Scar Scale Working Group. Japan Scar Workshop (JSW) Scar Scale 2015. Available online at. http:// www.scarkeloid.com/en/index.html.
- Ogawa R. Keloid and hypertrophic scars are the result of chronic inflammation in the reticular dermis. Int J Mol Sci. 2017;18(3):606.
- Zhu X, Zhuo S, Zheng L, Lu K, Jiang X, Chen J, Lin B. Quantified characterization of human cutaneous normal scar using multiphoton microscopy. J Biophotonics. 2010;3(1-2):108–16.
- Amadeu TP, Braune AS, Porto LC, Desmoulière A, Costa AM. Fibrillin-1 and elastin are differentially expressed in hypertrophic scars and keloids. Wound Repair Regen. 2004;12(2):169– 74.
- Goodman GJ. Postacne scarring: a review of its pathophysiology and treatment. Dermatol Surg. 2000;26(9):857–71.
- Zhu X, Zhuo S, Zheng L, Jiang X, Chen J, Lin B. Quantification of scar margin in keloid different from atrophic scar by multiphoton microscopic imaging. Scanning. 2011;33(4):195–200.
- Tanriverdi-Akhisaroglu S, Menderes A, Oktay G. Matrix metallo- proteinase-2 and -9 activities in human keloids, hypertrophic and atrophic scars: a pilot study. Cell Biochem Funct. 2009;27(2):81–7.
- Gillard JA, Reed MW, Buttle D, Cross SS, Brown NJ. Matrix metalloproteinase activity and immunohistochemical profile of matrix metalloproteinase-2 and -9 and tissue inhibitor of metallo- proteinase-1 during human dermal wound healing. Wound Repair Regen. 2004;12(3):295– 304
- Ehrlich HP, Desmoulière A, Diegelmann RF, Cohen IK, Compton CC, Garner WL, Kapanci Y, Gabbiani G. Morphological and immunochemical differences between keloid and hypertrophic scar. Am J Pathol. 1994;145(1):105– 13.
- Clark JA, Turner ML, Howard L, Stanescu H, Kleta R, Kopp JB. Description of familial keloids in five pedigrees: evidence for autosomal dominant inheritance and phenotypic heterogeneity. BMC Dermatol. 2009;9:8.
- Machesney M, Tidman N, Waseem A, Kirby L, Leigh I. Activated keratinocytes in the epidermis of hypertrophic scars. Am J Pathol. 1998;152(5):1133–41.
- Niessen FB, Schalkwijk J, Vos H, Timens W. Hypertrophic scar formation is associated with an increased number of epidermal Langerhans cells. J Pathol. 2004;202(1):121–9.
- Niessen FB, Andriessen MP, Schalkwijk J, Visser L, Timens W. Keratinocyte-derived growth factors play a role in the formation of hypertrophic scars. J Pathol. 2001;194(2):207–16.
- Rossiello L, D’Andrea F, Grella R, Signoriello G, Abbondanza C, De Rosa C, Prudente M, Morlando M, Rossiello R. Differential expression of cyclooxygenases in hypertrophic scar and keloid tis- sues. Wound Repair Regen. 2009;17(5):750– 7.
- Mustoe TA, Gurjala A. The role of the epidermis and the mecha- nism of action of occlusive dressings in scarring. Wound Repair Regen. 2011;19(Suppl 1):s16–21.
- Rockwell WB, Cohen IK, Ehrlich HP. Keloids and hyper- trophic scars: a comprehensive review. Plast Reconstr Surg. 1989;84(5):827–37.
- Friedman DW, Boyd CD, Mackenzie JW, Norton P, Olson RM, Deak SB. Regulation of collagen gene expression in keloids and hypertrophic scars. J Surg Res. 1993;55(2):214–22.
- Bertheim U, Hellström S. The distribution of hyaluronan in human skin and mature, hypertrophic and keloid scars. Br J Plast Surg. 1994;47:483–9.
- Nagata H, Ueki H, Fibronectin MT. Localization in normal human skin, granulation tissue, hypertrophic scar, mature scar, progres- sive systemic sclerotic skin, and other fibrosing dermatoses. Arch Dermatol. 1985;121:995–9.
- Louw L. Keloids in rural black South Africans. Part 1: general overview and essential fatty acid hypotheses for keloid forma- tion and prevention. Prostaglandins Leukot Essent Fatty Acids. 2000;63(5):237–45.
- Sun LM, Wang KH, Lee YC. Keloid incidence in Asian peo- ple and its comorbidity with other fibrosis-related diseases: a nationwide populationbased study. Arch Dermatol Res. 2014;306(9):803–8.
- Ogawa R, Okai K, Tokumura F, Mori K, Ohmori Y, Huang C, Hyakusoku H, Akaishi S. The relationship between skin stretch- ing/contraction and pathologic scarring: the important role of mechanical forces in keloid generation. Wound Repair Regen. 2012;20(2):149–57.
- Ogawa R, Akaishi S, Huang C, Dohi T, Aoki M, Omori Y, Koike S, Kobe K, Akimoto M, Hyakusoku H. Clinical applications of basic research that shows reducing skin tension could prevent and treat abnormal scarring: the importance of facial/subcutaneous tensile reduction sutures and flap surgery for keloid and hypertrophic scar reconstruction. J Nippon Med Sch. 2011;78:68–76.
- Huang C, Miyazaki K, Akaishi S, Watanabe A, Hyakusoku H, Ogawa R. Biological effects of cellular stretch on human dermal fibroblasts. J Plast Reconstr Aesthet Surg. 2013;66(12):e351– 61.
- Bagabir R, Byers RJ, Chaudhry IH, et al. Sitespecific immu- nophenotyping of keloid disease demonstrates immune upregu- lation and the presence of lymphoid aggregates. Br J Dermatol. 2012;167:1053–66.
- Ong CT, Khoo YT, Mukhopadhyay A, et al. Comparative proteomic analysis between normal skin and keloid scar. Br J Dermatol. 2010;162:1302–15.
- Khoo YT, Ong CT, Mukhopadhyay A, et al. Upregulation of secre- tory connective tissue growth factor (CTGF) in keratinocyte- fibroblast coculture contributes to keloid pathogenesis. J Cell Physiol. 2006;208:336–43.
- Nakaoka H, Miyauchi S, Miki Y. Proliferating activity of dermal fibroblasts in keloids and hypertrophic scars. Acta Derm Venereol. 1995;75:102–4.
- Uitto J, Perejda AJ, Abergel RP, et al. Altered steady-state ratio of type I/III procollagen mRNAs correlates with selectively increased type I procollagen biosynthesis in cultured keloid fibroblasts. Proc Natl Acad Sci U S A. 1985;82:5935–9.
- Kischer CW, Hendrix MJ. Fibronectin (FN) in hypertrophic scars and keloids. Cell Tissue Res. 1983;231:29–37.
- Ogawa R, Akaishi S, Hyakusoku H. Differential and exclusive diagnosis of diseases that resemble keloids and hypertrophic scars. Ann Plast Surg. 2009;62(6):660–4.
- James WD, Berger TG, Butler DF, Tuffanelli DL. Nodular (keloi- dal) scleroderma. J Am Acad Dermatol. 1984;11(6):1111–4.
- Sabater-Marco V, Pérez-Vallés A, BerzalCantalejo F, Rodriguez- Serna M, Martinez-Diaz F, Martorell-Cebollada M. Sclerosing dermatofibrosarcoma protuberans (DFSP): an unusual variant with focus on the histopathologic differential diagnosis. Int J Dermatol. 2006;45(1):59–62.
- Martin L, Combemale P, Dupin M, Chouvet B, Kanitakis J, Bouyssou-Gauthier ML, Dubreuil G, Claudy A, Grimand PS. The atrophic variant of dermatofibrosarcoma protuberans in childhood: a report of six cases. Br J Dermatol. 1998;139(4):719–25.
- Kamath NV, Ormsby A, Bergfeld WF, House NS. A light micro- scopic and immunohistochemical evaluation of scars. J Cutan Pathol. 2002;29(1):27–32.
- Aiba S, Tabata N, Ishii H, Ootani H, Tagami H. Dermatofibrosarcoma protuberans is a unique fibrohistiocytic tumour expressing CD34. Br J Dermatol. 1992;127(2):79–84.
- Altman DA, Nickoloff BJ, Fivenson DP. Differential expression of factor XIIIa and CD34 in cutaneous mesenchymal tumors. J Cutan Pathol. 1993;20(2):154–8.
- Burns RA, Roy JS, Woods C, Padhye AA, Warnock DW. Report of the first human case of lobomycosis in the United States. J Clin Microbiol. 2000;38(3):1283–5.
- Paniz-Mondolfi AE, Reyes Jaimes O, Dávila Jones L. Lobomycosis in Venezuela. Int J Dermatol. 2007;46(2):180–5. 121
- Okada E, Maruyama Y. Are keloids and hypertrophic scars caused by fungal infection? Plast Reconstr Surg. 2007;120(3):814–5.
- Francesconi VA, Klein AP, Santos AP, Ramasawmy R, Francesconi F. Lobomycosis: epidemiology, clinical presentation, and management options. Ther Clin Risk Manag. 2014;10:851–60.
- Moshref SS, Mufti ST. Keloid and hypertrophic scars: comparative histopathological and immunohistochemical study. JKAU: Med Sci. 2010;17(3):3–22.
- Lee JY, Yang CC, Chao SC, Wong TW. Histopathological differen- tial diagnosis of keloid and hypertrophic scar. Am J Dermatopathol. 2004;26(5):379–84.
- Huang C, Akaishi S, Hyakusoku H, Ogawa R. Are keloid and hypertrophic scar different forms of the same disorder? A fibrop- roliferative skin disorder hypothesis based on keloid findings. Int Wound J. 2014;11(5):517–22.
- Boyce DE, Ciampolini J, Ruge F, Murison MS, Harding KG. Inflammatory-cell subpopulations in keloid scars. Br J Plast Surg. 2001;54:511–6.
- Mohammadi AA, Seyed Jafari SM, Hosseinzadeh M. Early Marjolin’s ulcer after minimal superficial burn. Iran J Med Sci. 2013;38:69–70.
- Aydoğdu E, Yildirim S, Aköz T. Is surgery an effective and adequate treatment in advanced Marjolin’s ulcer? Burns. 2005;31:421–31.
- Copcu E. Marjolin’s ulcer: a preventable complication of burns? Plast Reconstr Surg. 2009;124:156e–64e.
- Gul U, Kilic A. Squamous cell carcinoma developing on burn scar. Ann Plast Surg. 2006;56(4):406–8.
- Pekarek B, Buck S, Osher LA. Comprehensive review on Marjolin’s ulcers: diagnosis and treatment. J Am Col Certif Wound Spec. 2011;3(3):60–4.
- Ogawa B, Chen M, Margolis J, Schiller FJ, Schnall SB. Marjolin’s ulcer arising at the elbow: a case report and literature review. Hand (N Y). 2006;1(2):89–93.
- Smith J, Mello LF, Nogueira Neto NC, Meohas W, Pinto LW, Campos VA, Barcellos MG, Fiod NJ, Rezende JF, Cabral CE. Malignancy in chronic ulcers and scars of the leg (Marjolin’s ulcer): a study of 21 patients. Skeletal Radiol. 2001;30(6):331–7.
- Kowal-Vern A, Criswell BK. Burn scar neoplasms: a literature review and statistical analysis. Burns. 2005;31:403–13.
- Huang C, Ogawa R. Fibroproliferative disorders and their mecha- nobiology. Connect Tissue Res. 2012;53(3):187–96.
- Huang C, Holfeld J, Schaden W, Orgill D, Ogawa R. Mechanotherapy: revisiting physical therapy and recruiting mechanobiology for a new era in medicine. Trends Mol Med. 2013;19(9):555–64