Tác giả: Adriana C. Panayi, Chanan Reitblat và Dennis P. Orgill
Dịch: Bác sĩ Trương Tấn Minh Vũ.
Để tải bài viết Sự lành vết thương và hình thành sẹo pdf mời các bạn click vào link ở đây.
1. Giới thiệu
Từ lúc bắt đầu của con người cho đến ngày nay, chấn thương vẫn là một nguyên nhân chính gây ra tàn tật và tử vong. Ngay cả gần hơn như cuộc Nội chiến ở Hoa Kỳ, có tới 24% trường hợp cụt chi trên và 88% trường hợp cụt ngay dưới hông dẫn đến tử vong [1]. Tuy nhiên, trong hơn 150 năm qua, đã có những tiến bộ lớn trong cả việc hiểu biết và điều trị vết thương, dẫn đến việc ít cắt cụt chi hơn và giảm đáng kể tỷ lệ tử vong [2,3]. Bất chấp những tiến bộ này, những vết thương mãn tính và sẹo để lại sau chấn thương vẫn tiếp tục tàn phá thể chất và tinh thần của hàng triệu người trên thế giới [4, 5]. Tăng cường hiểu biết về các cơ chế tế bào và phân tử nền tảng của việc chữa lành vết thương hứa hẹn cải thiện cuộc sống của những người này và thúc đẩy sự phát triển của các liệu pháp mới. Theo đó, chúng ta sẽ tập trung vào việc tìm hiểu đáp ứng của động vật có vú đối với chấn thương, các cơ chế cơ bản của sự lành thương, các yếu tố tại chỗ và toàn thân ảnh hưởng đến sự lành thương, và những tiến bộ gần đây trong việc quản lý các vết thương mãn tính và sẹo.
2. Đáp ứng của động vật có vú đối với chấn thương
“Sự lành thương không phải là khoa học, mà là nghệ thuật của tự nhiên” —W.H.
Auden [6].
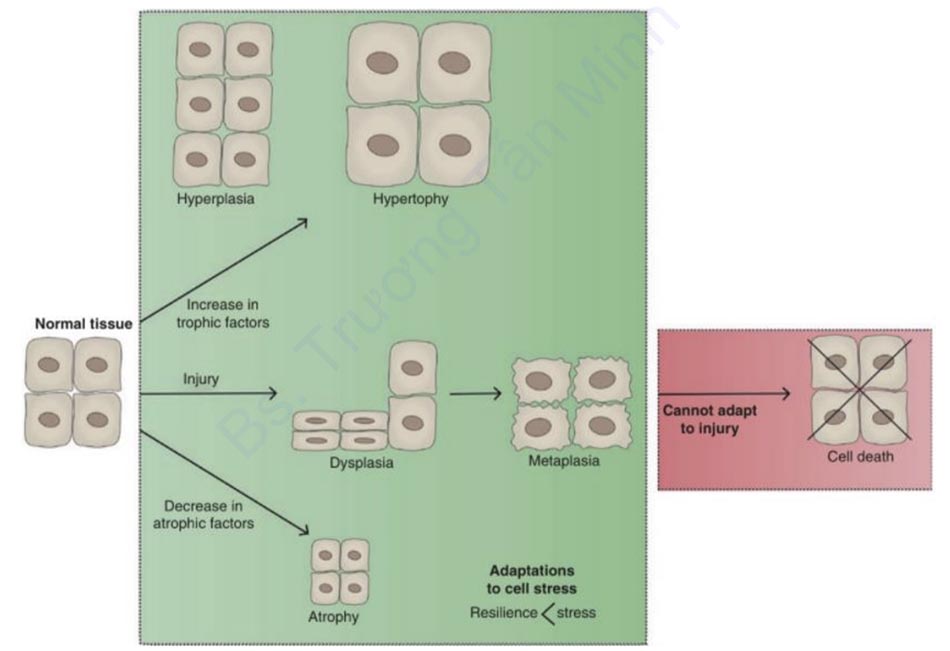
2.1 Các khái niệm cơ bản trong Cân bằng nội môi (Homeostasis), Thích nghi tăng trưởng (Growth Adaptation) và Chấn thương (Injury)
Sự tồn tại của một cơ thể sống phụ thuộc vào khả năng duy trì môi trường bên trong
ổn định, được gọi là cân bằng nội môi. Khi cân bằng nội môi bị xáo trộn bởi những thay
đổi môi trường, còn gọi là “yếu tố gây stress”, các hệ thống sinh học phức tạp bên trong cơ thể sinh vật hoạt động cùng lúc để thiết lập lại trạng thái cân bằng thông qua quá trình
thích nghi tăng trưởng [7].
Là một đáp ứng điều hòa nội môi, sự thích nghi tăng trưởng phụ thuộc vào loại yếu
tố gây stress, mức độ và loại tế bào, mô hoặc cơ quan bị ảnh hưởng. Lấy ví dụ, đáp ứng
của cơ xương với sự căng cơ học trong rèn luyện sức mạnh. Khi sự căng cơ học tăng lên,
các tế bào cơ phản ứng bằng cách tăng số lượng protein co bóp, myofibrils, và dự trữ
năng lượng dẫn đến sự phát triển tổng thể về kích thước tế bào được gọi là phì đại
(hypertrophy) [8]. Tác động tổng hợp của phì đại tế bào có thể được nhìn thấy ở cấp độ
mô vì bụng cơ nở ra và phù hợp hơn để xử lý các tải trọng cơ học nặng hơn. Điều này trái
ngược với tăng sản (hyperplasia), quá trình mà số lượng tế bào tăng lên thông qua cảm
ứng tế bào gốc để đáp ứng với sự gia tăng stress. Một ví dụ điển hình là tăng sản gan để
bù đắp cho lượng tế bào bị mất đi sau khi cắt bỏ hoặc hoại tử gan [9]. Tuy nhiên, đáp ứng
đối với sự gia tăng stress không phải là chỉ một trong hai, như ở mô đệm tử cung trải qua
cả quá trình phì đại và tăng sản để đáp ứng với các kích thích cơ học và nội tiết tố để có
thể thích nghi tốt hơn với thai nhi đang phát triển.
Ngược lại với các quá trình trên, các mô bị giảm stress sẽ giảm kích thước, hoặc
teo đi (atrophy), do không sử dụng hoặc rút các yếu tố dinh dưỡng như oxy, chất dinh
dưỡng và kích thích nội tiết tố. Cơ chế của teo bao gồm giảm kích thước hoặc số lượng
tế bào. Quá trình trước đây xảy ra thông qua autophagy (tiếng Hy Lạp cổ có nghĩa là “tự
ăn”), trong đó các thành phần tế bào chất bị phân hủy và tái chế bằng enzym trong
lysosome, cũng như con đường ubiquitin-proteosome nhắm vào các protein tồn tại trong
thời gian ngắn (và thường bị tổn hại) để phá hủy [10]. Mặt khác, số lượng tế bào giảm có
thể đạt được do chết tế bào theo chương trình được gọi là apoptosis hoặc sự phá hủy hỗn
loạn của các nhóm tế bào lớn để đáp ứng với tổn thương như thấy trong hoại tử (necrosis).
Những thay đổi bên ngoài về stress cơ học có thể dẫn đến những thay đổi về kích thước hoặc số lượng tế bào, trong khi tiếp xúc với môi trường nhất định có thể gây ra chuyển sản (metaplasia), một sự biến đổi có thể đảo ngược của một loại tế bào đã biệt hóa thành một loại khác phù hợp hơn để đáp ứng sự tiếp xúc này. Các dạng chuyển sản phổ biến nhất liên quan đến những thay đổi trong biểu mô bề mặt. Một ví dụ điển hình là sự thay đổi lớp niêm mạc của thực quản dưới trong tình trạng viêm trào ngược thực quản dai dẳng, được gọi là thực quản Barrett. Lớp niêm mạc điển hình của thực quản là biểu mô vảy có thể bong ra mà không làm hỏng các lớp bên dưới và do đó, lý tưởng để vượt qua ma sát cơ học của khối thức ăn. Tuy nhiên, khi bị viêm mãn tính do trào ngược axit dai dẳng, các tế bào gốc biểu mô được lập trình lại thành các cột tế bào tiết chất nhầy giống như tế bào được thấy ở ruột non, có khả năng chịu đựng tốt hơn trong môi trường axit. Mặc dù điều này có thể có lợi trong ngắn hạn, nhưng quá trình tái lập trình tế bào này có thể hoạt động không hiệu quả nếu sự tiếp xúc kích thích không được giải quyết. Theo thời gian, sự phát triển và tăng sinh của tế bào trở nên rối loạn, được gọi là loạn sản (dysplasia), hình thành các tổn thương tiền ác tính với tăng nguy cơ chuyển dạng ung thư. Trong trường hợp viêm thực quản trào ngược, 0,5-1% bệnh nhân bị Barrett thực quản phát triển ung thư biểu mô tuyến thực quản, một loại ung thư gây tử vong cao [11]. Tổng hợp lại, những sự thích nghi này đại diện nhưng một phần nhỏ của hệ thống phương tiện đã phát triển để chống lại thương tích và duy trì cân bằng nội môi. Tuy nhiên, bất chấp khả năng phục hồi ấn tượng của sinh vật, các biện pháp thích ứng cũng có thể bị áp đảo. Tế bào có thể bị tổn thương theo một số cách, bao gồm thiếu oxy, viêm, mất cân bằng dinh dưỡng, tổn thương vật lý, rối loạn di truyền và các tác nhân lây nhiễm, và một số tác nhân gây nhiễm trùng, tất cả đều có thể gây ra tổn thương không thể phục hồi và cuối cùng là chết tế bào (Hình 1.1).
2.2 Cơ chế của sự lành thương
Sự lành vết thương mô tả sự phục hồi các mối quan hệ giải phẫu bình thường và tính toàn vẹn sinh lý của các mô bị phá vỡ do chấn thương. Phản ứng cần thiết này đối với chấn thương diễn ra thông qua sự kết hợp giữa tái tạo (regeneration) và sửa chữa (repair), được định nghĩa tương ứng là sự phục hồi hoàn toàn của mô bị mất đi hoặc thay thế bằng sẹo xơ. Thường xảy ra đồng thời, sự cân bằng giữa hai quá trình này là động và phụ thuộc vào khả năng tăng sinh của mô liên quan, cũng như tính chất và mức độ của tổn thương.
Mô có thể được phân loại thành ba nhóm cơ bản dựa trên khả năng thay thế mô bị tổn thương bằng mô khỏe mạnh thông qua sự tăng sinh của tế bào gốc: biến đổi, ổn định và vĩnh viễn. Các mô biến đổi (labile tissues) như tủy xương và lớp biểu mô của da liên tục tái tạo và tạo ra các phản ứng phục hồi mạnh mẽ đối với chấn thương. Ít mạnh mẽ hơn là các mô ổn định (stable tissues) bao gồm các tế bào gốc dành phần lớn thời gian sống của chúng trong trạng thái tĩnh lặng nhưng có thể tăng sinh. Ví dụ bao gồm tế bào gan tái tạo sau khi cắt bỏ và biểu mô của ống thận phân chia nhanh chóng sau chấn thương thận cấp tính. Các mô vĩnh viễn (permanent tissues) như tế bào cơ tim được biệt hóa giai đoạn cuối và cho thấy rất ít hoặc không có khả năng tái tạo. Thay vào đó, các mô này lành lại thông qua quá trình sửa chữa, giải thích tại sao rất ít cơ tim có thể được tái tạo sau cơn nhồi máu cơ tim.
Khi sửa chữa là quá trình lành thương chủ đạo, như được thấy trong chấn thương các mô vĩnh viễn, cũng như chấn thương làm mất tế bào gốc, như trong trường hợp bỏng nặng, mô bị thương được thay thế bằng sẹo xơ. Sâu bên trong vết thương, quá trình sửa chữa được tiến hành thông qua sự hình thành của mô hạt giúp lấp đầy chỗ khuyết của mô, bảo vệ vết thương khỏi chấn thương và nhiễm trùng sâu hơn, đồng thời tạo cơ sở cho việc hình thành sẹo. Có màu đỏ tươi và có dạng hạt, mô hạt bao gồm các mạch máu mới, nguyên bào sợi và nguyên bào sợi cơ có nhiệm vụ cung cấp chất dinh dưỡng, lắng đọng các protein cấu trúc cần thiết để tái tạo và co lại vết thương. Trên bề mặt, các tế bào biểu mô ở rìa vết thương nhanh chóng tăng sinh và di chuyển vào bên trong để bảo vệ các đợt chữa lành ban đầu (Hình 1.2).
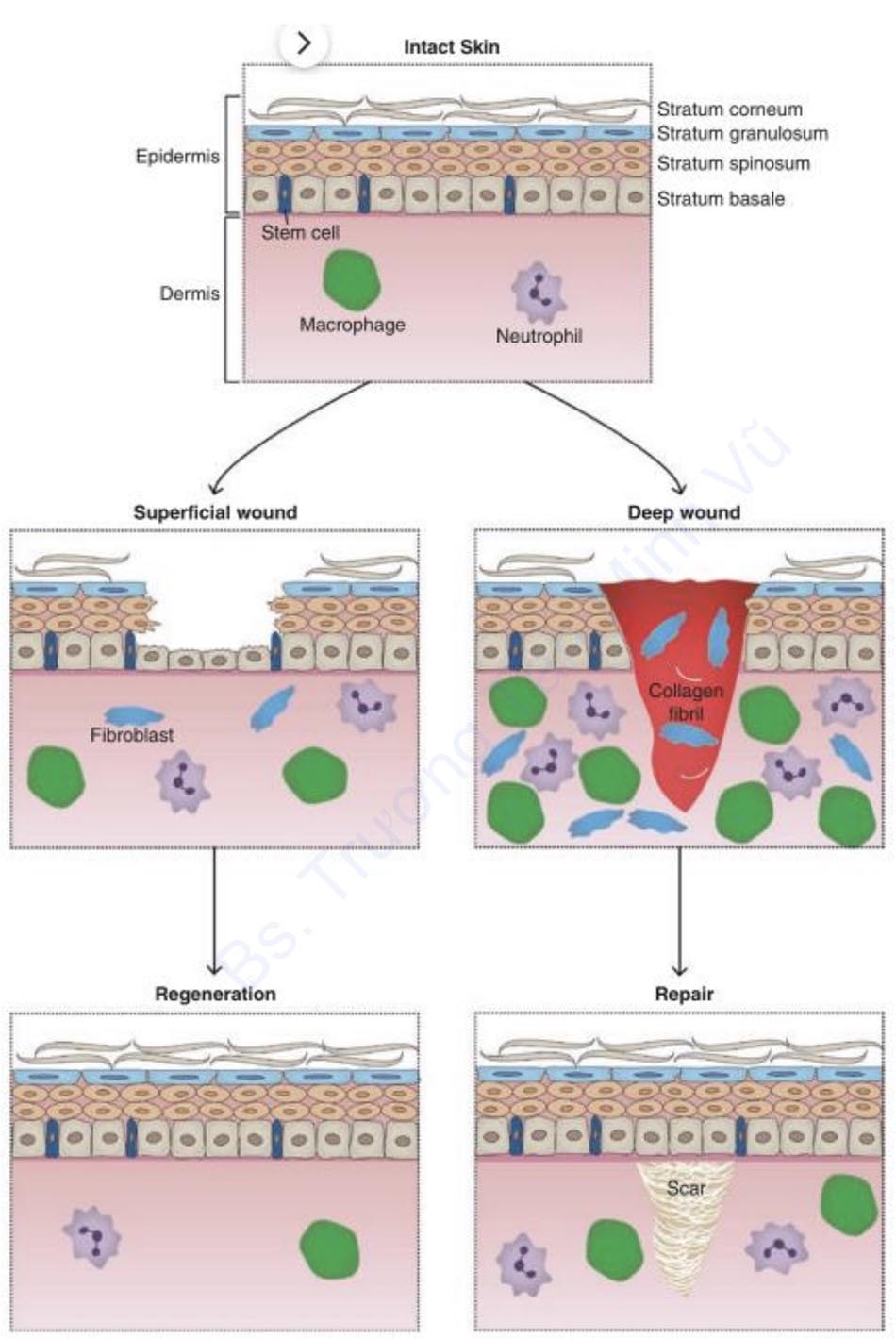
2.3 Các giai đoạn lành thương và sau đó
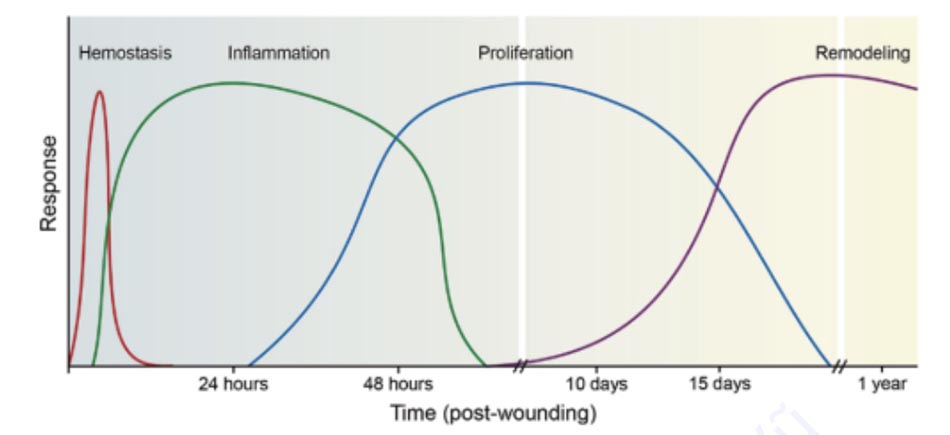
Sự lành vết thương là một quá trình phức tạp bắt đầu ngay sau chấn thương mô và tiến hành thông qua một trình tự được mô tả rõ ràng với các giai đoạn được điều chỉnh và chồng chéo gồm cầm máu (hemostasis), viêm (inflammation), tăng sinh (proliferation) và sửa chữa (remodeling) (Hình 1.3).
2.3.1 Cầm máu (ngay lập tức)
Ngay sau chấn thương mô và tổn thương mao mạch, tiểu cầu bám vào collagen dưới nội mô trên thành mạch tiếp xúc tạo thành một nút cầm máu yếu. Mục đích chính của nút này là để ngăn chặn tình trạng mất máu. Các yếu tố đông máu trong tuần hoàn sau đó ổn định nút thông qua một dòng enzym thúc đẩy sự kết tập tiểu cầu và hình thành khung fibrin ban đầu. Ngoài việc đóng vai trò là tế bào tác động chính của quá trình cầm máu, các tiểu cầu được kích hoạt trong khung fibrin tiết ra các yếu tố tăng trưởng cần thiết để chữa lành vết thương. Được nghiên cứu kỹ lưỡng nhất là các yếu tố tăng trưởng có nguồn gốc từ tiểu cầu (PDGF) và yếu tố tăng trưởng biến đổi-β, các chất mạnh chịu trách nhiệm cho việc thu hút và tăng sinh các tế bào viêm điều phối các giai đoạn tiếp theo của quá trình chữa lành. Tiểu cầu cũng hỗ trợ quá trình tái lưu thông máu của vết thương bằng cách giải phóng yếu tố tăng trưởng nội mô mạch máu (VEGF), một yếu tố proangiogenic tạo thuận lợi cho máu lưu thông bằng cách khôi phục tính toàn vẹn của các mạch bị tổn thương. Cùng hoạt động, các yếu tố nói trên đặt nền tảng cần thiết cho việc bắt đầu giai đoạn thứ hai của quá trình chữa lành vết thương, giai đoạn viêm.
2.3.2 Viêm (Ngày 0–5)
Khi quá trình cầm máu đạt được, nút ban đầu được biến đổi thành chất nền ngoại bào phức tạp (extracellular matrix, ECM) bao gồm các protein và carbohydrate ngoại bào thành khung vật lý và sinh hóa hỗ trợ cho quá trình lành thương. Trong số các phân tử này có chất có nguồn gốc từ tiểu cầu, chất chuyển hóa axit arachidonic, hệ thống bổ thể và các sản phẩm thoái hóa của vi khuẩn thu hút bạch cầu trong tuần hoàn vào vết thương trong một quá trình được gọi là viêm. Bạch cầu trung tính đến hiện trường đầu tiên, thực bào vi khuẩn xâm nhập cũng như các mảnh vỡ hoại tử và ngoại lai. Mức độ bạch cầu trung tính đạt đỉnh trong vòng 24 giờ, tại thời điểm đó các đại thực bào di chuyển vào ECM và trở thành chất trung gian gây viêm chủ yếu trong các ngày 2-5. Trong khi các đại thực bào cũng chống lại nhiễm trùng và loại bỏ các mảnh vỡ thông qua quá trình thực bào, chức năng chính của chúng là thu nhận các tế bào hiệu ứng sửa chữa vào nền vết thương. Điều này được thực hiện bằng cách liên kết với các thụ thể tích phân trong ECM như yếu tố α hoại tử khối u và interleukin-1, cho phép tiết ra các cytokine thu hút các nguyên bào sợi, các hoạt động chữa lành vết thương được thấy trong giai đoạn tăng sinh.
2.3.3 Tăng sinh (Ngày 5–10)
Với sự xuất hiện của các nguyên bào sợi vào ngày thứ 5, quá trình lành vết thương chuyển sang giai đoạn tăng sinh và thường tiếp tục cho đến ngày thứ 10 sau chấn thương. Dấu hiệu nhận biết của giai đoạn này là sự hình thành mô hạt bao gồm mao mạch, nguyên bào sợi, nguyên bào sợi cơ và mô liên kết lỏng lẻo. Ngay từ sớm, môi trường vết thương thiếu oxy sẽ gây ra sự tiết ra yếu tố gây thiếu oxy-1 (HIF-1ɑ), một chất kích thích mạnh các mạch máu mới cung cấp chất dinh dưỡng và oxy để hỗ trợ trao đổi chất trong quá trình chữa lành. Chính những mạch máu mới này là nguyên nhân gây ra sự xuất hiện ban đỏ và dạng hạt của mô hạt.
Để hỗ trợ cấu trúc cho các mao mạch mới này và nhanh chóng lấp đầy khiếm khuyết của mô, các nguyên bào sợi tiết ra một lượng lớn collagen loại III được dệt thành các sợi liên kết với nhau. Nằm sâu bên trong các sợi này là các nguyên bào sợi đã biệt hóa với khả năng co bóp giống như cơ, được gọi là nguyên bào sợi cơ. Các phức hợp actin – myosin trong các tế bào này tạo ra một lực làm cho các mép của vết thương được kéo lại với nhau trong một quá trình được gọi là co lại vết thương. Ở các rìa ngoài của vết thương, tế bào sừng tăng sinh và di chuyển vào trung tâm, bao phủ mô hạt bằng một lớp tế bào bảo vệ mỏng.
Kết quả cuối cùng của ba giai đoạn đầu của quá trình chữa lành vết thương là một vết sẹo chưa trưởng thành (immature scar), một sự thích nghi quan trọng đối với sự tồn tại của loài chúng ta sau khi bị thương nặng. Kết quả là, ngay từ khi bị chấn thương, chúng ta có thể ngăn chặn tình trạng mất máu, nhanh chóng phục hồi tính toàn vẹn cấu trúc của các vết thương hở, ngăn ngừa nhiễm trùng và ngăn ngừa sự mất nhiệt và nước không nhìn thấy được. Tuy nhiên, những vết sẹo chưa trưởng thành thường khó coi, dễ vỡ và chỉ có một phần nhỏ độ bền kéo của mô lành. Để vượt qua những vấn đề này, các vết thương phải trải qua một quá trình sửa chữa lâu dài sau chấn thương cấp tính, tạo thành một vết sẹo trưởng thành gần giống với hình thức và chức năng của mô khỏe mạnh.
2.3.4 Sửa chữa (Ngày 10 – 2 Năm)
Giai đoạn cuối cùng của quá trình lành thương đánh dấu việc sửa chữa vết thương thành một vết sẹo trưởng thành, một quá trình bắt đầu khoảng 2 tuần sau chấn thương và có thể kéo dài trong nhiều năm. Với thời gian kéo dài này, việc chỉnh sửa vết sẹo phải được chờ cho đến khi quá trình trưởng thành hoàn tất.
Trong ECM, quá trình sửa chữa cho thấy sự suy thoái và thay thế collagen loại III yếu và vô tổ chức bằng collagen loại I mạnh hơn và có tổ chức hơn bằng chất nền metalloproteinase (MMPs). Sự biến đổi này đạt đỉnh khoảng 60 ngày sau khi bị thương, tại thời điểm đó độ bền kéo của sẹo lên đến 80% so với vùng da chưa tổn thương. Cùng thời gian, collagen type I mới được tổng hợp được dệt thành các sợi ổn định, làm phẳng sẹo. MMPs cũng làm giảm tế bào và mạch máu của vết thương, làm cho vết sẹo có bề ngoài giống với mô bình thường hơn.
3. Các yếu tố ảnh hưởng đến sự lành vết thương
3.1 Giới thiệu
Để lành thương thích hợp, tất cả bốn giai đoạn — cầm máu, tiêu viêm, tăng sinh và sửa chữa — phải diễn ra không có sai lệch về trình tự hoặc về thời gian. Các yếu tố có thể can thiệp quá trình lành thương dẫn đến việc sửa chữa mô không đầy đủ hoặc không đúng cách. Các yếu tố can thiệp có thể được phân loại thành các yếu tố không thay đổi được và có thể thay đổi được, các yếu tố này có thể được phân loại thêm thành các yếu tố tại chỗ và toàn thân.
3.1.1 Các yếu tố không thể thay đổi
Một số yếu tố nguy cơ khiến vết thương kém lành hiện nằm ngoài tầm kiểm soát của bác sĩ, gồm các tình trạng di truyền, như hội chứng Down [12], cũng như các tình trạng miễn dịch, như thiếu hụt kết dính bạch cầu [13]. Ngoài các tình trạng di truyền và miễn dịch, ví dụ đáng chú ý nhất về yếu tố can thiệp không thể thay đổi là tuổi tác. So với dân số chung, bệnh nhân cao tuổi có thời gian lành thương chậm hơn và tỷ lệ vết thương mãn tính không lành cao hơn, nhưng chất lượng thực tế của sự lành thương không bị suy giảm. Giai đoạn viêm khác với những bệnh nhân trẻ hơn, về cả các yếu tố tăng trưởng liên quan giảm theo tuổi, và các cytokine tiền viêm, như yếu tố hoại tử khối u alpha, được duy trì ở mức độ cao hơn [14]. Khi tuổi càng cao, biểu hiện của angiotensin II trên da tăng lên, do đó dẫn đến mức độ cao hơn của yếu tố tăng trưởng chuyển hóa beta (TGF-β). Tất cả những yếu tố này kết hợp với nhau được cho là có liên quan đến việc ức chế tái lập biểu mô, cuối cùng dẫn đến sự biến đổi vết thương cấp tính thành vết thương mãn tính [15]. Các bác sĩ phẫu thuật nên nhận thức được điều này để tối ưu hóa các yếu tố có thể sửa đổi để đảm bảo lành vết thương thích hợp ở bệnh nhân lớn tuổi. Khi đối mặt với các yếu tố nguy cơ không thể sửa đổi, việc tối ưu hóa các yếu tố dưới sự kiểm soát của bác sĩ phẫu thuật càng tăng thêm tầm quan trọng [16].
3.1.2 Các yếu tố có thể thay đổi
Các yếu tố có thể thay đổi đại diện cho các chỉ số có thể phòng ngừa có thể được thay đổi để tạo điều kiện lành vết thương tối ưu. Chúng bao gồm các yếu tố toàn thân như dinh dưỡng, mức đường huyết, tình trạng hút thuốc và sử dụng steroid. Cần lưu ý rằng xử trí thích hợp thiếu máu cục bộ và nhiễm trùng là đặc biệt quan trọng.
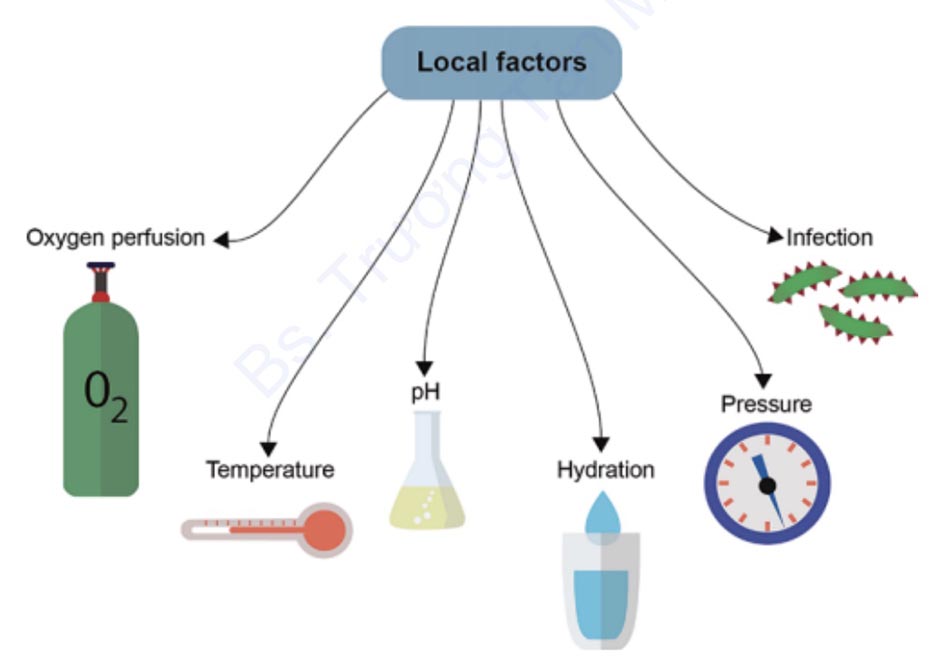
3.2 Các yếu tố tại chỗ (Hình 1.4)
Hình 1.4 Các yếu tố tại chỗ ảnh hưởng đến sự lành vết thương bao gồm mức độ oxy máu và độ ẩm, nhiệt độ, áp suất, độ pH và sự xuất hiện nhiễm trùng.
3.2.1 Kiểu đóng vết thương
Thời gian và quá trình lành thương phụ thuộc nhiều vào kiểu đóng vết thương, có thể được chia đơn giản thành ba nhóm. Trong lành thương sơ cấp chủ yếu, vết thương được đóng lại ngay lập tức bằng cách gần như trực tiếp, hoặc qua việc sử dụng một vạt hoặc ghép da, thường được ưu tiên ở những bệnh nhân khỏe mạnh và vết thương sạch và không bị nhiễm trùng. Hiện nay, đây là phương pháp lành thương tối ưu vì giảm thiểu nguy cơ nhiễm trùng và sẹo.
Vết thương được đóng lại theo kiểu thứ cấp khi quá trình đóng sơ cấp không thành công và vết thương đã bị đứt hoặc khi không thể đóng vết thương sơ cấp. Trong những trường hợp như vậy, vết thương có thể để hở để lành bằng cách co vết thương và tái tạo biểu mô. Để lấp đầy chỗ trống, cơ thể phải tạo ra một chất nền mô hạt mà cuối cùng được chuyển thành mô sẹo. Biểu mô hoá xảy ra từ các mép vết thương hoặc từ các tế bào xung quanh các cơ quan phần phụ. Sự co rút là kết quả từ các nguyên bào sợi cơ tạo ra một lực kéo bên trong vết thương và tạo ra chất nền ngoại bào co lại theo thời gian. Mặc dù sự co
là phần bình thường của quá trình đóng thứ cấp, nhưng cần phải cẩn thận để tránh co rút.
Sự co rút, xảy ra do co thắt quá mức, có thể làm giảm cử động xung quanh khớp, dẫn đến
suy giảm chức năng và biến dạng cơ thể. Vì các vết thương được điều trị kiểu đóng thứ
cấp đòi hỏi nhiều thời gian và năng lượng để chữa lành hơn so với đóng sơ cấp, chúng có
thể để mở trong thời gian dài khiến dễ bị dơ và nhiễm trùng sau đó.
Cuối cùng, kiểu đóng vết thương cấp ba liên quan đến việc cố ý trì hoãn việc đóng vết thương. Điều này có thể khá hữu ích đối với các vết thương bị dơ, nếu được đóng sơ cấp sẽ có nguy cơ nhiễm trùng cao, nhưng nếu được băng, vết thương có thể được đóng lại một cách an toàn 4–5 ngày sau khi bị thương. Trong giai đoạn này, vết thương có thể được tối ưu hóa để đóng lại thông qua quá trình làm sạch và cắt lọc. Việc đóng lại được thực hiện khi các mép vết thương có vẻ còn sống, được tưới máu tốt và sạch sẽ.
3.2.2 Tưới oxy
Mục tiêu chính trong chăm sóc vết thương là tối ưu hóa lưu lượng máu để cung cấp
oxy tối đa đến mô bị thương. Oxy là cần thiết cho quá trình lành thương tối ưu vì nó được
biết là thúc đẩy tổng hợp collagen, sản xuất nguyên bào sợi, trưởng thành tế bào sừng,
mô biểu mô và hình thành mạch mới, nhưng cũng để ức chế nhiễm trùng [17]. Oxy là cần
thiết cho hoạt động thích hợp của một số enzym tham gia vào quá trình tổng hợp collagen
và liên kết ngang. Ví dụ, hoạt động của hydroxylase, thủy phân lysine và proline, phụ
thuộc trực tiếp vào lượng oxy có trong vết thương [18, 19]. Độ bền của vết thương tỷ lệ
thuận với tổng hợp collagen, đó là oxy [20]. Sự hình thành mô biểu mô là tối ưu ở những
vết thương ẩm ướt, được tưới máu tốt với các nghiên cứu đã chỉ ra rằng tế bào biểu bì phát triển tốt nhất với nồng độ oxy 10–50% [21]. Vai trò cấp thiết của tưới máu đầy đủ oxy đối với quá trình hình thành mạch có thể được đánh giá bằng cách xem xét tác động của tình trạng thiếu oxy đối với sự hình thành mạch mới. Khi các tế bào trở nên thiếu oxy, một số con đường sinh hóa kích hoạt sản xuất các yếu tố phiên mã tạo mạch khác nhau, như yếu tố gây giảm oxy-1 (HIF-1) [22, 23]. Cần lưu ý rằng lactate là một yếu tố khác dường như cộng tác với oxy để tạo thành mạch [17]. Cung cấp đủ oxy và tưới máu là rất quan trọng để chống lại nhiễm trùng. Cơ chế kháng khuẩn tế bào được thực hiện bởi bạch cầu đa nhân trực tiếp phụ thuộc vào sự sẵn có của các gốc oxy tự do, chẳng hạn như superoxide diệt khuẩn [17]. Hơn nữa, sự tưới máu không đầy đủ oxy có liên quan đến tình trạng không nhạy cảm với kháng sinh, các vết thương thiếu oxy sẽ ít nhạy cảm hơn với kháng sinh [24]. Cần lưu ý rằng ngay sau khi bị thương, tình trạng thiếu oxy sẽ kích thích quá trình lành vết thương, và chỉ sau khi tiếp xúc mãn tính với tình trạng thiếu oxy thì quá trình lành thương mới bị trì hoãn, với vết thương trở thành mãn tính [25]. Nói cách khác, tình trạng thiếu oxy là cần thiết để bắt đầu quá trình lành thương, sau đó sẽ được duy trì với việc cung cấp oxy cần thiết [26].
3.2.3 Giữ ẩm
Giữ ẩm đầy đủ cho vết thương là điều quan trọng để vết thương được lành tối ưu. Sau chấn thương, hàng rào bảo vệ da bị phá vỡ, dẫn đến tăng mất nước trên bề mặt. Việc làm khô vết thương có thể dẫn đến mất nước và chết tế bào, cuối cùng dẫn đến hình thành vảy và suy giảm khả năng chữa lành vết thương. Các vết loét và bỏng đặc biệt có nguy cơ bị khô vì tốc độ mất nước từ bề mặt vết thương cao gấp 10 lần so với da bình thường [27]. Giữ ẩm vết thương cho phép lành thương nhanh hơn nhưng cũng ít đau hơn [28].
Môi trường có độ ẩm cao sẽ thúc đẩy quá trình hình thành mạch và tổng hợp collagen [28]. Ngoài ra, so với vết thương khô, vết thương ẩm có tốc độ tái tạo biểu mô và sản xuất tế bào sừng cao hơn [29].
Đồng thời, độ ẩm đầy đủ ức chế sự phân hủy của các yếu tố tăng trưởng và proteinase [30] và dẫn đến tỷ lệ hình thành sẹo thấp hơn [31]. Các yếu tố khác được cho là có liên quan đến việc cải thiện quá trình lành vết thương khi gặp môi trường ẩm là tăng cường sự di chuyển của tế bào biểu bì [32] và sản xuất nguyên bào sợi [33]. Cần lưu ý rằng, trái ngược với những quan niệm trước đây, và ngược lại với vết thương mất nước, môi trường ẩm không làm tăng nguy cơ nhiễm trùng [34].
3.2.4 Nhiệt độ
Duy trì nhiệt độ tối ưu cũng ảnh hưởng đến việc lành vết thương. Hai yếu tố quyết định nhiệt độ của vết thương, nhiệt độ của môi trường và mức độ cung cấp máu cho vùng bị thương. Nguồn cung cấp máu được xác định bởi mức độ giãn hoặc co thắt mạch máu.
Trong môi trường vết thương cấp tính, sự gia tăng các chất trung gian hoạt động mạch dẫn đến giãn mạch cục bộ để cung cấp oxy và chất dinh dưỡng hiệu quả hơn. Giãn mạch làm tăng nhiệt độ tại chỗ [35]. Các vết thương mãn tính, như loét bàn chân do tiểu đường, thường có mạng lưới cung cấp máu kém dẫn đến nhiệt độ thấp hơn nhiệt độ bên trong 5°C [36]. Tốt nhất vết thương nên được duy trì ở nhiệt độ gần 37°C để vết thương mau lành nhất. Nhiệt độ vết thương tăng lên có thể là dấu hiệu của nhiễm trùng [37].
3.2.5 Vi sinh / Nhiễm trùng
Sự hiện diện của sự phát triển quá mức của vi khuẩn trong vết thương có ảnh hưởng có hại đến quá trình lành thương. Sự hiện diện của vi khuẩn có thể được phân loại là nhiễm, xâm nhiễm, xâm nhiễm đáng kể và nhiễm trùng xâm lấn dựa trên mức độ và giai đoạn phát triển của vi khuẩn. Sự nhiễm cho thấy sự hiện diện của vi khuẩn mà không tăng sinh, trong khi sự xâm nhiễm cho thấy rằng vi khuẩn đã bắt đầu nhân lên nhưng tổn thương mô vẫn chưa xảy ra. Điểm xâm nhiễm đáng kể đạt được khi phản ứng miễn dịch của vật chủ trở nên quá mức do vi khuẩn tăng sinh. Thông thường, điều này trùng hợp với việc tạm ngừng lành vết thương. Khi vi khuẩn tiếp tục tăng sinh ngay cả khi phản ứng của vật chủ xảy ra, và số lượng vi khuẩn đạt tới 105 vi khuẩn trên một gam mô, nó được coi là một tình trạng nhiễm trùng và tiếp theo tổn thương vật chủ xảy ra [38]. Vi khuẩn trong vết thương gây ra gánh nặng trao đổi chất khi chúng cạnh tranh với các nguyên bào sợi và đại thực bào để lấy chất dinh dưỡng và cản trở quá trình lành bình thường. Do đó, bắt buộc phải giảm sự hiện diện của vi khuẩn. Vết thương bị nhiễm có thể cần tưới và rửa đơn giản, trong khi vết thương bị nhiễm trùng có thể cần cắt lọc tế bào chết và dùng thuốc kháng sinh toàn thân [16]. Thuốc kháng sinh toàn thân có tác dụng tốt nhất ở những vùng vết thương được tưới máu đầy đủ. Tuy nhiên, nếu việc khử nhiễm không đủ, giai đoạn viêm sẽ kéo dài hơn để loại bỏ gánh nặng vi khuẩn. Nếu mức độ vi khuẩn quá cao, vết thương có thể trở thành mãn tính và quá trình lành thương có thể thất bại. Viêm kéo dài có hai di chứng, nó thúc đẩy sản xuất MMPs, như đã mô tả ở trên là các protease làm suy giảm ECM và ức chế sản xuất các chất ức chế protease tự nhiên. Kết hợp, những di chứng này dẫn đến sự suy thoái của các yếu tố tăng trưởng khi chức năng protease trong các vết thương mãn tính diễn ra không được kiểm soát [39].
3.2.6 pH
Mức độ axit mà vết thương tiếp xúc có thể xác định giai đoạn chữa lành, và thực sự thì mức độ pH thay đổi tùy theo quá trình chữa lành [36]. Ở da nguyên vẹn, các tế bào sừng được thấy trong lớp biểu bì tiết ra axit có chức năng bảo vệ chống lại vi khuẩn và nấm. Khi hàng rào này bị phá vỡ sau chấn thương, mạch máu cục bộ cũng có thể bị thương, dẫn đến tăng độ pH của bề mặt vết thương từ xấp xỉ 5 đến 7,4 [40]. Vết thương thường có gradient pH, với vùng sâu nhất của vết thương có độ pH cao nhất [41]. Các nghiên cứu đã chỉ ra rằng tính axit thúc đẩy quá trình lành vết thương, trong khi tính kiềm ức chế quá trình lành vết thương và thúc đẩy hình thành vết thương mãn tính. Tính axit hỗ trợ lành vết thương bằng cách thúc đẩy tăng sinh nguyên bào sợi và tế bào sừng và hình thành mô hạt [42]. Ngoài ra, tính axit ức chế sự phát triển của vi khuẩn làm giảmnguy cơ nhiễm trùng.
Tính kiềm ức chế quá trình lành vết thương thông qua các cơ chế khác nhau. Đầu tiên, do độ pH thấp sẽ bảo vệ chống lại sự phát triển của vi khuẩn, vi khuẩn có thể chiếm ưu thế trong điều kiện kiềm dẫn đến nhiễm trùng mà còn hình thành màng sinh học [43]. Thứ hai, những vi khuẩn này có thể tiết ra các protease hoạt động tối ưu trong điều kiện kiềm và có thể thúc đẩy quá trình phân giải protein, dẫn đến giải phóng các sản phẩm độc hại, cuối cùng là ức chế sự lành vết thương [44].
3.2.7 Áp lực
Áp lực là một lực cơ bản sẽ được thảo luận chi tiết hơn trong Sect. 1.4 ở phần sau của chương này. Điều quan trọng là phải duy trì áp lực tại vị trí chấn thương trong mức tối ưu. Ví dụ, nếu áp lực quá thấp, khi không áp dụng liệu pháp ép từ bên ngoài, vị trí chấn thương và các mô xung quanh sẽ bị phù nề ở mức độ cao có thể làm tăng cảm giác đau [45].
Ngược lại, áp lực quá cao duy trì trong thời gian dài có thể cản trở mạch máu tại chỗ, hạn chế cung cấp máu cho vùng, giảm dinh dưỡng và cung cấp oxy, đồng thời ức chế quá trình lành thương.
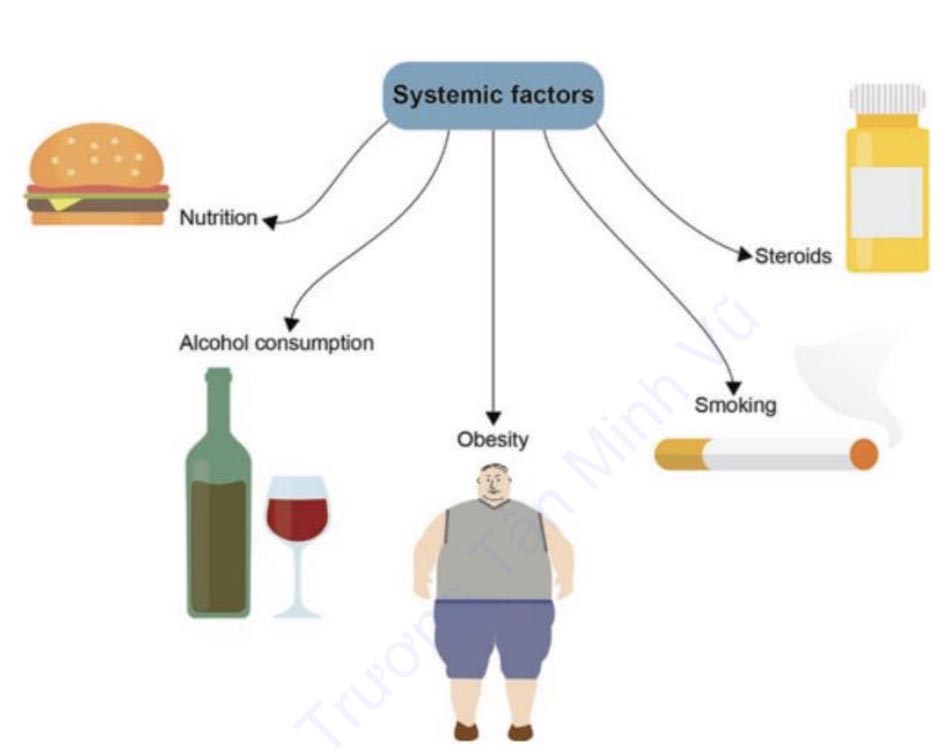
3.3 Các yếu tố toàn thân (Hình 1.5)
Tốc độ và chất lượng lành vết thương ở bệnh nhân có thể bị ảnh hưởng bởi một số yếu tố toàn thân, bao gồm dinh dưỡng, uống rượu, hút thuốc và sử dụng steroid.
3.3.1 Dinh dưỡng
Lành vết thương là một quá trình đòi hỏi sự trao đổi chất. Dinh dưỡng đầy đủ là cần thiết để lành vết thương thích hợp vì sự thiếu hụt chất dinh dưỡng đa lượng, vi lượng và vitamin có thể kéo dài quá trình lành vết thương. Vai trò quan trọng của dinh dưỡng trong việc lành vết thương có thể được nhìn thấy trong tất cả các giai đoạn của quá trình lành vết thương, với sự thiếu hụt dinh dưỡng khác nhau sẽ ảnh hưởng đến các quá trình khác nhau.
Các chất dinh dưỡng đa lượng quan trọng nhất cần thiết để lành vết thương thích hợp là protein và carbohydrate. Protein là yếu tố tối quan trọng trong việc lành vết thương, vì nó không chỉ cần thiết cho sự hình thành nguyên bào sợi, collagen và mao mạch mà còn cần thiết cho hệ thống miễn dịch hoạt động thích hợp để ngăn ngừa nhiễm trùng. Việc lành vết thương ở những bệnh nhân thiếu protein có giai đoạn viêm kéo dài hơn, nguyên nhân là do giảm sản xuất collagen và các protein khác cần thiết để chữa lành, và tỷ lệ thoái hóa vết thương cao hơn [46]. Giai đoạn viêm bị trì hoãn làm trì hoãn giai đoạn tăng sinh và sửa chữa.
Cần lưu ý rằng bệnh nhân đang lành thương tích cực có nhu cầu protein hàng ngày cao hơn, với một nghiên cứu cho thấy rằng để bệnh nhân có vết thương duy trì tình trạng dinh
dưỡng đầy đủ, họ cần 0,38 g protein cao hơn mỗi ngày so với bệnh nhân không có vết thương [47]. Hơn nữa, nhu cầu protein này thậm chí còn tăng lên ở nhiều vết thương không lành với lượng dịch tiết ra nhiều.
Lành vết thương là một quá trình đòi hỏi sự trao đổi chất, tương tự như các quá trình khác trong cơ thể, sử dụng carbohydrate làm nguồn năng lượng chính. Carbohydrate monosaccharide, như glucose, được sử dụng để sản xuất adenosine triphosphate cần thiết
để cung cấp năng lượng cho các quá trình như tăng sinh tế bào và hình thành mạch. Khi
thiếu glucose, cơ thể buộc phải trải qua quá trình gluconeogenesis, sử dụng các nguồn
năng lượng khác nhau bao gồm các axit amin và có thể dẫn đến cạn kiệt các thành phần
cần thiết cho việc tổng hợp các protein cần thiết để lành thương hiệu quả. Ngược lại, tăng
đường huyết cũng có thể gây ra những biến chứng lớn trong quá trình làm lành vết thương.
Tăng đường huyết toàn thân dẫn đến glycosyl hóa vi mạch, do đó làm giảm lưu lượng máu và giảm tính thẩm thấu của hồng cầu. Điều này dẫn đến tình trạng thiếu oxy và cạn kiệt chất dinh dưỡng, cuối cùng là làm suy giảm khả năng lành vết thương [48].
Một số vi chất dinh dưỡng bao gồm kẽm có liên quan chặt chẽ đến quá trình lành thương bị suy giảm. Điều này được cho là do thực tế là kẽm cần thiết để hình thành các chất nền metalloproteinase, cần thiết cho quá trình lành thương đầy đủ [49]. Sắt và magiê cần thiết cho sự hình thành collagen [50].
Vitamin A, C và E có vai trò rõ ràng nhất trong việc lành vết thương và sự thiếu hụt của một trong các loại vitamin này sẽ dẫn đến việc lành vết thương bị suy giảm. Cụ thể, sự thiếu hụt vitamin A và vitamin C có liên quan đến việc giảm hình thành mạch, lắng đọng collagen và tăng sinh nguyên bào sợi. Vitamin A cũng có liên quan đến việc giảm suy thoái ECM trong khi vitamin C có liên quan đến việc giảm độ dễ vỡ của mao mạch cũng như cải thiện tổng thể hệ thống miễn dịch, và do đó giảm khả năng nhiễm trùng. Vitamin E được biết đến nhiều nhất với vai trò là chất chống oxy hóa, và trong quá trình lành vết thương, bảo vệ ECM khỏi bị phá hủy do quá trình oxy hóa. Nghiên cứu trên động vật cho thấy rằng việc bổ sung vitamin E có liên quan đến việc cải thiện quá trình lành vết thương, đặc biệt là về mặt giảm hình thành sẹo [51].
3.3.2 Béo phì
Béo phì là một yếu tố quan trọng ảnh hưởng đến việc lành vết thương, và trong tình trạng béo phì hiện nay, một chủ đề cấp thiết sẽ được thảo luận trong chương này. Nguy cơ gia tăng đối với các biến chứng vết thương khác nhau, bao gồm nhiễm trùng, hoại tử, thoái hoá, xuất hiện huyết thanh, và loét, được chấp nhận rõ ràng [52]. Cơ chế được đề xuất gây ra những biến chứng này là sự tưới máu không đầy đủ các chất dinh dưỡng và oxy xảy ra trong mô mỡ dưới da. Lý thuyết đằng sau điều này là béo phì dẫn đến phì đại và tăng sản tế bào mỡ. Điều này dẫn đến rối loạn chức năng trao đổi chất và bắt đầu viêm mãn tính cấp độ thấp. Đồng thời, đại thực bào M2 có chức năng bảo vệ được thay thế bằng đại thực bào M1 có tính tiền viêm. Ngoài ra, tỷ lệ phì đại tế bào mỡ không phù hợp với tốc độ hình thành mạch, với sự hình thành mạch không theo kịp với nhu cầu tưới máu tăng lên. Thêm vào môi trường không thuận lợi này, mô mỡ ở những người béo phì giải phóng các yếu tố gây xơ hóa và ức chế sự hình thành mạch [53]. Nhìn chung, điều này làm giảm tưới máu của khu vực dẫn đến tình trạng thiếu oxy. Về nhiễm trùng, giảm tưới máu được cho là không chỉ tạo ra môi trường dễ bị nhiễm vi sinh vật mà còn là môi trường cản trở việc cung cấp kháng sinh. Ngoài giảm tưới máu, vết thương ở những người béo phì được cho là có sức căng cao hơn, điều này không chỉ làm tăng nguy cơ thoái hoá mà còn làm tăng thêm tình trạng giảm tưới máu, thông qua sự gia tăng bất lợi của áp lực mô [53]. Béo phì cũng có tác động tiêu cực chung đến hệ thống miễn dịch. Tế bào mỡ và đại thực bào được tìm thấy trong mô mỡ giải phóng adipokine, là các phân tử hoạt tính sinh học có thể ức chế hệ thống miễn dịch. Những phân tử này bao gồm, nhưng không giới hạn ở, cytokine và các yếu tố giống hormone như leptin và adiponectin được cho là có tác động tiêu cực đến việc lành vết thương [54].
3.3.3 Tình trạng hút thuốc
Tác động tiêu cực của việc hút thuốc lá đối với việc lành vết thương đã được biết rõ. Đặc biệt, hút thuốc làm chậm quá trình lành vết thương và tăng nguy cơ biến chứng.
Ví dụ, một nghiên cứu từ Wahie và Lawrence cho thấy tỷ lệ nhiễm trùng sau sinh thiết da
là 64% ở người hút thuốc so với 12% ở người không hút thuốc [55]. Một nghiên cứu khác
cho thấy những người hút thuốc cũng có nguy cơ hoại tử cao hơn, gấp ba lần so với những
người không hút thuốc, và nguy cơ này càng tăng đối với những người hút thuốc nặng hơn [56]. Các cơ chế chính xác gây ra những nguy cơ gia tăng này vẫn chưa được hiểu đầy đủ, nhưng người ta tin rằng sự co mạch và thiếu máu cục bộ mô có vai trò nhất định.
Sau khi hít phải khói, lưu lượng máu ngoại vi giảm đáng kể (30–40%) [57]. Trong bối cảnh lành vết thương, điều này có nghĩa là mô bị thương nhận được ít oxy hơn, làm suy giảm khả năng sửa chữa. Nicotine, một chất co mạch có trong thuốc lá, cũng có tác dụng tạo huyết khối. Bằng cách tăng khả năng kết dính của tiểu cầu, nicotin có thể góp phần vào chứng thiếu máu cục bộ ở mô [58]. Thiếu máu cục bộ ở mô có ảnh hưởng có hại đến việc lành vết thương bằng cách gây ra tình trạng thiếu oxy ở mô. Do những tác động tiêu cực của việc hút thuốc đối với việc lành vết thương, bệnh nhân nên kiêng hút thuốc trong vòng 4–6 tuần trước khi phẫu thuật.
3.3.4 Uống rượu
Sự lành thương bị ảnh hưởng tiêu cực bởi cả sử dụng rượu cấp tính và mãn tính. Sự suy giảm này là do tỷ lệ nhiễm trùng tăng lên, được cho là do sự ức chế các cytokine tiền viêm, bạch cầu trung tính và thực bào, và do sự ức chế giai đoạn tăng sinh làm lành vết thương [59]. Cụ thể, sử dụng rượu cấp tính đã được chứng minh là làm giảm hơn một nửa mức độ hình thành mạch, một hiện tượng được giả thuyết là do sự suy giảm biểu hiện của yếu tố tăng trưởng nguyên bào sợi cơ bản proangiogenic cytokine (FGF-2) và yếu tố tăng trưởng nội mô mạch máu (VEGF) [60]. Hơn nữa, các nghiên cứu trên động vật đã chỉ ra rằng nhiễm độc cấp tính ức chế sản xuất collagen, đồng thời thúc đẩy sự biểu hiện của các enzym phân giải chất nền và biến đổi yếu tố tăng trưởng beta (TGF-β), một phân tử ức chế miễn dịch làm suy giảm chức năng bạch cầu đơn nhân [61].
3.3.5 Steroid
Sử dụng steroid toàn thân có liên quan đến việc giảm tốc độ lành vết thương thông qua việc giảm hình thành mạch, tăng sinh nguyên bào sợi và lắng đọng collagen. Trong khi các cơ chế đằng sau điều này vẫn chưa rõ ràng, người ta đã đề xuất rằng steroid toàn thân làm giảm mức TGF-β, yếu tố tăng trưởng giống insulin-1 (IGF-1) và yếu tố gây giảm oxy-1 (HIF-1) gây ra các tác động nói trên [62, 63]. Ngoài những lợi ích được đề cập ở Sect. 3.3.1, vitamin A có thể là một chất hỗ trợ có lợi để đảo ngược tác dụng có hại của việc sử dụng steroid toàn thân đối với việc lành thương [16]. Ngoài tác dụng của chúng đối với quá trình lành vết thương, steroid toàn thân cũng có liên quan đến việc tăng nguy cơ nhiễm trùng vết thương. Điều quan trọng cần lưu ý là trái ngược với steroid toàn thân, sử dụng steroid tại chỗ đã được chứng minh là cải thiện quá trình lành vết thương, đặc biệt là thông qua việc giảm sự hình thành mô hạt quá mức [64].
4 Các chiến lược làm lành vết thương
4.1 Giới thiệu
Điều chỉnh các yếu tố cục bộ và toàn thân được mô tả trong Sect.2 tối ưu hóa việc lành vết thương. Qua nhiều năm, các công cụ của các công nghệ lành vết thương làm thay đổi môi trường vết thương đã phát triển. Phần này sẽ thảo luận về các tùy chọn khác nhau, tập trung vào những ưu điểm và nhược điểm của chúng.
4.2 Cắt lọc
Cắt lọc là quá trình loại bỏ mô ở mép vết thương với mục đích cuối cùng là thúc đẩy quá trình lành vết thương. Có thể tiến hành cắt lọc để loại bỏ các mô bị nhiễm và giảm tải lượng màng sinh học ở rìa vết thương. Mô hoại tử cũng là một chỉ định, vì mô không thể sống được là một rào cản vật lý đối với việc loại bỏ chất thải và phân phối oxy và chất dinh dưỡng, cũng như đóng vai trò là chất nền cho sự phát triển của vi khuẩn. Cắt lọc cũng hỗ trợ loại bỏ tăng sừng trên diện rộng [65]. Ngoài ra, việc cắt lọc thường được thực hiện để chuẩn bị cho nền vết thương để điều trị thêm, ví dụ, để ghép hoặc ứng dụng yếu tố ngoại sinh.
Phần mô còn lại, tiếp giáp với mép vết thương đã được cắt lọc, có khả năng đáp ứng điều trị tốt hơn [66]. Các nghiên cứu đã chỉ ra rằng các tế bào ở rìa vết thương kém hiệu quả hơn trong việc phản ứng với các kích thích làm lành vết thương, so với các tế bào từ vùng lân cận, không bị loét. Điều này được cho là do sự khác biệt trong biểu hiện của các thụ thể yếu tố tăng trưởng ở hai khu vực [67].
Cắt lọc có thể được thực hiện bằng phẫu thuật, cơ học, bằng enzym hoặc thông qua việc sử dụng con giòi. Phẫu thuật cắt lọc yêu cầu bác sĩ phẫu thuật loại bỏ một cách có chọn lọc các mô không thể sống được bằng cách sử dụng dao mổ, kéo và các dụng cụ khác. Cắt lọc bằng phương pháp cơ học sử dụng thuỷ liệu pháp, băng từ ướt đến khô và tưới vết thương để loại bỏ các mô không thể sống được. Ngược lại, cắt lọc bằng enzym và sử dụng giòi là các quy trình sinh học hơn. Quá trình cắt lọc enzym là việc bôi các tác nhân enzym tại chỗ vào vết thương. Các enzym này phá vỡ các mô hoại tử. Mặc dù không được sử dụng phổ biến nhưng giòi có chức năng tương tự như tác nhân enzym; giòi ăn một cách chọn lọc các mô hoại tử. Bất kể phương pháp nào, việc cắt lọc thường phải được thực hiện nhiều lần, vì sự xâm lấn của vi sinh vật trong vết thương là phổ biến và thường được cho là do sự hình thành các màng sinh học [68].
4.3 Băng vết thương
Một số lượng lớn băng gạc đã được phát triển để tạo điều kiện cho việc lành vết thương. Băng vết thương có thể được phân loại thành băng thụ động, tương tác và hoạt tính sinh học. Băng thụ động, chẳng hạn như băng gạc, không bịt kín và chủ yếu hoạt động như một tấm che. Mặc dù đơn giản, băng gạc đơn vẫn là loại băng được sử dụng rộng rãi nhất. Bản thân gạc có thể được ngâm tẩm với nhiều chất khác nhau như iốt hoặc kẽm, là một lựa chọn rẻ tiền và dễ sử dụng để băng bó vết thương [69]. Băng thụ động có xu hướng được ưa chuộng ở vết thương khô ráo, sạch sẽ. Mặt khác, băng tương tác là loại băng kín hoặc bán kín và có thể hoạt động như một hàng rào bảo vệ chống lại sự nhiễm vi khuẩn. Các tùy chọn có sẵn bao gồm film, bọt, hydrogel và hydrocolloid. Băng film polyurethane dính và phù hợp với hình dạng của da, trong suốt và bán kín cho phép hơi nước và khí truyền qua. Những đặc tính này làm cho chúng phù hợp nhất với những vết thương bề ngoài với ít dịch tiết. Tương tự như vậy, băng dạng foam là loại bán kín. Chúng thường được làm bằng foam kỵ nước và ưa nước, có lợi ích hơn nữa là có thể hấp thụ dịch tiết vết thương; do đó, việc sử dụng được ưu tiên là ở những vết thương có lượng dịch tiết cao, như vết loét ở bàn chân của bệnh nhân tiểu đường. Băng hydrogel được cấu tạo từ các polyme tổng hợp như polyvinyl pyrrolidine, có hàm lượng nước cao có thể tạo ra môi trường ẩm ướt cho vết thương, được sử dụng phổ biến trong các vết thương mãn tính hoặc hoại tử khô, vết thương bỏng và vết loét do tì đè. Cuối cùng, băng hydrocolloid cung cấp tính thấm chọn lọc, bằng cách cho phép hơi nước và khí đi qua, nhưng là hàng rào ngăn cản vi khuẩn. Hơn nữa, chúng có một lớp keo bên trong cho phép hấp thụ dịch tiết [70]. Chúng thường được sử dụng cho các vết thương có lượng dịch tiết vừa phải, ví dụ như vết loét do tì đè và vết thương bỏng nhẹ. Băng hoạt tính sinh học kết hợp các vật liệu sinh học được biết là có liên quan đến việc lành vết thương, chẳng hạn như collagen, chitosan và axit hyaluronic, để tăng cường lành vết thương [71–73]. Chúng thường có thể được kết hợp với các yếu tố tăng trưởng và chất kháng khuẩn. Nhìn chung, băng hoạt tính sinh học đã được ca ngợi là vượt trội hơn nhiều so với các loại băng khác, đặc biệt vì chúng tương thích sinh học và có thể phân hủy sinh học [70].
4.4 Sinh học
Cytokine là một nhóm các protein nhỏ được tiết ra liên quan đến việc điều chỉnh quá trình viêm và bao gồm chemokine, interleukin và interferon. Yếu tố tăng trưởng là các protein nội sinh giúp tăng cường lành vết thương bằng cách thúc đẩy sự tăng sinh, biệt hóa và tồn tại của tế bào. Nhiều người đã cho rằng việc điều trị vết thương tại chỗ bằng các phân tử này sẽ tạo ra một cuộc cách mạng trong việc chữa lành vết thương. Tuy nhiên, chỉ có một yếu tố tăng trưởng trên thị trường hiện nay, PDGF. Becaplermin gel (REGRANEX) là PDGF tái tổ hợp đầu tiên được bán trên thị trường ở Hoa Kỳ và được chấp thuận để điều trị loét bàn chân do tiểu đường [74]. Các nghiên cứu cơ học ban đầu cho thấy chế phẩm bôi ngoài da này có khả năng thu hút bạch cầu trung tính và đại thực bào, tăng mức độ nguyên bào sợi, kích thích sản xuất các yếu tố ECM quan trọng và tăng cường tái tạo, tất cả đều cần thiết để chữa lành vết thương hiệu quả [75]. Trên thực tế, bảy thử nghiệm lâm sàng (tổng số n = 685) đã chứng minh sự gia tăng có ý nghĩa thống kê trong việc chữa lành vết loét với PDGF tái tổ hợp khi so sánh với liệu pháp giả dược [76]. Các thử nghiệm ngẫu nhiên về REPIFERMIN, một phương pháp điều trị tại chỗ tương tự có chứa tái tổ hợp của yếu tố tăng trưởng nguyên bào sợi (FGF), cũng cho thấy kết quả đầy hứa hẹn với sự cải thiện đáng kể trong việc chữa lành vết loét tĩnh mạch mãn tính. REPIFERMIN hiện đang trong giai đoạn thử nghiệm II để điều trị viêm niêm mạc do liệu pháp điều trị ung thư. Mặc dù có kết quả khả quan, việc sử dụng rộng rãi các yếu tố tăng trưởng tái tổ hợp đã bị hạn chế bởi sinh khả dụng kém và sự bất hoạt bởi các protease vết thương khiến các phương pháp điều trị này không hiệu quả [77].
4.4.1 Oxy cao áp
Liệu pháp oxy cao áp (HBOT) đã được quảng cáo là một phương pháp điều trị hiệu quả cho bệnh viêm loét chi dưới mãn tính. Về lý thuyết, HBOT làm giảm thiếu máu cục bộ cục bộ bằng cách thúc đẩy quá trình khuếch tán oxy vào nền vết thương thông qua việc tăng nồng độ oxy hòa tan trong huyết tương. Tuy nhiên, bằng chứng về việc sử dụng HBOT vẫn chưa thể kết luận được. Một số báo cáo nghiên cứu rằng HBOT dẫn đến tỷ lệ cắt cụt chi thấp hơn và cải thiện khả năng chữa bệnh sau 1 năm, mặc dù bằng chứng có chất lượng kém [78]. Một nghiên cứu khác cho thấy HBOT có thể có kết quả tiêu cực vì làm tăng nguy cơ bị cắt cụt cả nhỏ và lớn [79]. Các nghiên cứu khác cho thấy rằng HBOT không mang lại lợi ích cũng như không gây hại [80]. Nhìn chung, việc thiếu các thử nghiệm ngẫu nhiên tiền cứu về HBOT làm cho đây là một lĩnh vực còn tranh cãi.
4.4.2 Sản phẩm thay thế da
Các sản phẩm thay thế da có thể được phân loại thành các sản phẩm tế bào hoặc không phải tế bào. Các sản phẩm tế bào gồm một chất nền chứa mô sống, như nguyên bào sợi hoặc tế bào sừng, có thể là tự thân, nội sinh hoặc ngoại sinh. Mặt khác, các sản phẩm không phải tế bào có chất nền thiếu mô tế bào. Trong số các sản phẩm thay thế da đầu tiên được bán trên thị trường, Epicel® (Genzyme Biosurgery, Cambridge, MA) là một phương pháp tự tạo biểu mô sống có nguồn gốc từ tế bào sừng của chính bệnh nhân được nuôi cấy thành tấm lớn, do đó loại bỏ thương tật ở phần hiến tặng và giảm nhu cầu về lưới. Apligraf® (Organogenesis, Canton, MA), một “chất tương đương với da” gây dị ứng bao gồm chất nền collagen da bò có hạt nguyên bào sợi sơ sinh và tế bào sừng, đã được chứng minh là có tác dụng đẩy nhanh quá trình chữa lành khi bôi lên vết thương mãn tính [81]. Mẫu tái tạo da Integra® (Integra LifeSciences, Plainsboro, NJ) là một hai lớp silicone biểu bì phủ lên một chất nền collagen da bò và chondroitin-6-sulfat, được bán trên thị trường và đã đạt được thành công đáng kể trong việc điều trị các vấn đề như bỏng nguy hiểm đến tính mạng, co rút sau bỏng, và lộ gân và khớp [82, 83].
4.5 Lý sinh
4.5.1 Trị liệu vết thương bằng áp lực âm
Trị liệu vết thương bằng áp lực âm (Negative pressure wound therapy, NPWT), được mô tả lần đầu tiên cách đây 20 năm, là một thuật ngữ rộng được sử dụng để định nghĩa bất kỳ công nghệ nào được thiết kế để tạo thành một lớp khí kín xung quanh vết thương cho phép ứng dụng chân không [84]. Áp suất âm là một tên gọi sai vì tất cả các giá trị áp suất đều dương và còn được gọi là phương pháp đóng hỗ trợ chân không (VAC), liệu pháp áp suất dưới khí quyển, hoặc liệu pháp vết thương vi cấu trúc. NPWT có nhiều chỉ định, bao gồm cả vết thương cấp tính và mãn tính, như bỏng và loét do tiểu đường và áp lực [85]. Công nghệ này sử dụng vật liệu xốp, thoát nước và lớp film dính. Vật liệu xốp có thể là bọt hoặc gạc, được sử dụng để lấp đầy vết thương và cho phép truyền áp lực một cách đồng đều. Cổng được kết nối với vật liệu này và với một máy bơm chân không được đặt để duy trì áp suất từ -50 đến -150 mmHg [86]. Băng được thiết kế để tạo thành một miếng đệm khí kín xung quanh vết thương.
NPWT được đề xuất hoạt động thông qua bốn cơ chế chính. Đầu tiên, các mép vết thương có thể được đặt tốt hơn thông qua định dạng vĩ mô, trong đó lực hút được áp dụng làm cho lớp foam co lại kéo các mép vết thương lại gần nhau hơn. Ngoài sự thay đổi vĩ mô này, lực hút trên lớp foam gây ra những biến đổi vi định dạng dẫn đến sự uốn lượn của bề mặt vết thương. Ngoài việc thúc đẩy vị trí tốt hơn của các mép vết thương, biến dạng vi mô còn kích thích sự hình thành mạch và điều hòa mô hạt [86, 87]. Thứ ba, NPWT có thể dẫn đến việc loại bỏ chất lỏng khỏi vết thương, làm giảm lực nén tác động lên nền vết thương và thúc đẩy quá trình lưu thông mạch máu và tưới máu mô tốt hơn [84]. Cuối cùng, NPWT có thể gây ra sự thay đổi tổng thể trong môi trường vết thương. Điều này không có gì đáng ngạc nhiên, vì có dịch chảy ra khỏi vết thương và do đó làm thay đổi nồng độ cục bộ của chất điện giải và chất dinh dưỡng. Ngoài ra, chất liệu phủ đóng vai trò như vật liệu cách nhiệt, giữ cho vết thương ẩm và ấm [86].
Một tổng quan tài liệu gần đây đã so sánh hiệu quả của NPWT so với liệu pháp tiêu chuẩn dựa trên kết quả của các thử nghiệm ngẫu nhiên có đối chứng [88]. Kết luận chung là công nghệ vừa an toàn vừa hiệu quả trong việc giảm nhu cầu can thiệp phẫu thuật ở bệnh nhân đái tháo đường [89–91], đồng thời giảm viêm và phù nề khi được sử dụng với các mảnh ghép da dày, chuẩn bị hoặc sau phẫu thuật [92– 94]. Hơn nữa, tỷ lệ nhiễm trùng giảm được thấy ở các vết thương do chấn thương [95].
4.5.2 Sự hình thành da được hỗ trợ bởi lực kéo
Hình thành da được hỗ trợ bởi lực kéo là một kỹ thuật mở rộng mô không xâm lấn, được phát triển bởi Daya và Nair một thập kỷ trước. Trong kỹ thuật này, một loạt băng Micropore (3M, St. Paul, MN) được dán lên da trong một thời gian dài. Thông qua lực căng không liên tục của da, mô sẽ trải qua quá trình giãn nở thông qua việc tạo ra mô mới. Không giống như máy làm giãn mô và thiết bị kéo căng da, quá trình hình thành da được hỗ trợ bởi lực kéo không xâm lấn và do đó mang lại lợi thế là dễ dàng hơn và rẻ hơn [96].
Tài liệu tham khảo
1. Manring MM, Hawk A, Calhoun JH, Andersen RC. Treatment of war wounds: a historical review.
Clin Orthop Relat Res. 2009;467(8):2168–91.
2. Feinglass J, Pearce WH, Martin GJ, Gibbs J, Cowper D, Sorensen M, et al. Postoperative and late
survival outcomes after major amputation: findings from the Department of Veterans Affairs
National Surgical Quality Improvement Program. Surgery. 2001;130(1):21–9.
3. Aulivola B, Hile CN, Hamdan AD, Sheahan MG, Veraldi JR, Skillman JJ, et al. Major lower
extremity amputation: outcome of a modern series. Arch Surg. 2004;139(4):395–9. discussion 9.
4. Bayat A, McGrouther DA, Ferguson MW. Skin scarring. BMJ. 2003;326(7380):88–92.
5. Lawrence JW, Mason ST, Schomer K, Klein MB. Epidemiology and impact of scarring after burn
injury: a systematic review of the literature. J Burn Care Res. 2012;33(1):136–46.
6. Auden WH, Mendelson E. Collected poems. London: Faber and Faber; 1976. p. 696.
7. Kumar V, Abbas AK, Aster JC. Robbins and Cotran pathologic basis of disease. 9th ed. Philadelphia,
PA: Elsevier/Saunders; 2015. xvi, p. 1391.
8. Goldberg AL, Etlinger JD, Goldspink DF, Jablecki C. Mechanism of work-induced hypertrophy of
skeletal muscle. Med Sci Sports. 1975;7(3):185–98.
9. Michalopoulos GK. Liver regeneration. J Cell Physiol. 2007;213(2):286–300.
10. Ohsumi Y. Historical landmarks of autophagy research. Cell Res.2014;24(1):9–23.
11. Wheeler JB, Reed CE. Epidemiology of esophageal cancer. Surg Clin North Am. 2012;92(5):1077–
87.
12. Mik G, Gholve PA, Scher DM, Widmann RF, Green DW. Down syndrome: orthopedic issues. Curr
Opin Pediatr. 2008;20(1):30–6.
13. Wada T, Tone Y, Shibata F, Toma T, Yachie A. Delayed wound healing in leukocyte adhesion
deficiency type 1. J Pediatr. 2011;158(2):342.
14. Gould L, Abadir P, Brem H, Carter M, Conner-Kerr T, Davidson J, et al. Chronic wound repair
and healing in older adults: current status and future research. J Am Geriatr Soc. 2015;63(3):427–
38.
15. Kurosaka M, Suzuki T, Hosono K, Kamata Y, Fukamizu A, Kitasato H, et al. Reduced angiogenesis
and delay in wound healing in angio-tensin II type 1a receptor-deficient mice. Biomed
Pharmacother. 2009;63(9):627–34.
16. Thorne C, Chung KC, Gosain A, Guntner GC, Mehrara BJ, Rubin JP, Spear SL, editors. Grabb and
Smith’s plastic surgery. 7th ed. Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins
Health; 2014. xbiii, p. 1030.
17. Gottrup F. Oxygen in wound healing and infection. World J Surg. 2004;28(3):312–5.
18. Prockop DJ, Kivirikko KI, Tuderman L, Guzman NA. The biosyn-thesis of collagen and its
disorders (first of two parts). N Engl J Med. 1979;301(1):13–23.
19. Prockop DJ, Kivirikko KI, Tuderman L, Guzman NA. The biosyn-thesis of collagen and its
disorders (second of two parts). N Engl J Med. 1979;301(2):77–85.
20. Vihersaari T, Kivisaari J, Ninikoski J. Effect of changes in inspired oxygen tension on wound
metabolism. Ann Surg. 1974;179(6):889–95.
21. Jonsson K, Hunt TK, Mathes SJ. Oxygen as an isolated variable influences resistance to infection.
Ann Surg. 1988;208(6):783–7.
22. Shweiki D, Itin A, Soffer D, Keshet E. Vascular endothelial growth factor induced by hypoxia may
mediate hypoxia-initiated angio-genesis. Nature. 1992;359(6398):843–5.
23. Semenza GL. HIF-1 and human disease: one highly involved factor. Genes Dev.
2000;14(16):1983–91.
24. Mader JT, Brown GL, Guckian JC, Wells CH, Reinarz JA. A mechanism for the amelioration by
hyperbaric oxygen of experi-mental staphylococcal osteomyelitis in rabbits. J Infect Dis.
1980;142(6):915–22.
25. Rodriguez PG, Felix FN, Woodley DT, Shim EK. The role of oxygen in wound healing: a review
of the literature. Dermatol Surg. 2008;34(9):1159–69.
26. Bishop A. Role of oxygen in wound healing. J Wound Care. 2008;17(9):399–402.
27. Wu P, Nelson EA, Reid WH, Ruckley CV, Gaylor JD. Water vapour transmission rates in burns
and chronic leg ulcers: influence of wound dressings and comparison with in vitro evaluation.
Biomaterials. 1996;17(14):1373–7.
28. Junker JP, Kamel RA, Caterson EJ, Eriksson E. Clinical impact upon wound healing and
inflammation in moist, wet, and dry environments. Adv Wound Care (New Rochelle).
2013;2(7):348–56.
29. Madden MR, Nolan E, Finkelstein JL, Yurt RW, Smeland J, Goodwin CW, et al. Comparison of
an occlusive and a semi-occlusive dressing and the effect of the wound exudate upon keratinocyte
proliferation. J Trauma. 1989;29(7):924–30. Discussion 30-1.
30. Svensjo T, Pomahac B, Yao F, Slama J, Eriksson E. Accelerated healing of full-thickness skin
wounds in a wet environment. Plast Reconstr Surg. 2000;106(3):602–12. discussion 13-4.
31. Winter GD. Formation of the scab and the rate of epithelization of superficial wounds in the skin
of the young domestic pig. Nature. 1962;193:293–4.
32. Eaglstein WH. Moist wound healing with occlusive dressings: a clinical focus. Dermatol Surg.
2001;27(2):175–81.
33. Katz MH, Alvarez AF, Kirsner RS, Eaglstein WH, Falanga V. Human wound fluid from acute
wounds stimulates fibroblast and endothelial cell growth. J Am Acad Dermatol. 1991;25(6 Pt
1):1054–8.
34. Field FK, Kerstein MD. Overview of wound healing in a moist environment. Am J Surg.
1994;167(1A):2S–6S.
35. Wilmore DW, Aulick LH, Mason AD, Pruitt BA Jr. Influence of the burn wound on local and
systemic responses to injury. Ann Surg. 1977;186(4):444–58.
36. Kruse CR, Nuutila K, Lee CC, Kiwanuka E, Singh M, Caterson EJ, et al. The external
microenvironment of healing skin wounds. Wound Repair Regen. 2015;23(4):456–64.
37. Fierheller M, Sibbald RG. A clinical investigation into the relationship between increased
periwound skin temperature and local wound infection in patients with chronic leg ulcers. Adv
Skin Wound Care. 2010;23(8):369–79. quiz 80-1.
38. Robson MC, Krizek TJ, Heggers JP. Biology of surgical infection. Curr Probl Surg. 1973;10:1–62.
39. Edwards R, Harding KG. Bacteria and wound healing. Curr Opin Infect Dis. 2004;17(2):91–6.
40. Lambers H, Piessens S, Bloem A, Pronk H, Finkel P. Natural skin surface pH is on average below
5, which is beneficial for its resident flora. Int J Cosmet Sci. 2006;28(5):359–70.
41. Schreml S, Szeimies RM, Karrer S, Heinlin J, Landthaler M, Babilas P. The impact of the pH value
on skin integrity and cutaneous wound healing. J Eur Acad Dermatol Venereol. 2010;24(4):373–
8.
42. Lengheden A, Jansson L. pH effects on experimental wound healing of human fibroblasts in vitro.
Eur J Oral Sci. 1995;103(3):148–55.
43. Stewart CM, Cole MB, Legan JD, Slade L, Vandeven MH, Schaffner DW. Staphylococcus aureus
growth boundaries: moving towards mechanistic predictive models based on solute-specific
effects. Appl Environ Microbiol. 2002;68(4):1864–71.
44. Menke NB, Ward KR, Witten TM, Bonchev DG, Diegelmann RF. Impaired wound healing. Clin
Dermatol. 2007;25(1):19–25.
45. Hettrick H. The science of compression therapy for chronic venous insufficiency edema. J Am Col
Certif Wound Spec. 2009;1(1):20–4.
46. Pinchcofsky-Devin G. Nutrition and wound healing. J Wound Care. 1994;3(5):231–4.
47. Pompeo M. Misconceptions about protein requirements for wound healing: results of a prospective
study. Ostomy Wound Manage. 2007;53(8):30–2. 4, 6–8 passim.
48. Loots MA, Lamme EN, Zeegelaar J, Mekkes JR, Bos JD, Middelkoop E. Differences in cellular
infiltrate and extracellular matrix of chronic diabetic and venous ulcers versus acute wounds. J
Invest Dermatol. 1998;111(5):850–7.
49. Mirastschijski U, Haaksma CJ, Tomasek JJ, Agren MS. Matrix metalloproteinase inhibitor GM
6001 attenuates keratinocyte migration, contraction and myofibroblast formation in skin wounds.
Exp Cell Res. 2004;299(2):465–75.
50. Guo S, Dipietro LA. Factors affecting wound healing. J Dent Res. 2010;89(3):219–29.
51. Burgess C. Topical vitamins. J Drugs Dermatol. 2008;7(7 Suppl):s2–6.
52. Wilson JA, Clark JJ. Obesity: impediment to postsurgical wound healing. Adv Skin Wound Care.
2004;17(8):426–35.
53. Pierpont YN, Dinh TP, Salas RE, Johnson EL, Wright TG, Robson MC, et al. Obesity and surgical
wound healing: a current review. ISRN Obes. 2014;2014:638936.
54. Juge-Aubry CE, Henrichot E, Meier CA. Adipose tissue: a regulator of inflammation. Best Pract
Res Clin Endocrinol Metab. 2005;19(4):547–66.
55. Wahie S, Lawrence CM. Wound complications following diagnostic skin biopsies in dermatology
inpatients. Arch Dermatol. 2007;143(10):1267–71.
56. Goldminz D, Bennett RG. Cigarette smoking and flap and full-thickness graft necrosis. Arch
Dermatol. 1991;127(7):1012–5.
57. Jensen JA, Goodson WH, Hopf HW, Hunt TK. Cigarette smoking decreases tissue oxygen. Arch
Surg. 1991;126(9):1131–4.
58. Wennmalm A, Alster P. Nicotine inhibits vascular prostacyclin but not platelet thromboxane
formation. Gen Pharmacol. 1983;14(1):189–91.
59. Greiffenstein P, Molina PE. Alcohol-induced alterations on host defense after traumatic injury. J
Trauma. 2008;64(1):230–40.
60. Radek KA, Matthies AM, Burns AL, Heinrich SA, Kovacs EJ, Dipietro LA. Acute ethanol
exposure impairs angiogenesis and the proliferative phase of wound healing. Am J Physiol Heart
Circ Physiol. 2005;289(3):H1084–90.
61. Radek KA, Ranzer MJ, DiPietro LA. Brewing complications: the effect of acute ethanol exposure
on wound healing. J Leukoc Biol. 2009;86(5):1125–34.
62. Wicke C, Halliday B, Allen D, Roche NS, Scheuenstuhl H, Spencer MM, et al. Effects of steroids
and retinoids on wound healing. Arch Surg. 2000;135(11):1265–70.
63. Wagner AE, Huck G, Stiehl DP, Jelkmann W, Hellwig-Burgel T. Dexamethasone impairs hypoxia-
inducible factor-1 function. Biochem Biophys Res Commun. 2008;372(2):336–40.
64. McShane DB, Bellet JS. Treatment of hypergranulation tissue with high potency topical
corticosteroids in children. Pediatr Dermatol. 2012;29(5):675–8.
65. Steed DL, Donohoe D, Webster MW, Lindsley L. Effect of extensive debridement and treatment
on the healing of diabetic foot ulcers. Diabetic Ulcer Study Group. J Am Coll Surg.
1996;183(1):61–4.
66. Schiffman J, Golinko MS, Yan A, Flattau A, Tomic-Canic M, Brem H. Operative debridement of
pressure ulcers. World J Surg. 2009;33(7):1396–402.
67. Brem H, Stojadinovic O, Diegelmann RF, Entero H, Lee B, Pastar I, et al. Molecular markers in
patients with chronic wounds to guide surgical debridement. Mol Med. 2007;13(1–2):30–9.
68. Baranoski S, Ayello EA. Wound care essentials: practice principles. 4th ed. Philadelphia: Wolters
Kluwer; 2016. xiv, p. 593.
69. Murphy PS, Evans GR. Advances in wound healing: a review of current wound healing products.
Plast Surg Int. 2012;2012:190436.
70. Dhivya S, Padma VV, Santhini E. Wound dressings: a review. Biomedicine (Taipei). 2015;5(4):22.
71. Ramshaw JA, Werkmeister JA, Glattauer V. Collagen-based biomaterials. Biotechnol Genet Eng
Rev. 1996;13:335–82.
72. Ishihara M, Nakanishi K, Ono K, Sato M, Kikuchi M, Saito Y, et al. Photocrosslinkable chitosan
as a dressing for wound occlusion and accelerator in healing process. Biomaterials.
2002;23(3):833–40.
73. Doillon CJ, Silver FH. Collagen-based wound dressing: effects of hyaluronic acid and fibronectin
on wound healing. Biomaterials. 1986;7(1):3–8.
74. Wieman TJ. Clinical efficacy of becaplermin (rhPDGF-BB) gel. Becaplermin Gel Studies Group.
Am J Surg. 1998;176(2A Suppl):74S–9S.
75. Heldin CH, Westermark B. Mechanism of action and in vivo role of platelet-derived growth factor.
Physiol Rev. 1999;79(4):1283–316.
76. Greer N, Foman N, Dorrian J, Fitzgerald P, MacDonald R, Rutks I, et al. Advanced wound care
therapies for non-healing diabetic, venous, and arterial ulcers: a systematic review. VA evidence-
based synthesis program reports. Washington, DC; 2012.
77. Robson MC, Phillips TJ, Falanga V, Odenheimer DJ, Parish LC, Jensen JL, et al. Randomized trial
of topically applied repifermin (recombinant human keratinocyte growth factor-2) to accelerate
wound healing in venous ulcers. Wound Repair Regen. 2001;9(5):347–52.
78. Duzgun AP, Satir HZ, Ozozan O, Saylam B, Kulah B, Coskun F. Effect of hyperbaric oxygen
therapy on healing of diabetic foot ulcers. J Foot Ankle Surg. 2008;47(6):515–9.
79. Londahl M, Katzman P, Nilsson A, Hammarlund C. Hyperbaric oxygen therapy facilitates healing
of chronic foot ulcers in patients with diabetes. Diabetes Care. 2010;33(5):998–1003.
80. Kalani M, Jorneskog G, Naderi N, Lind F, Brismar K. Hyperbaric oxygen (HBO) therapy in
treatment of diabetic foot ulcers. Long-term follow-up. J Diabetes Complications.
2002;16(2):153–8.
81. Falanga V, Sabolinski M. A bilayered living skin construct (APLIGRAF) accelerates complete
closure of hard-to-heal venous ulcers. Wound Repair Regen. 1999;7(4):201–7.
82. Jones I, Currie L, Martin R. A guide to biological skin substitutes. Br J Plast Surg. 2002;55(3):185–
93.
83. Fitton AR, Drew P, Dickson WA. The use of a bilaminate artificial skin substitute (Integra) in acute
resurfacing of burns: an early experience. Br J Plast Surg. 2001;54(3):208–12.
84. Argenta LC, Morykwas MJ. Vacuum-assisted closure: a new method for wound control and
treatment: clinical experience. Ann Plast Surg. 1997;38(6):563–76. discussion 77.
85. Panayi AC, Leavitt T, Orgill DP. Evidence based review of negative pressure wound therapy.
World J Dermatol. 2017;6(1):1–16.
86. Huang C, Leavitt T, Bayer LR, Orgill DP. Effect of negative pressure wound therapy on wound
healing. Curr Probl Surg. 2014;51(7):301–31.
87. Urschel JD, Scott PG, Williams HT. The effect of mechanical stress on soft and hard tissue repair;
a review. Br J Plast Surg. 1988;41(2):182–6.
88. Anghel EL, Kim PJ. Negative-pressure wound therapy: a comprehensive review of the evidence.
Plast Reconstr Surg. 2016;138(3 Suppl):129S–37S.
89. Stannard JP, Volgas DA, McGwin G 3rd, Stewart RL, Obremskey W, Moore T, et al. Incisional
negative pressure wound therapy after high-risk lower extremity fractures. J Orthop Trauma.
2012;26(1):37–42.
90. Masden D, Goldstein J, Endara M, Xu K, Steinberg J, Attinger C. Negative pressure wound therapy
for at-risk surgical closures in patients with multiple comorbidities: a prospective randomized
controlled study. Ann Surg. 2012;255(6):1043–7.
91. Gillespie BM, Rickard CM, Thalib L, Kang E, Finigan T, Homer A, et al. Use of negative-pressure
wound dressings to prevent surgical site complications after primary hip arthroplasty: a pilot RCT.
Surg Innov. 2015;22(5):488–95.
92. Saaiq M, Hameed Ud D, Khan MI, Chaudhery SM. Vacuum-assisted closure therapy as a
pretreatment for split thickness skin grafts. J Coll Physicians Surg Pak. 2010;20(10):675–9.
93. Petkar KS, Dhanraj P, Kingsly PM, Sreekar H, Lakshmanarao A, Lamba S, et al. A prospective
randomized controlled trial comparing negative pressure dressing and conventional dressing
methods on split-thickness skin grafts in burned patients. Burns. 2011;37(6):925–9.
94. Bloemen MC, van der Wal MB, Verhaegen PD, Nieuwenhuis MK, van Baar ME, van Zuijlen PP,
et al. Clinical effectiveness of dermal substitution in burns by topical negative pressure: a
multicenter randomized controlled trial. Wound Repair Regen. 2012;20(6):797–805.
95. Eisenhardt SU, Schmidt Y, Thiele JR, Iblher N, Penna V, Torio- Padron N, et al. Negative pressure
wound therapy reduces the isch-aemia/reperfusion-associated inflammatory response in free
muscle flaps. J Plast Reconstr Aesthet Surg. 2012;65(5):640–9.
96. Daya M, Nair V. Traction-assisted dermatogenesis by serial intermittent skin tape application. Plast
Reconstr Surg. 2008;122(4):1047–54.