Tác giả: Haig A. Yenikomshian và Nicole S. Gibran
Dịch: Bs. Trương Tấn Minh Vũ
Sinh lý bệnh lành thương và hình thành sẹo do bỏng
Xin mời bạn đọc tải bản đầy đủ Sinh lý bệnh lành thương và hình thành sẹo do bỏng tại đây
Đánh giá ban đầu về độ sâu vết bỏng
Tổn thương bỏng là kết quả của nhiều yếu tố tác động bao gồm cơ chế nhiệt và không nhiệt. Lửa, chất lỏng, lạnh quá mức, điện và bức xạ làm ảnh hưởng đến mô. Mô tả độ sâu vết bỏng và diện tích bề mặt liên quan rất quan trọng đối với bác sĩ để tính toán dinh dưỡng và hồi sức cũng như lập kế hoạch phẫu thuật. Năm 1832, Nam tước Guillaume Dupuytren đã mô tả sáu độ sâu của vết bỏng [1]. Vết bỏng cấp độ một gồm đỏ da mà không hình thành bóng nước. Bỏng cấp độ hai liên quan đến tình trạng viêm da với mất lớp biểu bì và phát triển các mụn nước chứa đầy huyết thanh. Bỏng độ ba gồm toàn bộ lớp bì. Bỏng độ 4 liên quan đến tổn thương nhiệt vào mô dưới da. Bỏng độ 5 mở rộng tới lớp cơ. Cuối cùng, bỏng độ 6 liên quan đến tổn thương nhiệt tới xương. The International Classification of Disease (ICD) đơn giản hóa thành hệ thống bỏng gồm cấp độ một, cấp độ hai và cấp độ thứ ba [2]. Trong hệ thống này, bỏng cấp độ một ảnh hưởng đến lớp biểu bì tương tự như bậc của Dupuytren 1. Bỏng cấp độ hai là sâu một phần qua lớp bì, tương ứng với bậc 2. Cuối cùng, bỏng cấp độ ba liên quan đến sự phá hủy nhiệt của toàn bộ lớp bì hoặc bậc 3–6 trong mô tả ban đầu của Dupuytren.
Bỏng có thể được phân loại theo cách khác của Jackson theo ba vùng tổn thương bỏng [3]. Vùng rìa ngoài ít tổn thương là vùng xung huyết, có đặc điểm là giãn mạch, tăng lưu lượng máu và viêm. Vùng này tương đương với bỏng cấp độ một và thường có thể sống được và tiến triển lành thương [4]. Vùng giữa là vùng thiếu máu cục bộ, có sự tưới máu mô giới hạn với mô có thể cứu được tùy thuộc vào các yếu tố toàn thân như hồi sức đầy đủ, nhiễm trùng và bệnh đi kèm. Vùng này ban đầu sẽ trắng khi có áp lực, nhưng có thể xuất hiện lốm đốm và đỏ [4]. Vùng này tương đương với tổn thương bỏng ở mức độ hai và có thể tiến triển lành thương hoặc có thể chuyển thành bỏng toàn bộ do quá
trình chết tế bào apoptosis và stress oxy hóa [5]. Cuối cùng là vùng đông đặc ở trung tâm, vùng bị tổn thương nhiệt nhiều nhất, tương quan với tổn thương bỏng độ 3 đến độ 6. Đây là vùng biến tính protein và tế bào bị phá vỡ thứ phát sau tác động nhiệt ban đầu dẫn đến đông đặc và hoại tử mô. Nói chung, vùng trung tâm này sẽ không lành nếu không cắt bỏ.
Các giai đoạn lành thương cấp tính
Nghiên cứu còn hạn chế về đáp ứng với chấn thương nhiệt so với các vết thương do cắt hoặc rạch khác nhưng tính liên tục của các giai đoạn lành thương từ đông đặc, hình thành mạch viêm, biểu mô hóa và cuối cùng là sửa chữa chất nền là tương tự nhau [6]. Đối với mỗi giai đoạn lành thương, sự di chuyển của tế bào xảy ra thông qua một cơ chế điều hòa cân bằng phức tạp bởi các yếu tố tăng trưởng cytokine, integrin và metalloproteases [7]. Giai đoạn đầu của tổn thương nhiệt đối với các mô liên quan đến việc kích hoạt quá trình cầm máu [8]. Quá trình đông máu được kích hoạt bởi yếu tố mô, dẫn đến sự phân cắt fibrinogen thành fibrin và hình thành cục máu đông. Cùng lúc với chấn thương ban đầu, sự co mạch được trung gian bởi catecholamine để hỗ trợ cầm máu và kết tập tiểu cầu. Sau đó, sự giãn mạch giúp hỗ trợ việc thu nhận các tế bào viêm vào nền vết thương [9]. Sự di chuyển xảy ra thông qua một điều hoà phức tạp bởi ba yếu tố chính: yếu tố tăng trưởng, integrin và metalloproteases [10].
Các tế bào viêm bao gồm bạch cầu trung tính, đại thực bào và nguyên bào sợi di chuyển đến nền vết thương và tiết ra cytokine như một phần của “giai đoạn viêm” thứ hai của quá trình lành thương, với việc thu nhận thêm các tế bào viêm cũng như nguyên bào sợi. Bạch cầu trung tính chiếm ưu thế ở nền vết thương ban đầu và đại thực bào trở nên ưu thế hơn vào ngày thứ 3 [11]. Các đại thực bào giải phóng nhiều loại cytokine bao gồm yếu tố tăng trưởng có nguồn gốc từ tiểu cầu (platelet-derived growth factor, PDGF), yếu tố tăng trưởng giống insulin (insulin-like growth factor, IGF-1), và yếu tố tăng trưởng biến đổi beta (transforming growth factor beta, TGF-β) [12]. Đại thực bào có thể được chia nhỏ thành hai loại: đại thực bào kiểu ức chế (M1) tham gia vào quá trình bảo vệ vật chủ chính và đại thực bào kiểu chữa lành (M2) tham gia vào quá trình lành thương [13]. Bạch cầu trung tính cũng giải phóng các cytokine bao gồm VEGF để thúc đẩy quá trình hình thành mạch ở nền vết thương [14].
Sự tái tạo biểu bì xảy ra trong giai đoạn tăng sinh của quá trình lành thương. Tế bào sừng, các tế bào cấu trúc chính và viêm của biểu bì, bắt nguồn từ lớp đáy của biểu bì và các phần phụ của biểu bì gồm các nang lông và ống mồ hôi. Quá trình biểu mô hoá liên quan đến sự tăng sinh tế bào sừng và di chuyển từ mép vết thương, nang lông, tuyến mồ hôi và tuyến bã nhờn ở những vết thương với một phần độ dày da; các vết thương với toàn độ dày da phụ thuộc hoàn toàn vào sự di chuyển của tế bào từ các mép vết thương [15]. Về mặt cơ học, các tế bào sừng di chuyển bằng cách tháo rời các hemidesmosomes
và desmosomes, đồng thời co lại và sửa chữa các sợi nội bào [16]. Tế bào sừng màng đáy sau đó di chuyển bề mặt và biệt hóa ở giai đoạn cuối thành tế bào coenocyte mất nhân và các bào quan bên trong trở thành hàng rào bảo vệ chống lại nhiễm trùng và những hao tổn ít nhận thấy được [17]. Trong quá trình lành thương, tế bào sừng và nguyên bào sợi điều chỉnh hai chiều quá trình lành thương và sửa chữa sẹo [18]. Các nền vết thương được biểu mô hóa hoàn toàn như vị trí lấy mô da và mô ghép da đã lành vẫn dễ bị phồng rộp vì quá trình tổ chức lại vùng màng đáy của biểu bì bị khiếm khuyết với tổ chức nguyên bào sợi bị khiếm khuyết [19].
Nguyên bào sợi trở thành tế bào chiếm ưu thế trong trung mô nền vết thương trong “giai đoạn tăng sinh”. Các tế bào hình thái này tổng hợp các collagens và các phân tử glycosaminoglycans khác và phối hợp chuyển đổi nền vết thương cấp tính thành chất nền ngoại bào sẹo [20]. Mô hạt có nhiều mạch máu được hình thành trong giai đoạn này bao gồm các nguyên bào sợi, tế bào viêm và tế bào nội mô mạch máu. Các mao mạch thấm qua mô hạt vào chất nền ngoại bào đang hình thành. Các phân tử tiết ra từ các tế bào viêm bao gồm VEGF, TGF-β, và angiopoietin có tác dụng tạo mạch và thúc đẩy sự hình thành mạch và tăng trưởng của hệ mạch vào vết thương [21]. Trong khi mô hạt cho thấy nền vết thương khoẻ mạnh, số lượng tế bào viêm và vi khuẩn gia tăng cùng với hàm lượng metalloprotease cao đòi hỏi mô hạt phải được cắt bỏ trước khi ghép. Hơn nữa, lớp trao đổi chất phong phú này có lẽ là tiền đề cho sự hình thành sẹo do tăng sinh mô sợi [22, 23].
“Giai đoạn sửa chữa” cuối cùng của quá trình lành thương trong đó các nguyên bào sợi biến đổi chất nền vết thương cấp tính thành một nền sẹo trưởng thành có thể kéo dài trong vài năm tùy thuộc vào mức độ tổn thương mô bên dưới [24]. Nguyên bào sợi có kiểu hình giống tế bào cơ trơn, được gọi là nguyên bào sợi cơ [25, 26]. Các tế bào này thay thế collagen loại III bằng collagen loại I [9]. Thông qua quá trình sửa chữa này, mô hạt được thay thế bằng sẹo và sự điều hòa của chất nền ngoại bào dẫn đến co thắt vết thương [27]. Bất chấp sự sửa chữa này, độ bền sức căng của sẹo sẽ chỉ bằng khoảng 70% độ bền của trạng thái trước khi bị thương [28].
Sự hiểu biết ngày càng tăng của chúng ta về vai trò của tế bào gốc trung mô từ tủy xương và tế bào gốc mô mỡ trong việc lành thương có thể thay đổi cách chúng ta cân nhắc việc lành thương tái tạo hơn là lành thương sửa chữa[29]. Tế bào trung mô có nguồn gốc từ tủy xương là đa năng có thể chuyển đổi thành các loại mô khác nhau bao gồm da, mỡ và xương [30]. Tiêm tế bào gốc trung mô có nguồn gốc từ tủy xương trên mô hình chuột làm tăng các yếu tố tiền tạo mạch [31]. Tế bào gốc có nguồn gốc từ mỡ cũng đã được chứng minh là có khả năng kích hoạt tế bào sừng và nguyên bào sợi ở da [32]. Việc sử dụng các tế bào gốc này để tái tạo da cho thấy nhiều hứa hẹn nhưng vẫn chưa thành hiện thực trong thực tế.
Sinh lý bệnh sẹo phì đại
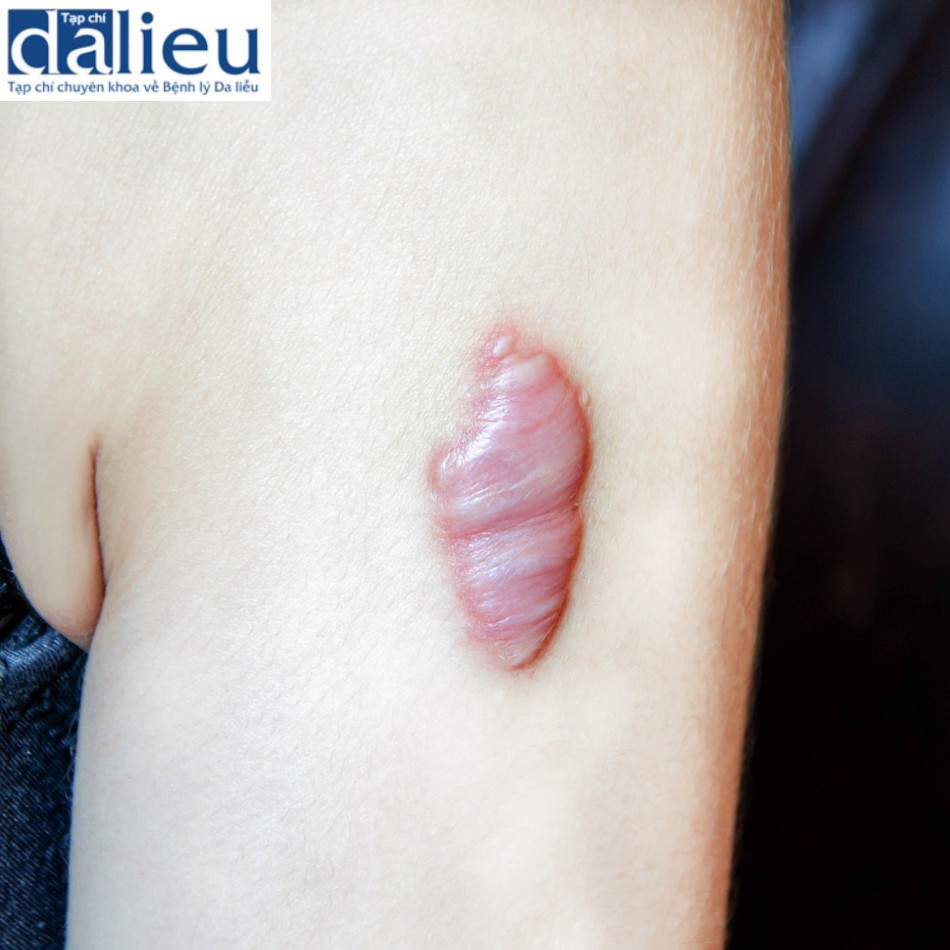
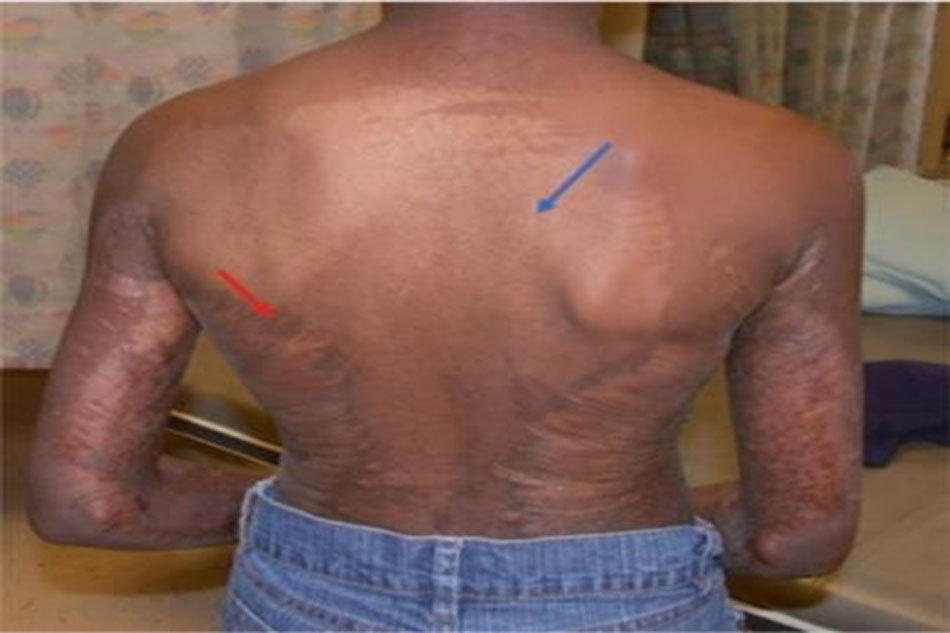
Di chứng bỏng có thể gây suy nhược cho những người sống chung với vết thương do bỏng và gây khó chịu cho nhóm người bị bỏng. Một vấn đề thường gặp sau chấn thương nhiệt là sẹo phì đại: một vết sẹo dày cứng, nhô cao, đỏ và gây đau. Hình 2.1 mô tả một sẹo phì đại của phía trên tay trái và hạ sườn trái. Sinh lý bệnh ít được biết đến của sẹo phì đại đã là một lĩnh vực được tập trung nghiên cứu trong 40 năm qua. Sự tăng sinh của mô sợi bao gồm một đáp ứng bất thường đối với quá trình lành thương. Cả sẹo phì đại và sẹo lồi là kết quả của đáp ứng viêm thái quá và có thể khó phân biệt trên khám lâm sàng. Một điểm khác biệt chính là sẹo phì đại vẫn nằm trong ranh giới của vết thương ban đầu trong khi sẹo lồi mở rộng ra ngoài [33]. Về mặt mô học, sẹo lồi có các bó collagen dày bạch cầu ái toan trong khi sẹo phì đại thì không; tuy nhiên, nhiều sẹo có thể biểu hiện với hình ảnh hỗn hợp [34]. Hầu hết các vết sẹo tăng sinh mô sợi sau chấn thương bỏng hoặc sẹo phì đại tại vị trí lấy mô ghép.
Đánh giá khách quan về mức độ nghiêm trọng của sẹo phì đại thách thức các bác sĩ. Một công cụ đo lường xác thực giá trị để xác định mức độ sẹo sẽ là điều cần thiết cho các bác sĩ và bệnh nhân để hướng dẫn điều trị và đánh giá hiệu quả điều trị theo thời gian [35]. Hai thang đo hiện có bao gồm thang điểm sẹo Vancouver (VSS) và thang đánh giá sẹo cho bệnh nhân quan sát (POSAS), kết hợp cả các đo lường khách quan và chủ quan để đánh giá sẹo [36]. Trong khi các thang điểm này được sử dụng rộng rãi cho các thử nghiệm lâm sàng, có sự khác nhau về mức độ được định nghĩa là sẹo phì đại và độ thâm nhập của các thang điểm khác nhau [37, 38].
Sinh lý bệnh của sẹo
Nguyên bào sợi, tế bào chính chịu trách nhiệm lắng đọng collagen và sửa chữa sẹo bỏng theo thời gian, khác nhau giữa các cá nhân cũng như theo vị trí cơ thể và độ sâu của da [39]. Nguyên bào sợi ở lớp bì lưới sâu đáp ứng với tổn thương khác với tế bào ở lớp bì nhú nông hơn, bao gồm giải phóng Il-6 và IFN-gamma một cách hệ thống hơn [40]. Các nguyên bào sợi sâu này được tìm thấy sớm trong quá trình lành vết thương trong mô hạt [41]. Trong quá trình lành thương bình thường, các tế bào sừng điều chỉnh các nguyên bào sợi ở da, và khi mất biểu mô, sự cân bằng này sẽ mất đi với sự điều tiết của các cytokine gây viêm [18]. Phản ứng viêm càng nặng thì phản ứng nguyên bào sợi càng dữ dội với nguy cơ hình thành sẹo phì đại càng cao [42].
Một trong những cytokine chính liên quan đến sẹo phì đại là TGF-β, một chất hoạt hóa mạnh của nguyên bào sợi [43]. Các sẹo phì đại có mức TGF-β mRNA tăng lên trong khi các vết thương ở thai nhi lành mà không để lại sẹo thì mức độ giảm rõ rệt [44]. TGF- β điều chỉnh proteoglycan nền ngoại bào, và sẹo phì đại có mức decorin thấp hơn nhưng mức versican và biglycan cao hơn [45]. Sản xuất tăng nồng độ TGF-β có thể do mất ức chế theo các con đường khác. IFN-α và IFN-γ hoạt động để điều chỉnh giảm TGF-β bằng cách điều chỉnh sản xuất mRNA; sai sót trên con đường này cũng được phát hiện là nguyên nhân gây ra sẹo phì đại [44].
Sự điều biến thần kinh đối với các phản ứng với chấn thương đại diện cho một lĩnh vực chưa được nghiên cứu kỹ lưỡng. Neuropeptides điều chỉnh một số quá trình tế bào quan trọng đối với việc lành vết thương, bao gồm di chuyển tế bào viêm, hình thành mạch, di chuyển tế bào sừng và thoái hóa tế bào mast. Chất P, được giải phóng trong các vết thương và viêm cấp tính, gây viêm và làm trung gian hình thành mạch [46]. Quá ít chất P, như được tìm thấy trong vết thương của bệnh tiểu đường, dẫn đến vết thương mãn tính và kém lành, và quá nhiều dẫn đến tình trạng tăng viêm và sẹo phì đại [47]. Sự điều biến thần kinh không bình thường trong quá trình lành vết thương cũng biểu hiện như đau và ngứa do bệnh lý thần kinh. Khoảng 75% bệnh nhân phàn nàn về cơn đau giống như bệnh thần kinh trong hàng tháng sau khi vết thương lành, và bệnh nhân vẫn phàn nàn về ngứa
cho đến 10 năm sau khi bị thương [48, 49]. Liên quan đến chứng đau thần kinh là chứng ngứa sau bỏng, với một số nghiên cứu cho thấy tỷ lệ 100% [50]. Trong khi cơ chế hoạt động chưa được hiểu rõ, cơ chế gây ngứa có lẽ là do nhiều yếu tố. Một trong những thành phần quan trọng là kích hoạt sợi C truyền dẫn cảm giác ngứa [51]. Tổn thương mô dẫn đến tăng nồng độ histamine và xanthine oxidase và giải phóng cục bộ chất P cũng như các cytokine khác [52]. Nhiều chất trong số này sẽ liên kết với các thụ thể sợi C và sẽ điều chỉnh tăng sự hoạt hóa của sợi C và cảm giác ngứa. Cơ chế đằng sau điều này chưa được hiểu rõ và điều này có thể kéo dài nhiều năm sau tổn thương ban đầu. Các phương pháp điều trị như gabapentin đã được chứng minh là cải thiện các triệu chứng nhưng cần phải tiến hành thử nghiệm trên nhiều vùng để chứng minh hiệu quả [53].
Mô bị suy yếu, như vết loét do tiểu đường, đã được chứng minh là ít để lại sẹo hơn bởi vì các cơ quan thụ cảm cơ học là một phần không thể thiếu trong quá trình lành vết thương [54]. Các kênh ion nhạy cảm cơ học (MS) và các sợi thần kinh cảm giác được kích thích gây ra sự hoạt hóa của các tế bào thần kinh cảm giác hướng tâm và giải phóng các neuropeptide, giúp điều chỉnh chức năng tế bào miễn dịch và sản xuất cytokine. TGF- β, được điều hòa bởi các neuropeptide này, gây ra nhiều sẹo phì đại hơn [55]. Tầm quan trọng của các thụ thể cơ học trong việc hình thành sẹo phì đại và sẹo lồi giải thích tại sao một số vùng dễ bị căng của cơ thể dễ bị sẹo phì đại như ngực trước và vai [56]. Theo lý thuyết, trang phục tạo áp lực để giảm lực cơ học này bằng cách tạo áp lực theo hướng ngược lại để làm phẳng và mềm sẹo [57].
Hình thành sẹo phì đại ở mô hình động vật
Các mô hình động vật đã mở rộng các hiểu biết còn hạn chế của chúng ta về sẹo phì đại. Mô hình tai thỏ đã được sử dụng để đo lường lành thương do bỏng và sẹo phì đại cho thấy vết bỏng sâu hơn gây ra nhiều sẹo phì đại hơn [58]. Một mô hình động vật khác ngày càng được công nhận là lợn cái Duroc đỏ. Được mô tả ban đầu vào năm 1972, loài động vật này đã được chứng minh là hình thành những vết sẹo phì đại dày khi bị thương [59, 60]. So sánh với lợn Yorkshire, cùng loài đối chứng không hình thành sẹo phì đại, lợn Duroc có nguyên bào sợi với sự tăng co collagen và biểu hiện TGF-β1 [61]. Mô hình tiếp tục là một công cụ hữu ích trong việc tìm hiểu về lành thương do bỏng [62, 63].
Hình thành sẹo phì đại theo khác biệt về di truyền
Cũng như sự khác nhau trong lành thương của lợn Duroc và Yorkshire, có một yếu tố di truyền gây ra sẹo phì đại ở người. Trẻ em, thanh niên và bệnh nhân có làn da sẫm màu có tỷ lệ bị sẹo phì đại cao hơn mà không hiểu lý do tại sao [64]. Một số nhóm chủng tộc nhất định như người Mỹ bản địa và người Hàn Quốc có tỷ lệ sẹo phì đại cao hơn [65].
Sự khác biệt trong biểu hiện của tế bào miễn dịch và hoạt động của nguyên bào sợi cơ ảnh hưởng đến việc hình thành sẹo phì đại [66]. Trong một nhóm bệnh nhân được nghiên cứu với phân tích gen, gen CSMD1 được phát hiện có khả năng bảo vệ chống lại sẹo phì đại [67]. Mặc dù chức năng của gen này trong việc lành thương vẫn chưa được xác định, nhưng đây có thể là một khía cạnh đầy hứa hẹn để ngăn ngừa sẹo phì đại trong tương lai.
Hình thành sự co rút
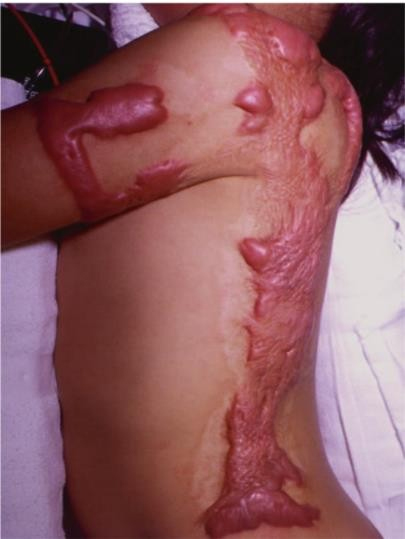
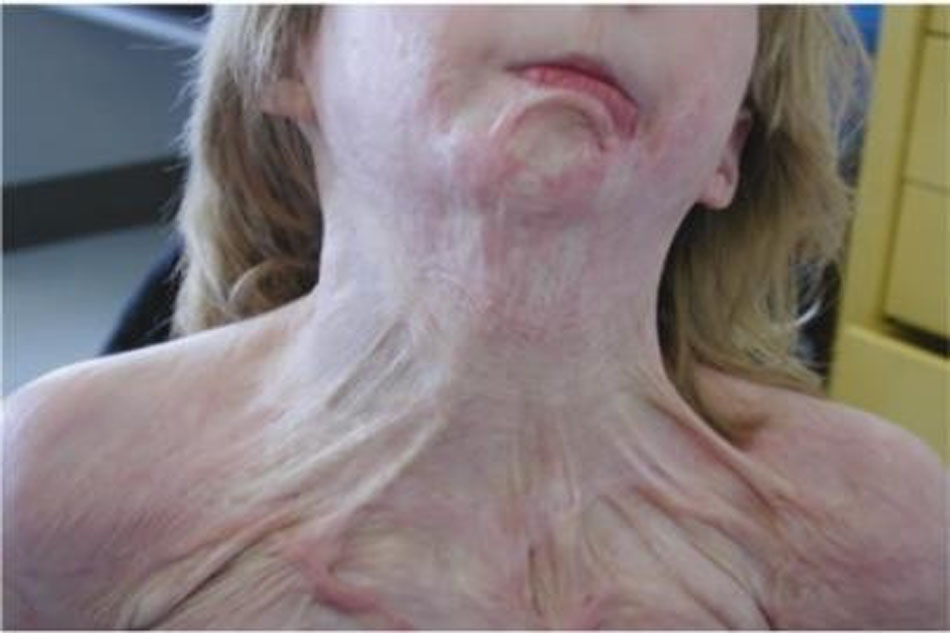
Hình thành sự co rút là một biến chứng khác của việc lành vết thương bỏng. Trong khi sự co lại đại diện cho một quá trình chữa lành vết thương sinh lý bình thường, thì sự cực đoan về mặt sinh lý bệnh gây ra tàn tật nghiêm trọng cho bệnh nhân. Các dải xơ ngăn cản phạm vi cử động bình thường ảnh hưởng ở khoảng một phần ba số bệnh nhân xuất viện sau chấn thương bỏng [68]. Thông thường nhất, co rút ảnh hưởng vai / nách và mặc dù điều trị tích cực và ghép da, phạm vi cử động vẫn bị suy giảm [68]. Hình 2.2 mô tả sẹo phì đại ở cổ và vai. Đối với bệnh nhi, khoảng 25% bị hạn chế cử động khi xuất viện, vai là vị trí co rút phổ biến nhất [69].
Khi đánh giá phạm vi cử động ở một bệnh nhân bị chấn thương bỏng nặng, sự hóa xương (heterotopic ossification, HO) biểu hiện cho một biến chứng khác do tổn thương nhiệt. HO là sự hình thành ở vị trí bất thường của phiến xương sau chấn thương, phẫu thuật hông và chấn thương tủy sống [70]. Khoảng 5% bệnh nhân bỏng phát triển HO, với khuỷu tay là vị trí phổ biến nhất [71]. Hiện nay, phẫu thuật cắt bỏ mô xương bất thường
vẫn là lựa chọn tốt nhất cho HO, với các phương thức điều trị khác như xạ trị và liệu pháp bisphosphonate chỉ đóng vai trò là phương pháp điều trị bổ trợ [72]. Sinh lý bệnh của HO vẫn chưa rõ ràng; các giải thích có thể bao gồm protein hình thái xương bị thay đổi và các con đường truyền tín hiệu yếu tố tăng trưởng giống insulin [73, 74]. Biến chứng này tác động tiêu cực đến chất lượng cuộc sống với tỷ lệ hiện mắc cao hơn ở nam giới và những người trẻ tuổi hơn [73]. Các nghiên cứu sâu hơn về phòng ngừa và điều trị là cần thiết để hiểu rõ hơn về vấn đề này.
Sắc tố
Sắc tố bất thường sau chấn thương bỏng gây ra các vấn đề về hình ảnh cơ thể đáng kể cho bệnh nhân. Biến chứng này gây ra sự tự ti và cô lập xã hội, đặc biệt là ở những người da màu [75]. Cả tăng và giảm sắc tố đều xuất hiện ở những vết bỏng đã lành mà không rõ cơ chế hoạt động. Hình 2.3 cho thấy các vùng tăng và giảm sắc tố trên cùng một bệnh nhân. Sau chấn thương nhiệt, các tế bào hắc tố tăng sinh và di chuyển vào vết thương từ các mép vết thương và các phần phụ của biểu bì để sản xuất và chuyển hắc tố sang các tế bào sừng lân cận [76]. Sự kết hợp của các yếu tố nội tiết có nguồn gốc tế bào sừng và các nguyên bào sợi ở da điều chỉnh hành vi của tế bào hắc tố [77]. Sự điều biến nguyên bào sợi của các tế bào hắc tố đã được chứng minh là không đồng nhất đáng kể, có thể là một yếu tố cho các tác động thay đổi của sắc tố [78]. Hiện tại, các lựa chọn thay đổi sắc tố bị hạn chế [79].
Loét Marjolin
Biến chứng nổi tiếng nhất của sẹo bỏng là loét Marjolin. Biến chứng được biết nhiều nhưng hiếm gặp của vết thương bỏng mãn tính biểu hiện như một ung thư biểu mô tế bào vảy ở sẹo bỏng đã lành [80]. Bệnh nhân biểu hiện với vết thương không lành trong sẹo bỏng phát sinh thứ phát sau viêm mãn tính xảy ra nhiều năm sau khi lành [81]. Vẫn còn nhiều tranh cãi về liệu pháp điều trị thích hợp cho căn bệnh ung thư da độc đáo và xâm lấn này. Điều trị bằng cách cắt bỏ cục bộ rộng. Các khối u cấp độ thấp cần phải giải phẫu hạch bạch huyết để tìm các hạch bạch huyết có thể sờ thấy được, nhưng các khối u cấp độ cao hơn có biểu hiện nguyên phân không bình thường thường xuyên hơn và thì cần phải giải phẫu hạch bạch huyết do tính xâm lấn tự nhiên của bệnh [82, 83].
Phục hồi tâm lý xã hội
Sức khỏe tâm lý xã hội sau chấn thương là một lĩnh vực ngày càng được các nhà cung cấp dịch vụ chăm sóc bỏng quan tâm. Bệnh nhân có tiền sử tâm thần gặp nhiều khó khăn hơn trong việc tái hòa nhập xã hội sau khi xuất viện. Tổng bề mặt cơ thể bị bỏng có thể không liên quan trực tiếp đến tình trạng tâm lý xã hội kém. Hai nghiên cứu nhi khoa đã cho thấy không có sự khác biệt giữa những người sống sót sau bỏng và nhóm chứng nhưng điều này chỉ giới hạn ở một nhóm dân số cụ thể [84, 85]. Bất chấp số liệu này, các bậc cha mẹ đánh giá thấp mức độ kỳ thị mà trẻ em phải trải qua [86]. Việc đo lường sức khỏe tâm lý xã hội là rất khó, một nghiên cứu theo dõi những phụ nữ bị chấn thương sau bỏng 1 năm cho thấy nhiều người do dự khi thảo luận về cảm xúc của họ và cảm thấy mâu thuẫn về khả năng hồi phục của họ [87]. Có rất ít dữ liệu nghiên cứu ảnh hưởng lâu dài của sẹo bỏng đối với phục hồi tâm lý xã hội và cần được nghiên cứu thêm [88].
Kết luận
Với tỷ lệ tử vong sau chấn thương bỏng đã giảm đáng kể trong 50 năm qua, quá trình lành vết thương lâu dài và các bệnh tật liên quan đến thể chất và tâm lý là phần của những tiến bộ cần tiếp tục trong lĩnh vực chăm sóc bỏng. Việc xác định thời điểm vết thương được “chữa lành” không còn là quá trình biểu mô hóa nữa mà giờ đây là một nhiệm vụ khó khăn hơn. Phục hồi chức năng, nhận thức hình ảnh cơ thể và đau thần kinh thách thức bệnh nhân trong nhiều thập kỷ. Hiểu được sự liên tục của các phản ứng da đối với chấn thương là cơ sở để ngăn ngừa những vấn đề mãn tính này. Tổn thương nhiệt phải được coi là một tình trạng mãn tính hơn là một chẩn đoán theo từng đợt ngắn hạn. Do đó, các bác sĩ phải nhận thức được các biến chứng bỏng lâu dài để xác định bệnh nhân sẽ được hưởng lợi từ các chương trình chăm sóc cụ thể liên tục về bỏng.
Tài liệu tham khảo
- Dupuytren G, Doane Clinical lectures on surgery: delivered at Hotel Dieu. Boston: Carter, Hendee; 1832.
- Center for Disease Release of ICD-10-CM https://www.cdc.gov/nchs/icd/icd10cm.htm# FY%202018%20release%20of%20ICD-10-CM (2018).
- Jackson The diagnosis of depth of burning. J Br Surg. 1953;40:588–96.
- Jackson Second thoughts on the burn wound. J Trauma.1969;9:839–62.
- Rowan MP, Cancio LC, Elster EA, et Burn wound healing and treatment: review and advancements. Crit Care. 2015;19:243–55.
- Tiwari Burn wound: how it differs from other wounds? Indian J Plast Surg. 2012;45:364–73.
- Santoro MM, Gaudino Cellular and molecular facets of keratinocyte reepithelization during wound healing. Exp Cell Res. 2005;304:274–86.
- Zhu Z, Ding J, Shankowsky HA, et The molecular mechanism of hypertrophic scar. J Cell Commun Signal. 2013;7:239–52.
- Gurtner GC, Werner S, Barrandon Y, et Wound repair and regeneration. Nature. 2008;453:314– 21.
- Santoro MM, Gaudino Cellular and molecular facets of keratinocyte reepithelization during wound healing. Exp Cell Res. 2005;30:274–86.
- Leibovich SJ, Ross The role of the macrophage in wound repair. Am J Pathol. 1975;78:71–95.
- Ladak A, Tredget Pathophysiology and management of the burn scar. Clin Plast Surg. 2009;36:661–74.
- Mills CD, Ley M1 and M2 macrophages: the chicken and the egg of immunity. J Innate Immun. 2014;6:716–26.
- Tacchio C, Cassatella Neutrophil-derived cytokines involved in physiological and pathological angiogenesis. Chem Immunol Allergy. 2014;99:123–37.
- Levy V, Lindon C, Zheng Y, et Epidermal stem clels arise from the hair follicle after wounding. FASEB J. 2007;21:1358–66.
- Martin Wound healing: aiming for perfect skin regeneration. Science. 1997;276:75–81.
- Koster Making an epidermis. Ann N Y Acad Sci. 2009;1170:7–10.
- Garner Epidermal regulation of dermal fibroblast activity. Plast Reconstr Surg. 1996;102:135– 9.
- Chetty BV, Boissey RE, Warden GD, et Basement membrane and fibroblast aberration in blisters at the donor, graft, and spontaneously healed sites in patients with burns. Arch Dermatol. 1992;125:181–6.
- Sarrazy V, Billet F, Micallef L, et al. Mechanisms of pathological scarring: role of myofibroblasts and current developments. Wound Repair Regen. 2011;19(Suppl):s10–5.
- Tonnesen MG, Feng X, Clark Angiogenesis in wound healing. J Investig Dermatol Symp Proc. 2000;5:40–6.
- Hollander DA, Erli HJ, Theisen A, Falk S, Kreck T, Muller S. Standardized qualitative evaluation of scar tissue properties in an animal wound healing Wound Repair Regen. 2003;4:150–7.
- Kischer CW. The microvessels in hypertrophic scars, keloids and related lesions: a review. J Submicrosc Cytol Pathol. 1992;24:281–96.
- Travis TE, Mino MJ, Moffatt LT, et al. Biphasic presence of fibrocytes in a porcine hypertrophic scar J Burn Care Res. 2015;36:e125–35.
- Ehrlich HP. Wound closure: evidence of cooperation between fibroblasts and collagen matrix. Eye. 1988;2:149–57.
- Gabbiani The myofibroblast in wound healing and fibrocontractive diseases. J Pathol. 2003;200:500–3.
- Baum J, Duffy HS. Fibroblasts and myofibroblasts: what are we talking about? J Cardiovasc 2011;57:37–379.
- Levenson SM, Geever EF, Crowley LV, et Healing of rat skin wounds. Ann Surg. 1965;161:293– 308.
- Hocking AM, Gibran NS. Mesenchymal stem cells: paracrine signaling and differentiation during cutaneous wound repair. Exp Cell 2010;316:2213–9.
- Nambu M, Kishimoto S, Nakamura S, et al. Accelerated wound healing in healing-impaired db/db mice by autologous adipose tissue-derived stromal cells combined with atelocollagen matrix. Ann Plast 2009;62:317–21.
- Wu Y, Chen L, Scott PG, et Mesenchymal stem cells enhance wound healing through differentiation and angiogenesis. Stem Cells. 2007;25:2648–59.
- Lee SH, Jin SY, Song JS, et al. Paracrine effects of adipose derived stem cells on keratinocytes and dermal Ann Dermatol. 2012;24:136–43.
- Mustoe TA, Cooter RD, Gold MH, et International clinical recommendations on scar management. Plast Reconstr Surg. 2002;110:560–71.
- Ogawa R. The most current algorithms for the treatment and prevention of hyperrophic scars and Plast Reconstr Surg. 2010;125:557–68.
- Tyack Z, Simons M, Spinks A, et A systematic review of the quality of burn scar rating scales for clinical and research use. Burns. 2012;38:6–18.
- Tyack Z, Wasiak J, Spinks A, et al. A guide to choosing a burn scar rating scale for clinical or research Burns. 2013;39:1341–50.
- Thompson CM, Sood RF, Honari S, et al. What score on the Vancouver scar scale constitutes a hypertrophic scar? Results from a survey of North American burn care Burns. 2015;41:1442–8.
- Lumenta DB, Siepmann E, Kamolz LP, et Internet-based survey on current practice for evaluation, prevention, and treatment of scars, hypertrophic scars, and keloids. Wound Repair Regen. 2014;22:483–91.
- Rinkevich R, Walmsley GG, Hu MS, et Science. 2015;348:aaa2151.
- Kwan PO, Tredget Biological principles of scar and contracture. Hand Clin. 2017;33:277–92.
- Kischer CW, Pindur J, Krasovith P, et al. Characteristics of granulation tissue which promote hypertrophic Scanning Microsc. 1990;4:877–87.
- Ogawa R. Keloid and hypertrophic scars are the results of chronic inflammation in the reticular Int J Mol Sci. 2017;18:606–16.
- Honardoust D, Varkey M, Marcoux Y, et al. Reduced decorin, fibro-modulin, and transforming growth factor: B3 in deep dermis leads to hypertrophic J Burn Care Res. 2012;33:218–27.
- Tredget EE, Wang R, Shen Q, et al. Transforming growth factor-beta mRNA and protein in hypertrophic scar tissues and fibroblasts antagonism by IFN-alpha and IFN-gamma in vitro and in J Interferon Cytokine Res. 2000;20:143–52.
- Scott PG, Dodd CM, Tredget EE, et al. Immunohistochemical localization of the proteoglycan decorin, biglycan, and versican and transforming growth factor-beta in human post-burn hypertrophic and mature scars. Histopathology. 1995;26:423–31.
- Scott JR, Muangman PR, Tamura RN, et al. Substance P levels and neutral endopeptidase activity in acute burn wounds and hypertrophic Plast Reconstr Surg. 2005;115:1095–102.
- Scott JR, Muangman P, Gibran NS. Making sense of hypertrophic scar: a role for nerves. Wound Repair Regen. 2007; 15:S27–31.
- Malenfont A, Forget R, Papillon J, et Prevalence and characteristics of chronic sensory problems in burn patients. Pain. 1996;67:493–500.
- Carrougher GJ, Martinez EM, McMullen KS, et al. Pruritus in adult burn survivors: postburn prevalence and risk factors associated with increased intensity. J Burn Care Res. 2013;34(1):94–
- Ahuja RB, Gupta R, Gupta G, et al. A comparative analysis of cetirizine, gabapentin and their combination in the relief of post-burn Burns. 2011;37:203–7.
- Brooks JP, Malic CC, Judkins Scratching the surface—managing the itch associated with burns: a review of current knowledge. Burns. 2008;34:751–60.
- Shimizu S, Tanaka H, Sakaki S, et Burn depth affects dermal interstitial fluid pressure, free radical production, and serum histamine levels in rats. J Trauma. 2003;54:683–7.
- Schneider JC, Harris NL, El Shami A, et A descriptive review of neuropathic-like pain after Burn injury. J Burn Care Res. 2006;27:524–8.
- Yagmur C, Guneren E, Kefeli M, et The effect of surgical denervation on prevention of excessive dermal scarring: a study on rabbit ear hypertrophic scar model. J Plast Reconstr Aesthet Surg. 2011;64:1359–65.
- Ogawa Mechanobiology of scarring. Wound Repair Regen. 2011;19(Suppl 1):s2–9.
- Ogawa R, Okai K, Tokumura F, et al. The relationship between skin stretching/contraction and pathologic scarring: the important role of mechanical forces in keloid generation. Wound Repair 2012;20:149–57.
- Kim JY, Willard JJ, Supp DM, et al. Burn scar biomechanics following pressure garment therapy. Plast Reconstr Surg. 2015;136:572–81.
- Friedrich EE, Niknam-Bienia S, Xie P, et Thermal injury model in the rabbit ear with quantifiable burn progression and hypertrophic scar. Wound Repair Regen. 2017;25:327–37.
- Silverstein, et al. Hypertrophic scarring etiology and control of disabling complications in burned Ann Res Progr Rep (US Army Institute of Surgical Research). 1972;37:1–5.
- Zhu KQ, Carrougher GJ, Gibran NS, et al. Review of the female Duroc/Yorkshire pig model of human fibroproliferative Wound Repair Regen. 2007;15(Suppl 1):S32–9.
- Sood RF, Muffley LA, Seaton ME, et al. Dermal fibroblasts from the red Duroc pig have an inherently fibrogenic phenotype: an in vitro model of fibroproliferative scarring. Plast Reconstr 2015;136:990–1000.
- Seaton M, Hocking A, Gibran Porcine models of cutaneous wound healing. ILAR J. 2015;56:127–38.
- Hollander DA, Erli HJ, Theisen A, et Standardized qualitative evaluation of scar tissue properties in an animal wound healing model. Wound Repair Regen. 2003;11:150–7.
- Engrav LE, Garner WL, Tredget Hypertrophic scar, wound contraction, and hyper- hypopigmentaiton. J Burn Care Res. 2007;28:593–7.
- Thompson CM, Hocking AM, Honari S, et Genetic risk factors for hypertrophic scar development. J Burn Care Res.2013;34:477–82.
- Santucci M, Borgogni L, Reali UM, et al. Keloids and Hypertrophic scars of caucasians show distinctive morphologic and immunophenotypic Virchows Arch. 2001;438:457–63.
- Sood RF, Hocking AM, Muffley LA, et al. Genome-wide association study of postburn scarring indentifies a novel protective Ann Surg. 2015;262:563–39
- Goverman J, Mathews K, Goldstein R, et Adult contractures in burn injury: a burn model system national database study. J Burn Care Res. 2017;38:e328–36.
- Goverman J, Mathews K, Goldstein R, et al. Pediatric contractures in burn injury: a burn model system national database J Burn Care Res. 2017;38:e192–9.
- Levi B, Jayakumar P, Giladi A, et Risk factors for the development of heterotopic ossification in seriously burned adults: a national institute on disability, independent living and rehabilitation research burn model system database analysis. J Trauma Acute Care Surg. 2015;79:870–6.
- Orchard GR, Paratz JD, Blot S, et al. Risk factors in hospitalized patients with burn injuries for developing heterotopic ossification—a retrospective J Burn Care Res. 2015;36:465–70.
- Schneider JC, Simko LC, Goldstein R, et al. Predicting heterotopic ossficaition early after burn A risk scoring system. Ann Surg. 2017;266:179–84.
- Peterson JR, Eboda ON, Brownley RC, et Effects of aging on osteogenic response and heterotopic ossification following burn injury in mice. Stem Cells Dev. 2015;24:205–13.
- Ranganathan K, Peterson J, Agarwal S, et Role of gender in burn-induced heterotopic ossification and mesenchymal cell osteogenic differentiation. Plast Reconstr Surg. 2015;135:1631–41.
- Holavanahali RK, Helm PA, Kowalske KG. Long-term outcomes in patients surviving large burns: the skin. J Burn Care 2010;31:631–9.
- Chadwick SL, Yip C, Ferguson MW, et al. Repigmentation of cutaneous scars depends on original wound J Anat. 2013;223(1):74–82.
- Park HY, Kosmadaki M, Yaar M, et Cellular mechanisms regulating human melanogenesis. Cell Mol Life Sci. 2009;66:1493–506.
- Sirimahachaiyakul P, Sood RF, Muffley LA, et al. Race does not predict melanocyte heterogenous responses to dermal fibroblast-derived mediators. PLoS One. 2015;10:e0139135.
- Greenhalgh A primer on pigmentation. J Burn Care Res. 2015;36:247–57.
- Shen R, Zhang J, Zhang F, et Clinical characteristics and therapeutic analysis of 51 patients with Marjolin’s ulcers. Exp Ther Med. 2015;10:1364–74.
- Bozkurt M, Kapi E, Kuvat SV, et al. Current concepts in the management of Marjolin’s ulcers: outcomes from a standardized treatment protocol in 16 J Burn Care Res. 2010;31:776–80.
- Fleming MD, Hunt JL, Purdue GF, et al. Marjolin’s ulcer: a review and reevaluation of a difficult J Burn Care Rehabil. 1990;11:460–9.
- Yanofsky VR, Mercer SE, Phelps RG. Histopathological variants of cutaneous squamous cell carcinoma: a J Skin Cancer. 2011;2011:210813.
- Lawrence JW, Rosenberg LE, Fauerbach JA. Comparing the body esteem of pediatric survivors of burn injury with the body esteem of an age-matched comparison group without burns. Rehabil 2007;52:370–9.
- Pope SJ, Solomons WR, Done DJ, et al. Body image, mood and quality of life in young burn Burns. 2007;33:747–55.
- Lawrence JW, Rosenberg L, Mason S, et Comparing parent and child perceptions of stigmatizing behavior experience by children with burn scars. Body Image. 2011;8:70–3.
- Hunter TA, Medved MI, Hiebert-Murphy D, et Put on your face to face the world: women’s narratives of burn injury. Burns. 2013;39:1588–98.
- Lawrence JW, Mason ST, Schomer K, et al. Epidemiology and impact of scarring after burn injury: a systematic review of the J Burn Care Res. 2012;33:136–46.