Bài viết Đánh giá sẹo và tìm hiểu về các yếu tố đánh giá về sẹo – Tải file PDF Tại đây.
Tác giả: Satoko Yamawaki
Dịch: Bs. Trương Tấn Minh Vũ
Sẹo gây ra biến dạng thẩm mỹ, rối loạn chức năng và các vấn đề về tâm lý. Việc điều trị sẹo là một thách thức đối với các bác sĩ phẫu thuật thẩm mỹ. Có nhiều phương thức điều trị sẹo, bao gồm phẫu thuật cắt bỏ, tiêm steroid, dán gel silicon, liệu pháp áp lực và liệu pháp laser. Do đó, đánh giá chặt chẽ kết quả điều trị sẹo là cần thiết. Các công cụ đánh giá sẹo được chia thành hai loại, cụ thể là đánh giá chủ quan bằng thang đo đánh giá sẹo và đánh giá khách quan bằng thiết bị. Chúng tôi giới thiệu các phương pháp đánh giá phổ biến nhất trong chương này.
6.1 Đánh giá chủ quan
6.1.1 Thang đo đánh giá biến dạng thẩm mỹ
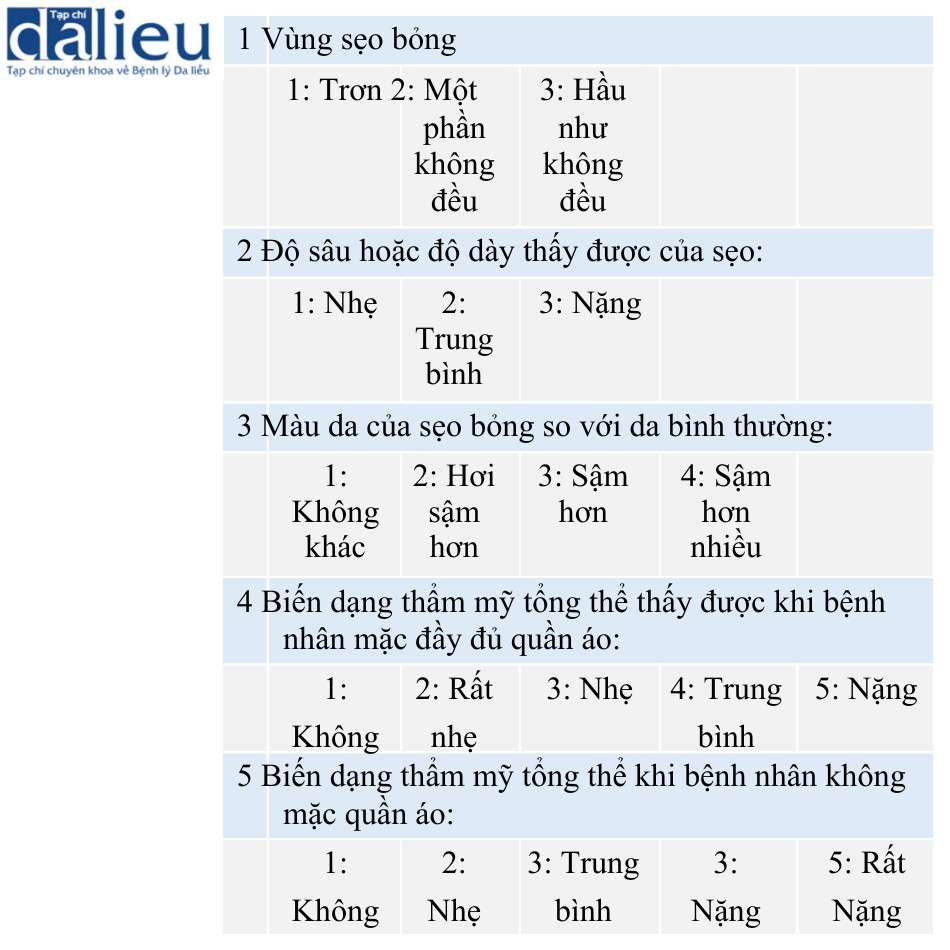
Từ những năm 1950, nhiều thang đo đánh giá sẹo được phát triển để đánh giá sẹo bỏng. Sẹo hình thành sau chấn thương bỏng thường có màu đỏ, cứng, căng và nhô lên so với vùng da xung quanh. Sẹo đôi khi phát triển phì đại, dẫn đến co thắt. Hầu hết bệnh nhân là trẻ em và sẹo nghiêm trọng có thể dẫn đến rối loạn tăng trưởng do co cứng khớp cũng như các vấn đề về tâm lý. Smith và cộng sự báo cáo một thang đo cho sẹo bỏng gồm năm mục, cụ thể là diện tích sẹo bỏng, độ sâu/độ dày, màu da và tình trạng biến dạng thẩm mỹ tổng thể khi mặc quần áo đầy đủ và khi không mặc quần áo (Bảng 6.1). Các tác giả đánh giá tính nhất quán của thang đo của họ và kết luận rằng một đánh giá đáng tin cậy đòi hỏi sự tham gia của hơn bốn người đánh giá khác nhau.
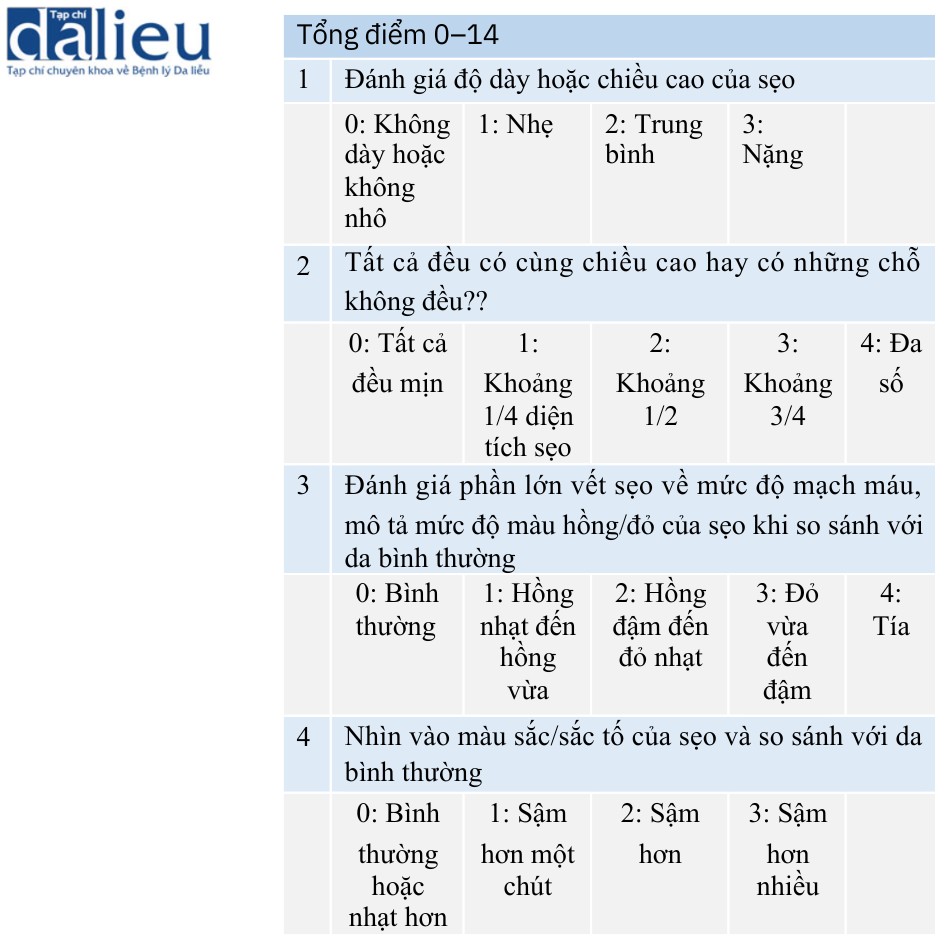
6.1.2 Thang Hamilton
Crowe và cộng sự phát triển thêm thang đo mà Smith và cộng sự báo cáo và mô tả là thang đo Hamilton (Bảng 6.2). Thang đo này đánh giá độ dày/chiều cao của sẹo, độ không đều của vùng sẹo, mạch máu cũng như màu sắc/sắc tố của sẹo so với da bình thường. Thang đo được thiết kế với mục đích đánh giá sẹo với độ tin cậy cao bằng cách sử dụng dữ liệu đầu vào từ một người đánh giá.
6.1.3 Thang sẹo Vancouver
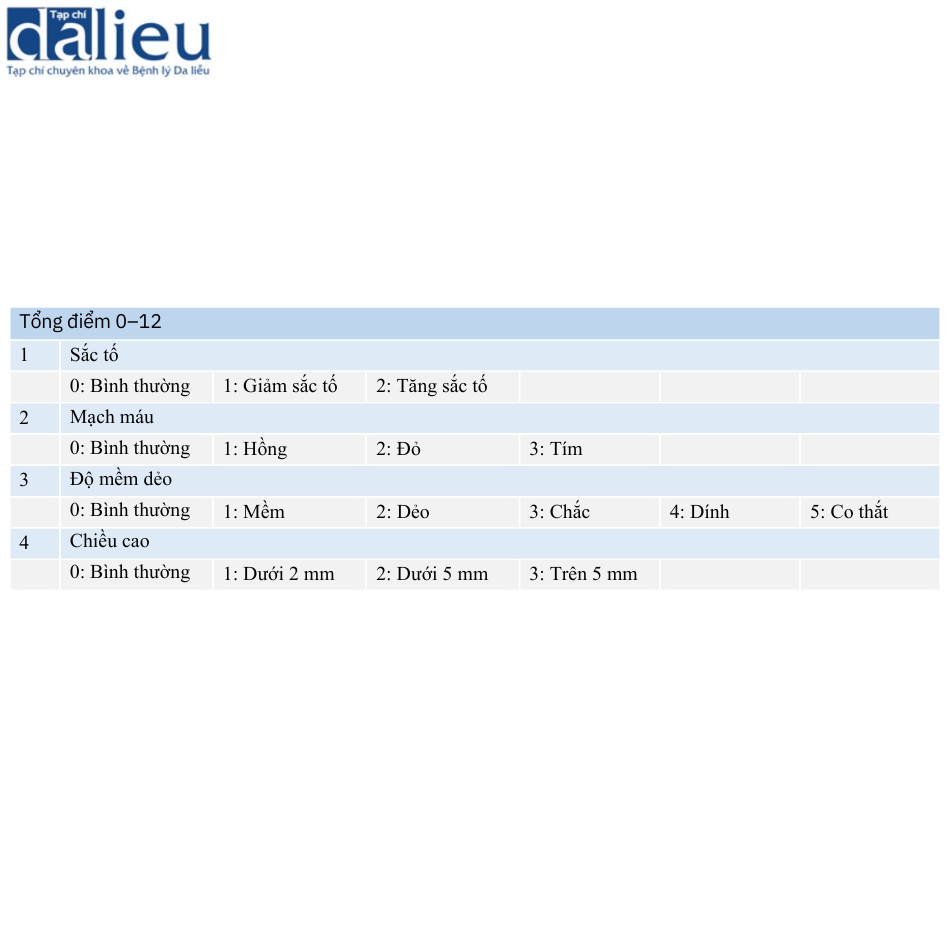
Thang đo đánh giá sẹo được sử dụng phổ biến nhất là thang đo sẹo Vancouver (VSS) . Thang VSS được dùng cho bệnh nhân ngoại trú và đánh giá các đặc điểm điển hình của sẹo, bao gồm sắc tố, mạch máu, độ mềm dẻo và chiều cao (Bảng 6.3). Da được làm trắng bằng một tấm nhựa trong suốt để loại bỏ tác động của mạch máu khi đánh giá sắc tố. Đánh giá mạch máu giống như thử nghiệm làm đầy mao mạch, trong đó da được đè và sau đó được đánh giá theo lưu lượng máu trở lại. Sẹo được cầm bằng ngón tay để đánh giá độ mềm dẻo của nó. Nếu sẹo gây ra biến dạng hoặc méo mó, nó được đánh giá là 5 điểm (tức là đánh giá nặng nhất). Tính nhất quán và độ tin cậy của VSS đã được xác nhận; tuy nhiên, một số vấn đề cũng được chỉ ra. Sẹo sau chấn thương bỏng đôi khi cho thấy cả tình trạng giảm và tăng sắc tố sau khi lành thương. Sẹo có sắc tố hỗn hợp khó đánh giá bằng VSS. Hơn nữa, thang điểm này không tính đến các triệu chứng của từng bệnh nhân.
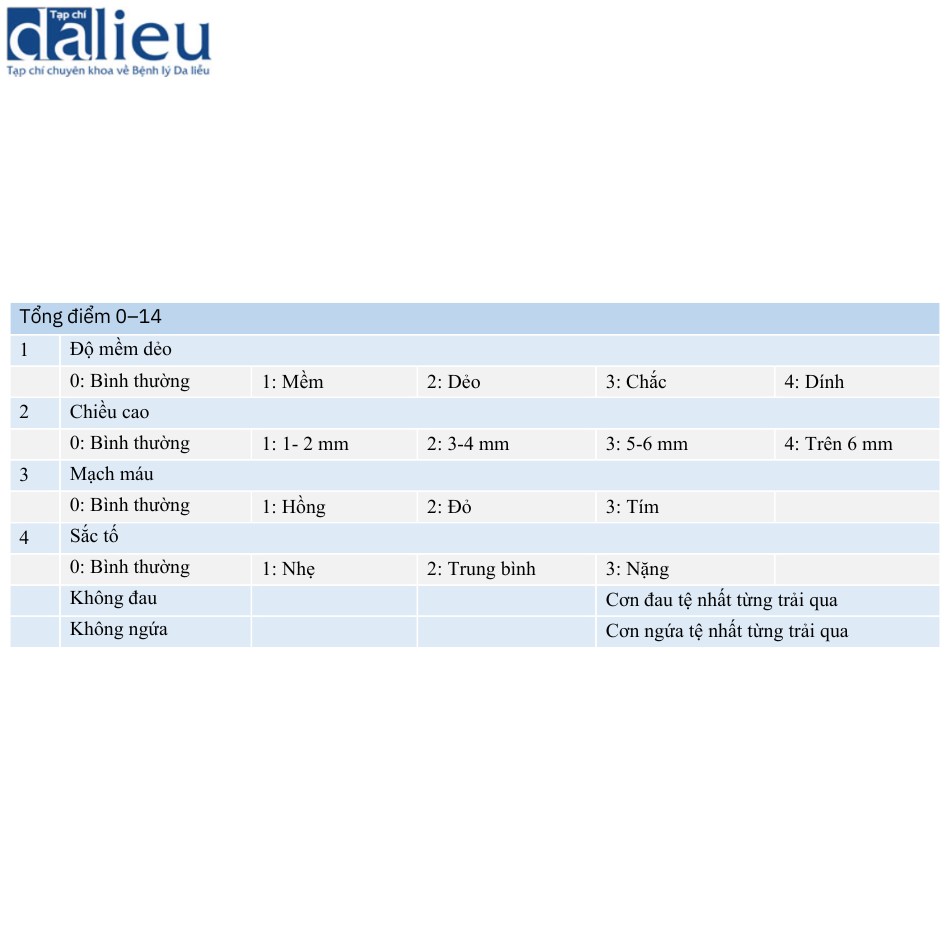
Có một số báo cáo về các phiên bản sửa đổi của VSS. Baryza và Baryza báo cáo rằng VSS có hệ số tương quan giữa các lớp cao và độ tin cậy giữa các chuyên gia, nhưng giá trị κ cho các phân loại sắc tố và chiều cao của nó chỉ ở mức khá và trung bình. Do đó, các tác giả sửa đổi các đánh giá về sắc tố và chiều cao và khuyến nghị sử dụng tấm Plexiglas® khi đánh giá các thang điểm phụ này (Bảng 6.4). Nedelec và cộng sự đánh giá sự thay đổi theo thời gian của từng mục và thấy rằng chiều cao của sẹo có ít thay đổi theo thời gian. Do đó, họ sửa đổi đánh giá chiều cao. Hơn nữa, họ thêm các triệu chứng đau và ngứa do mỗi bệnh nhân tự báo cáo (Bảng 6.5). ForbesDuchart và cộng sự đề cập đến khó khăn trong việc đánh giá sự khác biệt về màu da giữa bệnh nhân da trắng và thổ dân Úc. Một bức ảnh về màu da điển hình được hiển thị trong bài viết của họ. Họ kết luận rằng tổng điểm VSS được sửa đổi của họ có ý nghĩa đối với việc đánh giá sẹo.

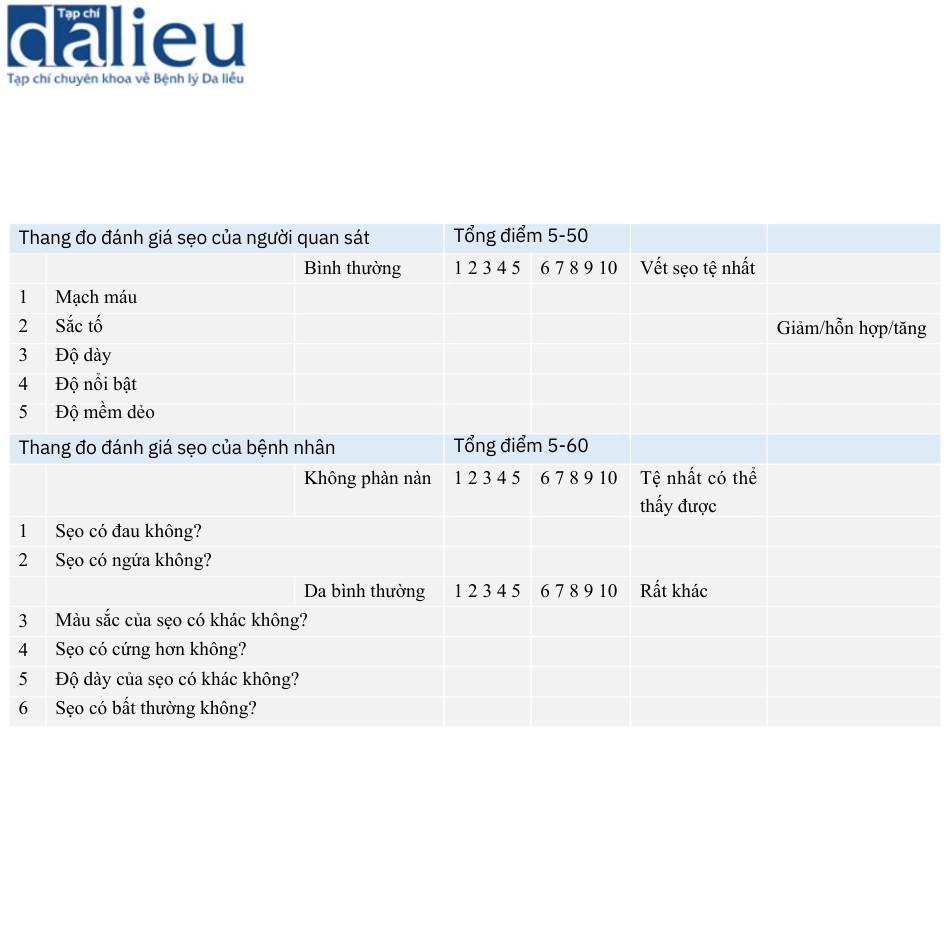
6.1.4 Thang đo đánh giá sẹo của bệnh nhân và người quan sát (POSAS)
POSAS được Draaijers và cộng sự phát minh, đưa vào các triệu chứng tự đánh giá của bệnh nhân (Bảng 6.6), và đánh giá từng mục sử dụng điểm số 10 bước. Các mục do người quan sát đánh giá bao gồm mạch máu, sắc tố, độ dày, độ nổi bật và độ mềm dẻo và các mục do bệnh nhân đánh giá bao gồm đau, ngứa, màu sắc, độ cứng và độ dày. Tất cả các mục đều được đánh giá bằng cùng một xếp hạng số để có thể cộng điểm của từng mục để tạo ra tổng điểm đáng tin cậy và nhất quán. Thú vị là ngứa và chiều cao được thấy có ảnh hưởng lớn hơn đến ý kiến của mỗi bệnh nhân về vết sẹo so với các mục khác. Thang đo này được chứng minh là hữu ích cho mọi loại sẹo.
6.1.5 Thang điểm Seattle
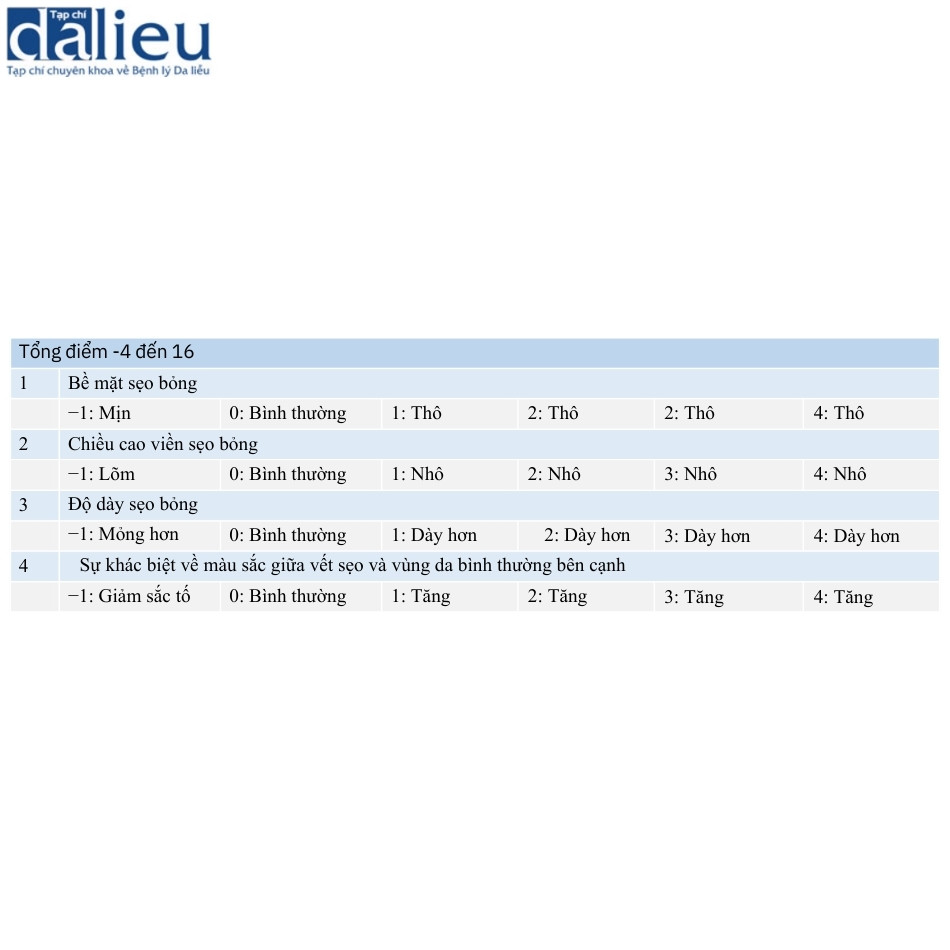
Yeong và cộng sự đã giới thiệu một thang điểm tập trung vào sự khác biệt giữa sẹo và vùng da bình thường liền kề. Thang điểm này bao gồm bốn mục, cụ thể là độ không đều của bề mặt, chiều cao đường viền, độ dày và sự khác biệt về màu sắc. Mỗi mục được chấm điểm bằng thang điểm sáu điểm từ -1 đến 4 (Bảng 6.7). Thang điểm này được gọi là thang điểm Seattle. Ngoài ra, các tác giả khuyến nghị sử dụng ảnh chụp bệnh nhân và vết sẹo với vùng da bình thường liền kề, mà họ gọi là “hình ảnh giảng dạy”. Những bức ảnh như vậy có thể giúp người đánh giá đánh giá sẹo một cách đơn giản, dễ dàng và đáng tin cậy.
6.1.6 Thang điểm sẹo Manchester
Để đánh giá định lượng, Beausang và cộng sự đề xuất kết hợp đánh giá mô học và lâm sàng của sẹo. Thang đo của họ được gọi là thang đo sẹo Manchester (Bảng 6.8).
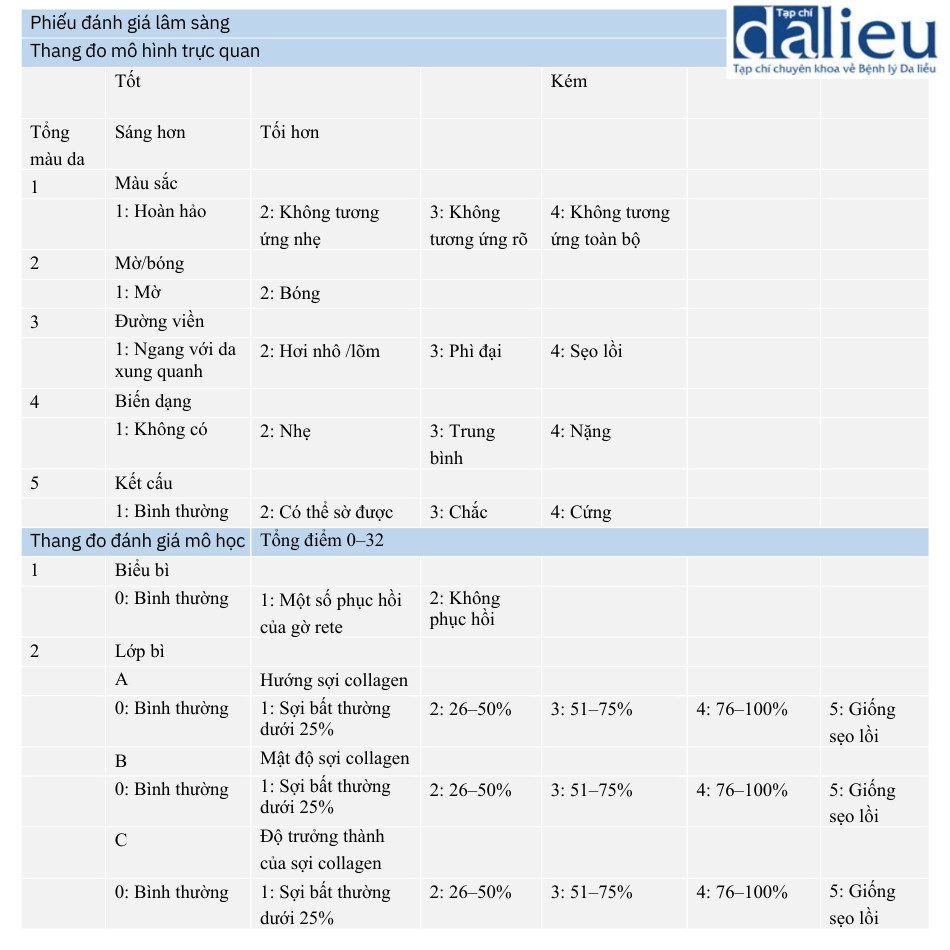
Họ kiểm tra lớp biểu bì và lớp bì bằng các mẫu vật thu được sau khi cắt bỏ sẹo trong phẫu thuật. Ngoài ra, lớp bì nhú và lớp bì lưới cũng được kiểm tra riêng biệt. Trong quá trình kiểm tra lớp bì, hướng, mật độ và độ trưởng thành của các sợi collagen được đánh giá. Điều này là do các sẹo trưởng thành hơn biểu hiện các sợi collagen mỏng hơn và định hướng ngẫu nhiên hơn, biểu hiện kiểu hình dệt giống như giỏ. Lớp bì lưới thay đổi nhiều nhất ở các sẹo phì đại, nhưng các dấu hiệu của lớp biểu bì và lớp bì nhú phản ánh biểu hiện của sẹo theo nghiên cứu của họ. Họ nhận xét về độ tin cậy của xét nghiệm mô học như sau: “Không có trường hợp sẹo nào kém chất lượng trên lâm sàng được phát hiện có mô học tốt khi kiểm tra bằng kính hiển vi”. Các mục mới khác trong thang đo sẹo Manchester là đánh giá mức độ mờ/bóng của sẹo và chấp nhận thang đo mô hình trực quan (VAS) để nắm bắt ý kiến của từng bệnh nhân về các triệu chứng của họ. Họ ước tính rằng sẹo mờ tốt hơn sẹo bóng dựa trên cảm nhận thông thường của người bình thường. VAS ban đầu được phát triển để đo lường và đánh giá cơn đau trong lĩnh vực nghiên cứu về cơn đau và kể từ đó đã được sử dụng rộng rãi trong nhiều bối cảnh lâm sàng khác nhau.
Báo cáo đầu tiên về điểm số VAS được sử dụng để đánh giá sẹo được Quinn và cộng sự mô tả. Bốn bác sĩ phẫu thuật thẩm mỹ đánh giá sẹo theo ba loại, cụ thể là không thể chấp nhận được, phù hợp và xuất sắc. Sau đó, những người quan sát tương tự đánh giá cùng một sẹo sử dụng VAS, trong đó các điểm được đo từ 0–100 mm dưới dạng dữ liệu liên tục. Họ kết nối kết quả đánh giá theo danh mục với điểm số VAS và đề xuất điểm cắt của sẹo “kém” là 35 mm trên VAS. VAS có thể lặp lại và đáng tin cậy, nhưng rất khó để xác định điểm cắt cho tất cả các danh mục. Điều này là do VAS mang tính khái niệm và không có giá trị ngưỡng chính xác. Sau báo cáo này, Moiemen và cộng sự sắp xếp VAS để đánh giá hiệu quả của da nhân tạo trong điều trị sẹo. Thang điểm của họ bao gồm bảy mục, cụ thể là phạm vi cử động, độ mềm, bề ngoài, ngứa, khô, đổ mồ hôi và cảm giác. Mỗi mục được bệnh nhân đánh giá trên thang điểm từ -10 (tệ hơn) đến +10 (tốt hơn). VAS được sử dụng để đánh giá các triệu chứng của bệnh nhân, như đau và ngứa, và để định lượng ý kiến của từng bệnh nhân. Ví dụ, để đánh giá ý kiến của bệnh nhân về cách vết sẹo của họ được người khác nhìn nhận, nếu bệnh nhân cho rằng vết sẹo của họ không đẹp, họ sẽ trả lời với số điểm là 0. Ngược lại, nếu họ cho rằng người khác không để ý đến vết sẹo, họ sẽ trả lời với số điểm là 10. Họ cũng giới thiệu một thang đo mới có tên là Đánh giá phù hợp giữa sẹo và ảnh chụp (Matching Assessment of Scars and Photographs). Họ sắp xếp thang đo được báo cáo bới Yeong và cộng sự để bao gồm đánh giá các triệu chứng của từng bệnh nhân bằng VAS và đề xuất thang đo có độ tin cậy dài hạn hơn.
6.1.7 Thang đo đánh giá sẹo Stony Brook (SBSES)
Singer và cộng sự sử dụng điểm VAS kết hợp với thang điểm đánh giá lâm sàng do người quan sát xếp hạng để tạo ra thang điểm mới, được gọi là SBSES. Đây là một trong số nhiều thang đo kết hợp điểm VAS với thang điểm lâm sàng sẹo để đánh giá các đặc điểm chi tiết của từng vết sẹo. SBSES bao gồm năm loại, là chiều rộng, chiều cao, màu sắc, vết khía/vết khâu và hình thức chung, và mỗi loại là một biến nhị phân (Bảng 6.9). Trong thang điểm này, tổng điểm cao hơn liên quan đến kết quả lâm sàng tốt hơn. Họ chứng minh không chỉ độ tin cậy cao giữa người đánh giá và người đánh giá mà còn có mối tương quan tốt giữa điểm thang đo đánh giá sẹo và điểm VAS, không giống như các báo cáo trước đây. Loại vết khía/vết khâu được đưa vào thang điểm phụ, do đó thang điểm này phù hợp để đánh giá ngắn hạn các vết sẹo sau phẫu thuật. Hơn nữa, việc sử dụng thang điểm này được FDA khuyến nghị.

Trong VSS, rối loạn chức năng vận động khớp được đánh giá là “co thắt” trên thang đo phụ về độ mềm dẻo. Schneider và cộng sự tập trung vào phạm vi chuyển động ở các khớp bị ảnh hưởng bởi co thắt do sẹo. Họ nhằm mục đích kiểm tra tỷ lệ mắc và mức độ nghiêm trọng của co cứng khớp và xác định các yếu tố dự báo chính về co thắt xảy ra sau chấn thương bỏng. Ví dụ, phạm vi chuyển động chủ động của khuỷu tay được đo ở tất cả các mặt phẳng, cụ thể là gấp, duỗi, sấp và ngửa, bằng cách sử dụng goniometer và inclinometer. Theo sự rối loạn phạm vi chuyển động, mức độ nghiêm trọng của mỗi co cứng được phân loại thành nhẹ, trung bình và nặng (Bảng 6.10). Khớp thường bị ảnh hưởng nhất là vai, tiếp theo là khuỷu tay và đầu gối. Thời gian nằm viện và tổng diện tích bề mặt bị bỏng (TBSA) và được ghép da là những yếu tố dự báo chính về sự phát triển của co thắt. Các yếu tố dự báo chính về mức độ nghiêm trọng của co thắt là TBSA được ghép da, cắt cụt và chấn thương do hít phải. Thời gian nằm viện và TBSA bị bỏng và được ghép da cũng liên quan đến số lượng co thắt. Cuối cùng, họ đề xuất rằng can thiệp sớm vào quá trình phục hồi chức năng ở bệnh nhân bỏng có thể ngăn ngừa sự phát triển của co thắt.
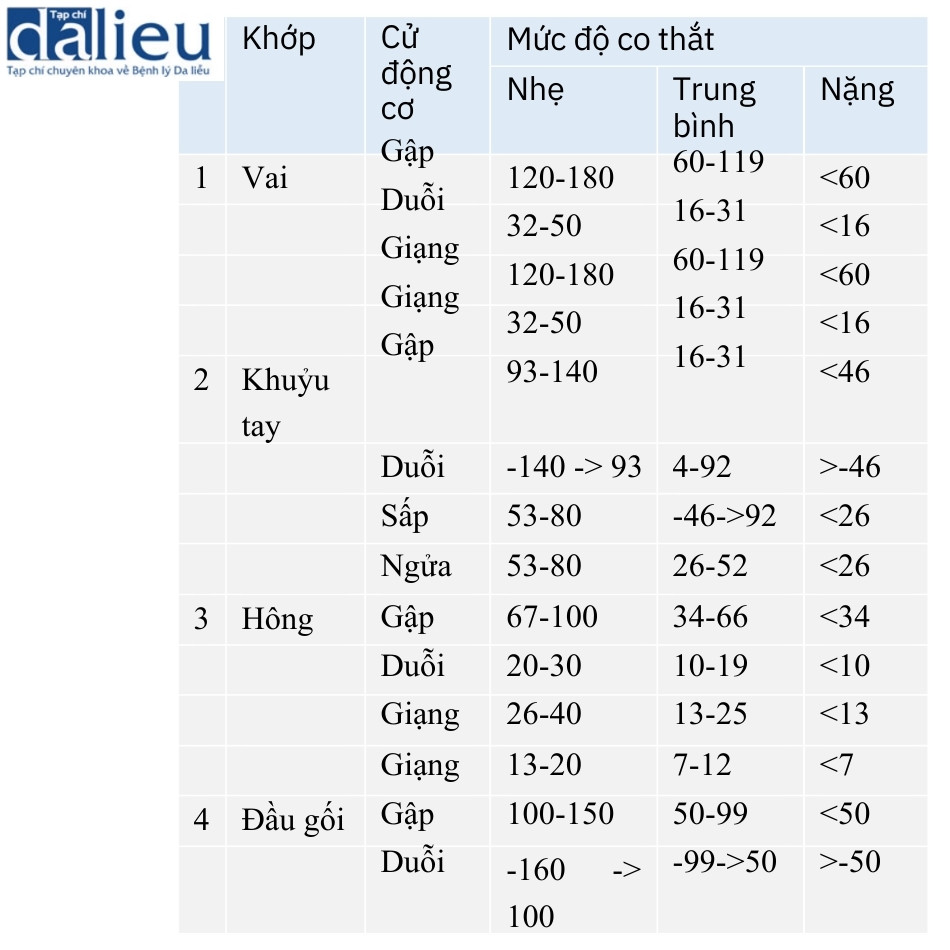
Vài năm sau, Fearmonti và cộng sự trích dẫn khái niệm mà Schneider và cộng sự đã báo cáo và phát triển một POSAS mới. Ông muốn phân biệt sẹo bệnh lý với sẹo không bệnh lý, vì điều quan trọng là phải xác định được sẹo bệnh lý để có thể điều trị. Trước đây, chúng tôi đã báo cáo một thang đánh giá sẹo gọi là thang đánh giá sẹo Kyoto. Thang đo này bao gồm cả các triệu chứng khách quan và chủ quan. Các triệu chứng khách quan được đánh giá là đỏ, cứng và nhô lên. Các triệu chứng chủ quan được đánh giá là đau và ngứa. Chúng tôi phân loại sẹo thành bốn loại, cụ thể là tuyệt vời, tốt, trung bình và kém, theo tổng số điểm.
6.1.8 Thang đánh giá sẹo của Japan Scar Workshop (JSW)
Tất cả các thang đánh giá mà chúng tôi đề cập ở trên đều đánh giá kết quả điều trị sẹo, nhưng phương thức điều trị tối ưu sẽ khác nhau tùy thuộc vào loại sẹo. Rất khó để phân biệt sẹo lồi với sẹo phì đại khó chữa, nhưng hai loại sẹo này đòi hỏi các chiến lược điều trị riêng biệt.
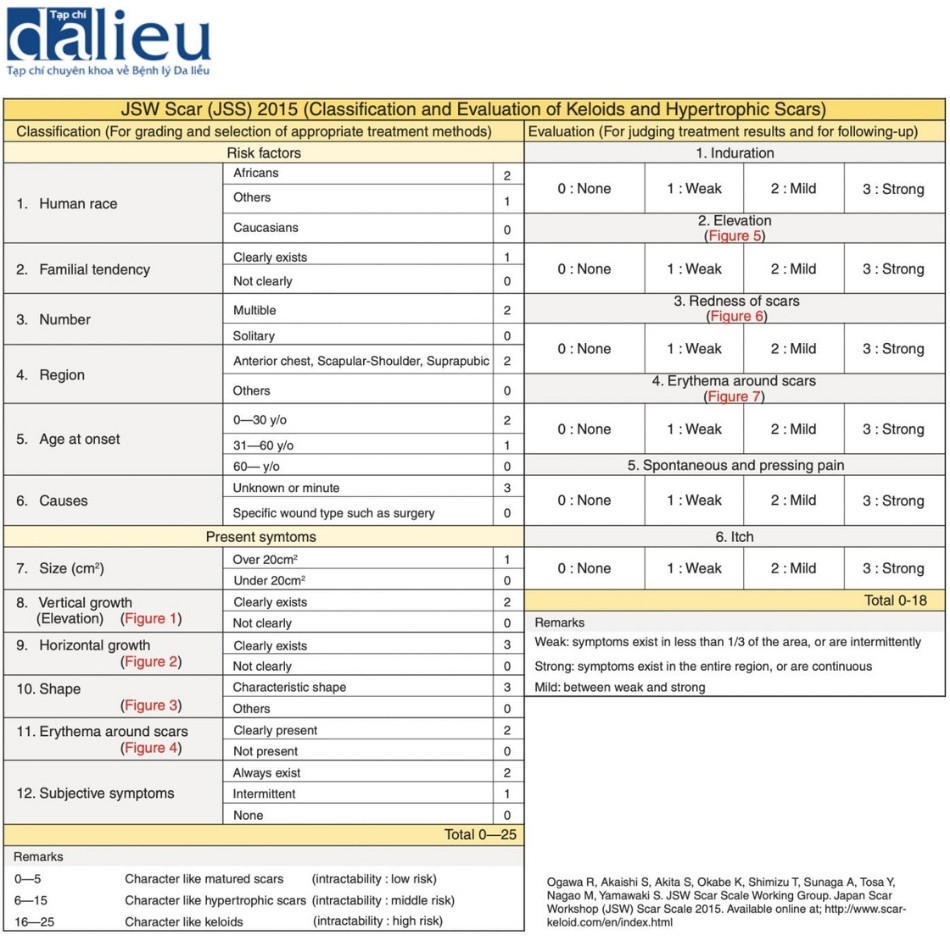
Sẹo lồi đôi khi cần xạ trị bổ sung sau khi phẫu thuật cắt bỏ. Do đó, điều quan trọng là phải phân biệt chính xác giữa sẹo lồi và sẹo phì đại trước khi bắt đầu điều trị. Theo quan điểm này, JSW phát minh ra thang điểm sẹo JSW, phân loại sẹo thành sẹo trưởng thành, sẹo phì đại và sẹo lồi và đánh giá các đặc điểm của chúng (Hình 6.1). Trong phân loại, 12 mục được đánh giá, cụ thể là dân tộc, khuynh hướng gia đình, số lượng tổn thương, có phải là vị trí sẹo phổ biến hay không, tuổi khởi phát, nguyên nhân, kích thước, sự phát triển theo chiều dọc, sự phát triển theo chiều ngang, hình dạng, ban đỏ xung quanh sẹo và tần suất các triệu chứng chủ quan. Các hình ảnh chuẩn hóa được áp dụng để đánh giá các thang điểm phụ về sự phát triển theo chiều dọc, sự phát triển theo chiều ngang, hình dạng và ban đỏ xung quanh sẹo. Theo tổng điểm của thang đo, sẹo được phân loại thành sẹo trưởng thành (0– 5 điểm), sẹo phì đại (6–15 điểm) và sẹo lồi (16–25 điểm). Chúng ta có thể quyết định chiến lược điều trị dựa trên kết quả này. Đánh giá bao gồm sáu thang điểm phụ, cụ thể là sẹo cứng, nhô lên, đỏ, ban đỏ quanh sẹo, đau tự phát/đau khi ấn và ngứa. Tất cả các thang điểm phụ đều được phân loại theo thang đo 4 điểm là không có, yếu, nhẹ hoặc mạnh. Người đánh giá có thể tham khảo ảnh chụp các trường hợp điển hình để hỗ trợ đánh giá. Thang đo sẹo JSW được sử dụng để phân loại sẹo trước khi bắt đầu điều trị cũng như đánh giá sau khi điều trị. Thang điểm này dễ sử dụng, hữu ích và khả thi để sử dụng trong các điều kiện lâm sàng.
Có nhiều thang đo đánh giá sẹo. VSS và POSAS được sử dụng rộng rãi vì chúng đánh giá các đặc điểm chính của sẹo và đơn giản, dễ sử dụng, không xâm lấn, nhanh chóng và không tốn kém. Do đó, chúng phù hợp để sử dụng trong thực hành lâm sàng. Các hướng dẫn được khuyến nghị để sử dụng thang đo đánh giá sẹo một cách đáng tin cậy như sau. Đầu tiên, vị trí và diện tích để đánh giá phải giống nhau mọi lúc. Sullivan và cộng sự đề xuất rằng diện tích để đánh giá phải là 4 cm2 , trong khi Tyack và cộng sự đề xuất rằng diện tích đó phải là 3 × 3 cm2 . Thứ hai, chúng ta nên quyết định vùng nào được đánh giá và chọn vùng đối chứng phù hợp. Cuối cùng, các thang đo có nhiều mục và tổng điểm lớn có xu hướng có khả năng xác định các điểm khác biệt nhỏ hơn giữa các vết sẹo so với các thang đo có tổng điểm nhỏ.
6.2 Đánh giá khách quan
Tất cả các vết sẹo đều có các đặc điểm chung về màu sắc, độ dày, độ mềm dẻo và diện tích bề mặt. Có nhiều thiết bị khác nhau để đánh giá các đặc điểm đó của sẹo. Chúng tôi giới thiệu tổng quan về các thiết bị để đo từng đặc điểm của sẹo trong Bảng 6.11.
6.2.1 Màu sắc
Màu da bất thường là một phàn nàn chính của bệnh nhân bị sẹo. Màu sắc của sẹo phản ánh hàm lượng hemoglobin và melanin trong da. Có hai loại công cụ để đo màu da.
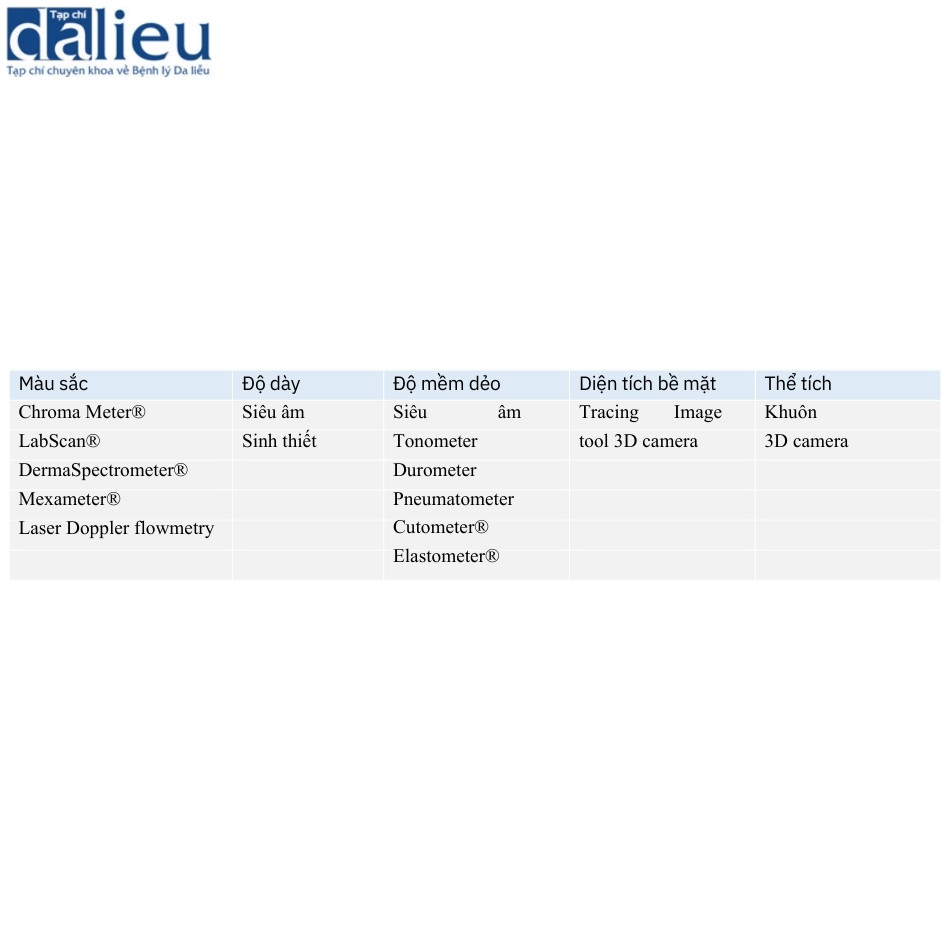
Đầu tiên, máy đo màu tristimulus phản xạ chiếu sáng da và thu nhận ánh sáng phản xạ để đo ba thông số: L∗, độ sáng (độ sáng); a∗, lượng màu xanh lá cây và đỏ (ban đỏ); và b∗, lượng màu vàng và xanh lam (sắc tố). Chroma Meter® (CR-400, Konica Minolta, Tokyo, Nhật Bản, Hình 6.2) và LabScan® (HunterLab, Reston, VA) là những thiết bị được sử dụng rộng rãi dùng cơ chế này và đo cả ban đỏ và sắc tố. Chroma Meter® được chứng minh là đáng tin cậy và nhất quán để sử dụng với các thang đo đánh giá sẹo chủ quan như VSS và POSAS. LabScan® đo bước sóng ánh sáng mà mắt người có thể nhận biết và cho thấy độ tin cậy tuyệt vời. Thiết bị này thường được sử dụng cho các nghiên cứu. Chúng ta nên biết rằng đôi khi tăng sinh mạch máu nhiều che khuất sắc tố khi sử dụng các thiết bị này. Chroma Meter® dễ vận hành hơn và rẻ hơn LabScan®.

Thứ hai, máy quang phổ dải hẹp tính toán chỉ số ban đỏ và chỉ số melanin dựa trên sự khác biệt giữa sự hấp thụ ánh sáng đỏ và xanh lục của hemoglobin và melanin. DermaSpectrometer® (Cortex Technology, Hadsund, Đan Mạch, Hình 6.3) đã chứng minh giá trị và độ tin cậy so với Chroma Meter® và thang đo đánh giá sẹo chủ quan. Oliveira và cộng sự chỉ ra rằng ngưỡng chỉ số lưu lượng máu là 2,5 có độ nhạy và độ đặc hiệu cao lần lượt là 73% và 83,3%.

Mexameter® (Courage và Khazaka, Cologne, Đức, Hình 6.4) chiếu sáng vùng được đánh giá bằng ba bước sóng ánh sáng khác nhau là 568, 660 và 880 nm. Sau đó, nó đo ánh sáng phản chiếu bởi da. Do đó, nó cũng đánh giá cả ban đỏ và sắc tố. Đầu dò của Mexameter® nhỏ và dễ sử dụng. Ngoài ra, nó cho thấy độ tin cậy cao giữa các quan sát viên và có mối tương quan mạnh với VSS.
Thứ ba, lưu lượng kế Doppler Laser (Hình 6.5) đánh giá sự tưới máu trong da, đo chuyển động của các tế bào hồng cầu trong một vùng rộng khoảng 1 mm2. Lưu lượng máu trong sẹo phì đại cao hơn lưu lượng máu trong sẹo trưởng thành và giảm đáng kể sau 18–24 tháng sau chấn thương bỏng. Nghĩa là, dữ liệu đo được bằng lưu lượng kế Doppler Laser có thể cung cấp thông tin về các đặc điểm và độ trưởng thành của sẹo. Ehrlich và Kelley cho rằng kỹ thuật này có thể hữu ích để dự đoán sự hình thành sẹo phì đại. Ngoài ra, lưu lượng kế Doppler Laser được sử dụng để xác định độ sâu của vết thương bỏng. Merz và cộng sự kết luận rằng vết thương có số ghi lưu lượng kế Laser Doppler lớn hơn 100 AU sẽ lành trong vòng 3 tuần.
6.2.2 Độ dày
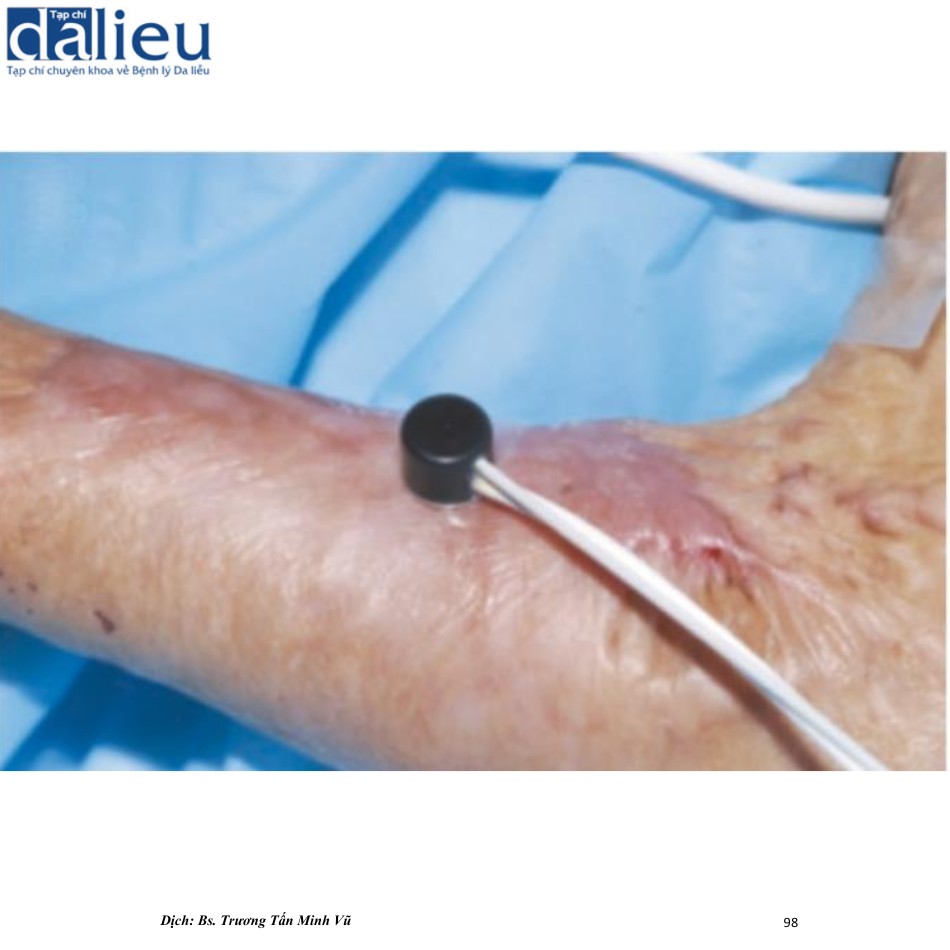
Độ dày của sẹo được đo bằng cách so sánh với da bình thường liền kề trong các điều kiện lâm sàng. Vì sẹo là do sự tăng sinh của collagen và nguyên bào sợi trong lớp bì, chúng ta có thể đo độ nhô và độ sâu của tổn thương bằng các thiết bị hoặc kỹ thuật phù hợp. Sinh thiết da là một giải pháp để đo các đặc điểm sẹo này. Tuy nhiên, kỹ thuật này xâm lấn và da co lại sau khi được cố định với paraformaldehyde. Kỹ thuật sinh thiết da phù hợp để kiểm tra mô học của sẹo. Một giải pháp khác để xác định độ dày của sẹo là siêu âm. Nedelec và cộng sự sử dụng DermaScan® C (Cortex, Hình 6.6), chuyên dùng để đo các đặc điểm của da thông qua siêu âm. Các tác giả đề xuất rằng các vị trí có độ dày vượt quá 2,034 mm nên được phân loại là sẹo phì đại. Việc kiểm tra da bằng siêu âm nói chung gần đây trở nên khả thi nhờ vào sự tiến bộ của công nghệ siêu âm. Các thiết bị siêu âm thường được sử dụng trong các cơ sở lâm sàng và chúng có khả năng tái sử dụng tốt, ít xâm lấn và độ chính xác cao. Hơn nữa, siêu âm gần đây được áp dụng để đánh giá độ cứng của các tổn thương da. Chúng tôi sẽ thảo luận thêm về phép đo độ cứng bằng siêu âm trong phần tiếp theo.
6.2.3 Độ mềm dẻo
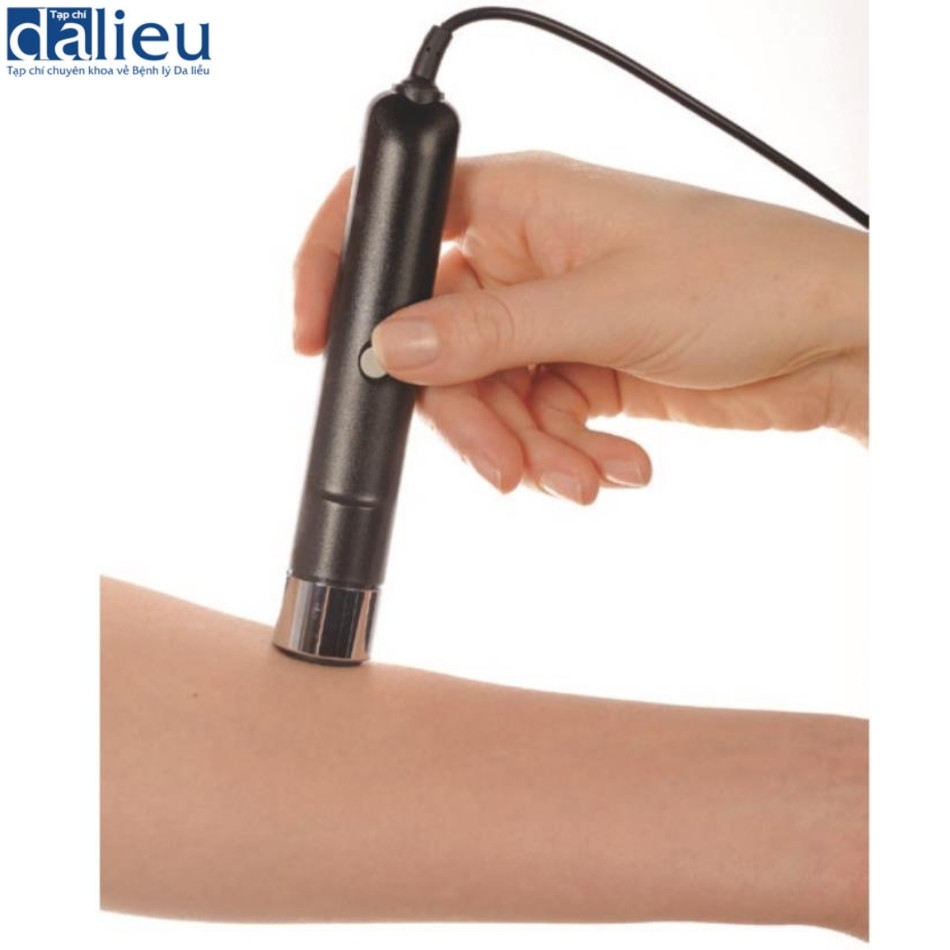
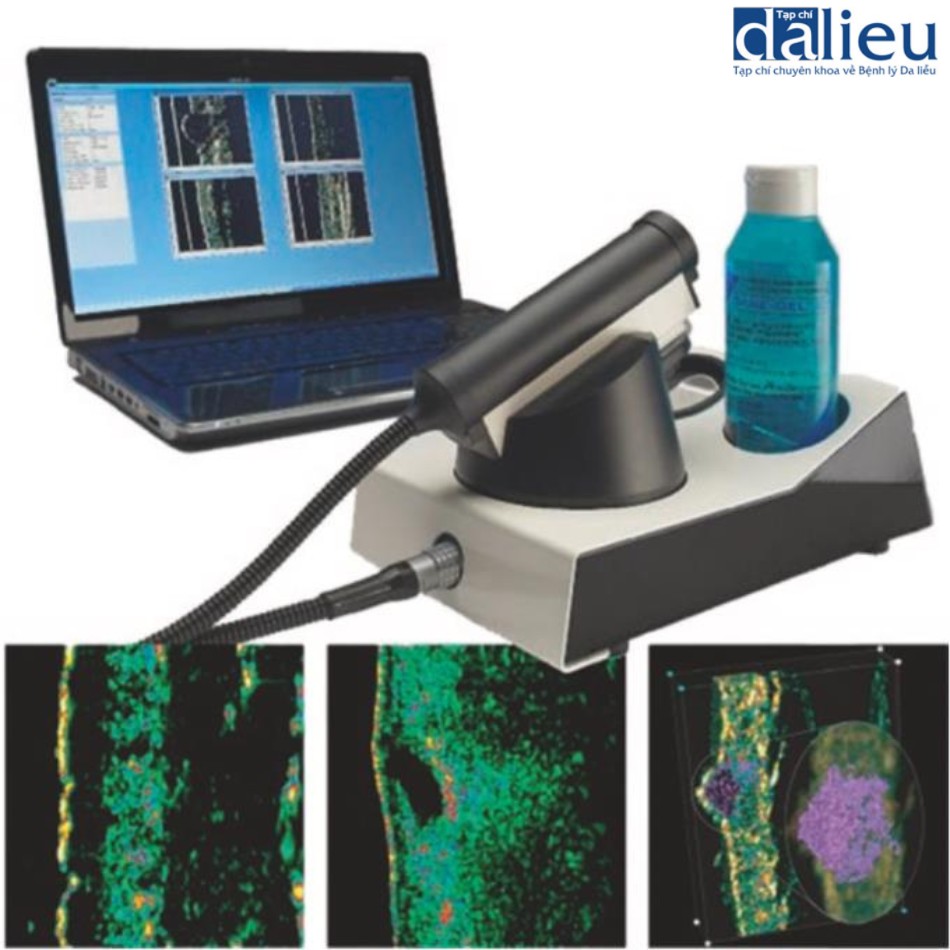
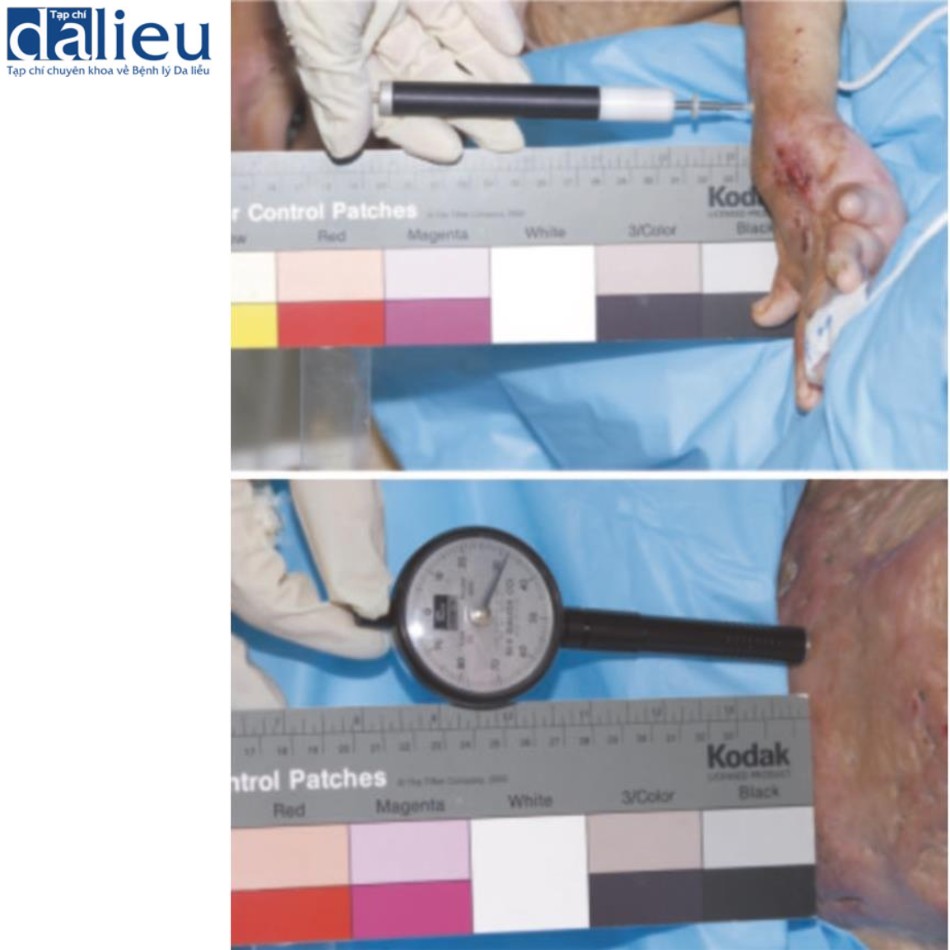
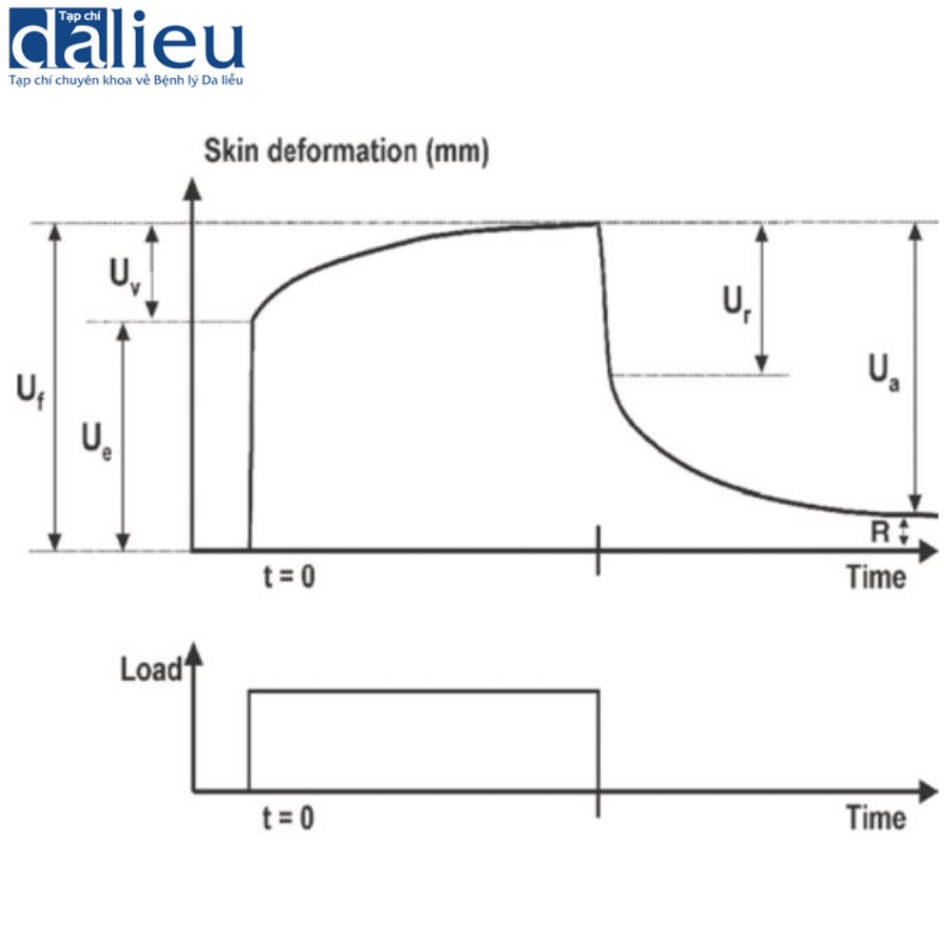
Sẹo thường có độ mềm dẻo giảm so với da bình thường. Độ cứng tăng của sẹo đôi khi gây đau và ngứa do sự khác biệt về độ mềm dẻo so với da bình thường liền kề. Ngoài ra, độ cứng của chúng làm trầm trọng thêm tình trạng co thắt của sẹo và góp phần hạn chế phạm vi chuyển động của khớp. Một số thiết bị dựa trên các cơ chế khác nhau để đo độ mềm dẻo của sẹo. Áp kế (tonometer) ban đầu được phát triển trong lĩnh vực nhãn khoa để đánh giá áp suất nội nhãn, nó cung cấp tải trọng lõm theo hướng thẳng đứng. Khí áp kế (pneumatometer) và máy đo độ cứng (durometer) (Hình 6.7) là các loại áp kế đo áp suất thông qua hệ thống luồng khí. Các thiết bị này cho thấy tính nhất quán cao với VSS. Máy đo độ cứng có độ nhạy là 87% và độ đặc hiệu là 91,7% dưới ngưỡng 40. Khí áp kế cho thấy độ nhạy là 87,5% và độ đặc hiệu là 100% dưới ngưỡng 20. Chúng ta nên xem xét rằng áp kế chịu ảnh hưởng của mô cứng bên dưới. Cutometer® (Courage và Khazaka, Hình 6.8) đo độ nhớt đàn hồi của da bằng cách phân tích biến dạng theo chiều dọc của bề mặt da sau khi áp dụng áp suất âm 500 mbar lên da trong khoảng thời gian 1 giây, sau đó là áp dụng áp suất bình thường trong 1 giây. Dữ liệu được tải lên máy tính. Cutometer® sử dụng đầu dò cầm tay có nhiều đường kính khác nhau, từ 2 đến 8 mm. Đầu dò 6 mm phù hợp để đo độ đàn hồi của da. Thiết bị thu thập dữ liệu cho một số thông số (Hình 6.9). Trong số các thông số được đo, Uf và Ue được cho là các phép đo đáng tin cậy về độ đàn hồi. Cutometer® được sử dụng rộng rãi và nhiều bài báo chỉ ra tính hữu ích, độ tin cậy và giá trị của nó. Điều quan trọng cần lưu ý là Cutometer® bị ảnh hưởng bởi độ ẩm, nhiệt độ và vị trí cơ thể được đánh giá. Chúng ta cần chú ý đến việc lựa chọn đối tượng đối chứng. Ngoài ra, các thiết bị có sẵn để đo độ dẻo có hiệu ứng trần, do đó, rất khó để phân biệt giữa các khác biệt về độ cứng trên một mức nhất định. US cũng hữu dụng để đo độ cứng. Có hai kỹ thuật để đo độ cứng của da bằng US. Đầu tiên là sự đàn hồi biến dạng, hoạt động theo nguyên tắc rằng các tổn thương sẽ bị biến dạng khi có lực tác dụng. Các tổn thương cứng biến dạng ít hơn các mô mềm dẻo. Độ cứng của tổn thương được ước tính bằng cách tính tỷ lệ tương quan của độ biến dạng mô giữa tổn thương và lớp bì bình thường. Kỹ thuật US thứ hai để đo độ cứng của da là sự đàn hồi sóng cắt. Đàn hồi sóng cắt phát ra các xung âm thanh ngắn gây ra sự nén mô và sau đó tạo ra sóng cắt lan truyền vào mô theo phương vuông góc với hướng của xung âm thanh. Chúng tôi chọn vùng quan tâm trong sẹo và vận tốc được tính toán tự động. Do đó, độ cứng được tiết lộ bởi vận tốc truyền sóng. Ở các mô cứng hơn, sóng truyền với vận tốc cao hơn và sóng cũng truyền với vận tốc cao hơn ở các vết sẹo chưa trưởng thành cho thấy sự tích tụ collagen bất thường theo phân tích mô bệnh học so với các vết sẹo trưởng thành.
6.2.4 Diện tích bề mặt
Diện tích bề mặt của sẹo liên quan đến mức độ nghiêm trọng của chúng, đặc biệt là đối với các vết thương do bỏng. Việc theo dõi viền ngoài của sẹo được thực hiện như một phương pháp đánh giá trong một thời gian dài. Hiện nay, người ta thường kết hợp ảnh chụp sẹo với các công cụ phân tích hình ảnh tính toán dễ dàng có sẵn. Mặc dù kỹ thuật theo dõi và chụp ảnh kết hợp với phân tích tính toán đều đáng tin cậy và có thể tái sử dụng, đặc biệt là đối với các vùng nhỏ hơn 25 cm2 , nhưng phương pháp sau dễ thực hiện và thu thập dữ liệu hơn. Có một số nhược điểm liên quan đến việc đo diện tích bề mặt. Đầu tiên, diện tích bề mặt của sẹo có thể thay đổi khi nó giãn ra hoặc co lại; do đó, rất khó để ước tính diện tích vết thương ban đầu từ diện tích sẹo. Thứ hai, diện tích bề mặt tăng lên ở những bệnh nhân đã ghép da sau chấn thương bỏng. Cuối cùng, độ cong của cơ thể làm nhiễu độ chính xác của phép đo diện tích bề mặt, ngay cả khi chúng ta sử dụng các phương pháp phân tích hình ảnh tính toán.

6.2.5 Thể tích
Để đo thể tích sẹo, khuôn răng được sử dụng trong quá khứ. Việc sử dụng phương pháp này rất phức tạp vì cần có một số bước để đo thể tích, cụ thể là tạo dấu ấn âm tính, tạo dấu ấn dương tính và đo thể tích. Khuôn được áp dụng trực tiếp vào sẹo; do đó, sự biến dạng da thường xảy ra và kết quả trở nên không chính xác. Là một phương pháp thay thế, máy ảnh 3D trở nên phổ biến. Với phương pháp này, chúng tôi chọn ba điểm tùy ý sau khi chụp ảnh. Hệ thống được kết nối với máy tính và phần mềm ứng dụng sẽ tự động tính toán thể tích. Nó không chỉ có thể đo diện tích bề mặt mà còn đo thể tích sẹo và không yêu cầu tiếp xúc vật lý với bệnh nhân. Hơn nữa, nó có thể tính toán độ dốc của bề mặt cơ thể, do đó vấn đề về độ cong của cơ thể được đề cập ở trên có thể được giải quyết. Sử dụng phương pháp này, Ardehali và cộng sự phát hiện ra rằng tiêm steroid trong 8 tuần làm giảm thể tích sẹo hơn 50% trong phần lớn các trường hợp. Họ xác định thành công những người đáp ứng thấp cần cân nhắc phương thức điều trị khác. Những hạn chế của chụp ảnh 3D là chi phí của thiết bị và các bước phân tích tốn thời gian, khiến việc sử dụng phương pháp này hàng ngày trong các cơ sở lâm sàng trở nên khó khăn.
Để xác định phương thức điều trị phù hợp, việc đánh giá kết quả điều trị là rất quan trọng. Đánh giá khách quan về sẹo là định lượng, chính xác, đáng tin cậy, có thể tái sử dụng và giá trị. Mỗi thiết bị đều chính xác; ví dụ, hệ thống hình ảnh 3D VECTRA® (Canfield Scientific, Parsippany, NJ) có thể đo thể tích sẹo với sai số đo lường nhỏ hơn 1 mm3 . Tuy nhiên, hầu hết các thiết bị được đề cập ở trên đều chỉ có thể đánh giá một đặc điểm của sẹo, mặc dù sẹo có một số đặc điểm phản ánh mức độ nghiêm trọng của chúng như màu sắc, độ cứng, diện tích bề mặt và độ dày. Ngoài ra, vẫn còn nghi ngờ liệu bệnh nhân có đánh giá cao những cải thiện nhỏ trong sẹo của họ mà chỉ có thể đo được bằng các thiết bị như vậy hay không. Một vấn đề khác là các thiết bị này đắt tiền và thường đòi hỏi các bước phân tích tốn thời gian. Do đó, việc đánh giá sẹo bằng các thiết bị này thường phù hợp hơn cho nghiên cứu hơn là cho thực hành lâm sàng hàng ngày. Hiện tại, mỗi người đánh giá nên chọn thiết bị phù hợp tùy thuộc vào mục đích của một nghiên cứu hoặc quy trình đánh giá lâm sàng nhất định.
Tài liệu tham khảo
- Smith GM, Tompkins DM, Bigelow ME, et al. Burn-induced cosmetic disfigurement: can it be measured reliably? J Burn Care Rehabil. 1988;9(4):371–5.
- Crowe JM, Simpson K, Johnson W, et al. Reliability of photographic analysis in determining change in scar appearance. J Burn Care Rehabil. 1998;19(2):183–6.
- Sullivan T, Smith J, Kermode J, et al. Rating the burn scar. J Burn Care Rehabil. 1990;11(3):256– 60.
- Baryza MJ, Baryza GA. The Vancouver Scar Scale: an administration tool and its interrater reliability. J Burn Care Rehabil. 1995;16(5):535– 8.
- Nedelec B, Shankowsky HA, Tredget EE. Rating the resolving hypertrophic scar: comparison of the Vancouver Scar Scale and scar volume. J Burn Care Rehabil. 2000;21(3):205–12.
- Forbes-Duchart L, Mrashall S, Strock A, et al. Determination of inter-rater reliability in pediatric burn scar assessment using a modified version of the Vancouver Scar Scale. J Burn Care Res. 2007;28(3):460–7.
- Draaijers LJ, Tempelman FR, Botman YA, et al. The patient and observer scar assessment scale: a reliable and feasible tool for scar evaluation. Plast Reconstr Surg. 2004b;113(7):1960–5. discussion 1966–1967.
- Yeong EK, Mann R, Engrav LH, et al. Improved burn scar assessment with use of a new scar-rating scale. J Burn Care Rehabil. 1997;18(4):353–5. discussion 352.
- Beausang E, Floyd H, Dunn KW, et al. A new quantitative scale for clinical scar assessment. Plast Reconstr Surg. 1998;102(6):1954–61.
- Quinn JV, Drzewiecki AE, Stiell IG, et al. Appearance scales to measure cosmetic outcomes of healed lacerations. Am J Emerg Med. 1995;13(2):229–31. https://doi.org/ 10.1016/0735-6757(95)90100-0.
- Moiemen NS, Staiano JJ, Ojeh NO, et al. Reconstructive surgery with a dermal regeneration template: clinical and histologic study. Plast Reconstr Surg. 2001;108(1):93–103.
- Masters M, McMahon M, Svens B. Reliability testing of a new scar assessment tool, Matching Assessment of Scars and Photographs (MAPS). J Burn Care Rehabil. 2005;26(3):273–84.
- Martin D, Umraw N, Gomez M, et al. Changes in subjective vs objective burn scar assessment over time: does the patient agree with what we think? J Burn Care Rehabil. 2003;24(4):239–44. discussion 238. https://doi.org/10.1097/ 01.BCR.0000075842. 55039.03.
- Singer AJ, Arora B, Dagum A, et al. Development and validation of a novel scar evaluation scale. Plast Reconstr Surg. 2007;120(7): 1892–7. https://doi.org/10.1097/01.prs.0000287275.15511 .10.
- Bae SH, Bae YC. Analysis of frequency of use of different scar assessment scales based on the scar condition and treatment method. Arch Plast Surg. 2014;41(2):111–5. https://doi.org/10.5999/ aps. 2014.41.2.111.
- Schneider JC, Holavanahalli R, Helm P, et al. Contractures in burn injury: defining the problem. J Burn Care Res. 2006;27(4):508–14. https://doi.org/10.1097/01.BCR.0000225994.757 44.9D.
- Schneider JC, Holavanahalli R, Helm P, et al. Contractures in burn injury part II: investigating joints of the hand. J Burn Care Res. 2008;29(4):606–13. https://doi.org/10.1097/ BCR.0b013e31817db8e1.
- Fearmonti R, Bond J, Erdmann D, et al. A review of scar scales and scar measuring devices. Eplasty. 2010;10:e43.
- Yamawaki S, Naitoh M, Ishiko T, et al. Keloids can be forced into remission with surgical excision and radiation, followed by adjuvant therapy. Ann Plast Surg. 2011;67(4):402–6. https://doi. org/10.1097/SAP.0b013e31820d68.
- Ogawa R, Akaishi S. Endothelial dysfunction may play a key role in keloid and hypertrophic scar pathogenesis—keloids and hypertrophic scars may be vascular disorders. Med Hypotheses. 2016;96:51–60. https://doi.org/ 10.1016/j.mehy.2016.09.024.
- Tyack Z, Simons M, Spinks A, et al. A systematic review of the quality of burn scar rating scales for clinical and research use. Burns. 2012;38(1):6–18. https://doi.org/10.1016/j.burns.2011.09.021.
- Draaijers LJ, Botman YA, Tempelman FR, et al. Skin elasticity meter or subjective evaluation in scars: a reliability assessment. Burns. 2004a;30(2):109–14. https://doi.org/10.1016/ j.burns.2003. 09.003.
- Oliveira GV, Chinkes D, Mitchell C, et al. Objective assessment of burn scar vascularity, erythema, pliability, thickness, and planimetry. Dermatol Surg. 2005;31(1):48–58.
- Nedelec B, Correa JA, Rachelska G, et al. Quantitative measurement of hypertrophic scar: intrarater reliability, sensitivity, and specificity. J Burn Care Res. 2008b;29(3):489–500. https://doi. org/10.1097/BCR.0b013e31817108.
- Atiles L, Mileski W, Purdue G, et al. Laser Doppler flowmetry in burn wounds. J Burn Care Rehabil. 1995;16(4):388–93.
- Ehrlich HP, Kelley SF. Hypertrophic scar: an interruption in the remodeling of repair—a laser Doppler blood flow study. Plast Reconstr Surg. 1992;90(6):993–8.
- Perry DM, McGrouther DA, Bayat A. Current tools for noninvasive objective assessment of skin scars. Plast Reconstr Surg. 2010;126(3):912–23. https://doi.org/10.1097/ PRS.0b013e3181e6046b.
- Merz KM, Pfau M, Blumenstock G, et al. Cutaneous microcirculatory assessment of the burn wound is associated with depth of injury and predicts healing time. Burns. 2010;36(4):477–82. https:// doi.org/10.1016/j.burns.2009.06.195.
- Verhaegen PD, van der Wal MB, Middelkoop E, et al. Objective scar assessment tools: a clinimetric appraisal. Plast Reconstr Surg. 2011;127(4):1561– 70. https://doi.org/10.1097/ PRS.0b013e31820a641a.
- Fong SS, Hung LK, Cheng JC. The cutometer and ultrasonography in the assessment of postburn hypertrophic scar—a preliminary study. Burns. 1997;23(Suppl 1):S12–8.
- Katz SM, Frank DH, Leopold GR, et al. Objective measurement of hypertrophic burn scar: a preliminary study of tonometry and ultrasonography. Ann Plast Surg. 1985;14(2):121– 7.
- Nedelec B, Correa JA, Rachelska G, et al. Quantitative measurement of hypertrophic scar: interrater reliability and concurrent validity. J Burn Care Res. 2008a;29(3):501–11. https://doi. org/10.1097/BCR.0b013e3181710881.
- Aya R, Yamawaki S, Muneuchi G, et al. Ultrasound elastography to evaluate keloids. Plast Reconstr Surg Glob Open. 2014;2(2):e106. https://doi.org/10.1097/GOX.0000000000000048
- Aya R, Yamawaki S, Yoshikawa K, et al. The shear wave velocity on elastography correlates with the clinical symptoms and histopathological features of keloids. Plast Reconstr Surg Glob Open. 2015;3(7):e464. https://doi.org/10.1097/ GOX.0000000000000445.
- Esposito G, Ziccardi P, Scioli M, et al. The use of a modified tonometer in burn scar therapy. J Burn Care Rehabil. 1990;11(1):86–90.
- Falanga V, Bucalo B. Use of a durometer to assess skin hardness. J Am Acad Dermatol. 1993;29(1):47–51.
- van Zuijlen PP, Angeles AP, Kreis RW, et al. Scar assessment tools: implications for current research. Plast Reconstr Surg. 2002;109(3) :1108– 22.
- Lee KC, Dretzke J, Grover L, et al. A systematic review of objective burn scar measurements. Burns Trauma. 2016;4:14. https://doi. org/10.1186/s41038-016-0036-x.
- Matsuzaki K, Kumagai N, Fukushi S, et al. Cultured epithelial autografting on meshed skin graft scars: evaluation of skin elasticity. J Burn Care Rehabil. 1995;16(5):496–502.
- Rennekampff HO, Rabbels J, Reinhard V, et al. Comparing the Vancouver Scar Scale with the cutometer in the assessment of donor site wounds treated with various dressings in a randomized trial. J Burn Care Res. 2006;27(3):345–51. https://doi.org/10.1097/01. BCR.0000216311. 61266.00.
- van Zuijlen PP, Vloemans JF, van Trier AJ, et al. Dermal substitution in acute burns and reconstructive surgery: a subjective and objective long-term follow-up. Plast Reconstr Surg. 2001;108(7):1938–46.
- van Zuijlen PP, Angeles AP, Suijker MH, et al. Reliability and accuracy of techniques for surface area measurements of wounds and scars. Int J Low Extrem Wounds. 2004;3(1):7–11. https://doi. org/10.1177/1534734604263200.
- Ahn ST, Monafo WW, Mustoe TA. Topical silicone gel for the prevention and treatment of hypertrophic scar. Arch Surg. 1991;126(4):499– 504.
- Sawada Y. A method of recording and objective assessment of hypertrophic burn scars. Burns. 1994;20(1):76–8.
- Ardehali B, Nouraei SA, Van Dam H, et al. Objective assessment of keloid scars with threedimensional imaging: quantifying response to intralesional steroid therapy. Plast Reconstr Surg. 2007;119(2): 556–61. https://doi.org/10.1097/ 01.prs.0000252505.52821.76.
- Taylor B, McGrouther DA, Bayat A. Use of a non-contact 3D digitiser to measure the volume of keloid scars: a useful tool for scar assessment. J Plast Reconstr Aesthet Surg. 2007;60(1):87–94. https://doi.org/10.1016/j.bjps.2005.12.051.
- Van der Aa T, Verhiel SH, Erends M, et al. A simplified three- dimensional volume measurement technique in keloid scars: Validity and reliability. J Plast Reconstr Aesthet Surg. 2015;68(11):1574– 80. https://doi.org/10.1016/ j.bjps.2015.07.001.