Bài viết Chất thay thế da và liệu pháp áp suất âm cho vết bỏng và sẹo – Tải file PDF Tại đây.
Tác giả: J. Genevieve Park và Joseph A. Molnar
Dịch: Bs. Trương Tấn Minh Vũ
10.1 Tổng quan về lịch sử
Chăm sóc vết bỏng có sự phát triển đáng kể trong vài thập kỷ qua, dẫn đến cải thiện khả năng sống sót của bệnh nhân và các thách thức lớn hơn đối với bác sĩ phẫu thuật tái tạo. Phần lớn khả năng sống sót được cải thiện là nhờ những tiến bộ trong y học chăm sóc đặc biệt, nhưng những thay đổi trùng hợp trong việc quản lý vết bỏng cũng đóng một vai trò quan trọng. Theo truyền thống, vết thương bỏng được để yên và phân vùng trong nhiều tuần, dẫn đến nhiễm trùng. Việc chấp nhận rộng rãi kỹ thuật cắt bỏ sớm và ghép da đã giảm thiểu vấn đề này và cải thiện khả năng sống sót. Với sự tiến bộ này, một vấn đề mới xuất hiện: làm thế nào để che phủ vết bỏng lớn với các vị trí lấy da tối thiểu. Phương pháp điều trị tiêu chuẩn phát triển thành ghép da dạng lưới, chia đôi độ dày trên vết thương, dẫn đến hình thành sẹo và co rút do thay thế da mất toàn bộ độ dày bằng lớp bì tối thiểu . Trong nỗ lực tăng khả năng sống sót của các vết bỏng có diện tích bề mặt cơ thể lớn hơn, tỷ lệ lưới trở nên lớn hơn và các mảnh ghép trở nên mỏng hơn để có thể lấy lại nhanh chóng vị trí lấy da. Tất cả những điều này dẫn đến các vấn đề ngày càng lớn hơn về hình thành sẹo, co rút và chức năng kém. Nhiều bệnh nhân sống sót sau những vết bỏng lớn hơn nhưng mối quan tâm là làm thế nào để bệnh nhân có chức năng và thẩm mỹ chấp nhận được để cuộc sống trở nên đáng sống.
Những tiến bộ trong những năm 1970 bao gồm sự phát triển của biểu mô được nuôi cấy và việc sử dụng ghép khác cá thể (allograft) và ghép khác loài (xenograft) để giải quyết vấn đề che phủ này. Ghép khác cá thể và ghép khác loài chỉ cho phép che phủ tạm thời cho đến khi các vị trí lấy da có thể được thu hoạch lặp lại để che phủ hoàn toàn. Sự theo dõi thấy rằng đôi khi lớp bì sẽ trở nên kết hợp vào vết thương dẫn đến khám phá rằng lớp biểu bì là phần kháng nguyên nhất trong ghép khác cá thể, và nếu phần này bị loại bỏ, lớp bì khác cá thể có thể được để lại trong vết thương với hy vọng cải thiện kết quả về chức năng và thẩm mỹ. Kết quả là những cố gắng để phát triển lớp bì đã khử tế bào có thể được đặt vào vết thương bỏng để thay thế lớp bì đã mất của vết bỏng toàn bộ độ dày và sau đó được che phủ bằng lớp biểu bì hoặc tế bào sừng của chính bệnh nhân được phát triển trong môi trường nuôi cấy.
Giấc mơ về biểu mô được nuôi cấy là để thay thế sự hạn chế về tính sẵn có của vị trí lấy da. Thật không may, người ta thấy rằng kết quả thường là lớp biểu bì không ổn định, dễ vỡ dẫn đến sự hình thành sẹo và co rút đáng kể. Hơn nữa, tế bào sừng được nuôi cấy có chi phí cao về thời gian, đắt tiền và sự phức tạp của quá trình mở rộng tế bào. Có một số thành công trong việc nuôi cấy tế bào sừng trực tiếp trên lớp bì tổng hợp hoặc ghép khác cá thể (để sử dụng làm miếng ghép tổng hợp), nhưng điều này tốn thời gian cũng như chi phí. Có một số thành công trong việc chữa lành vết thương toàn bộ độ dày bằng ghép khác cá thể, tiếp theo là các tấm CEA, với tỷ lệ thành công được báo cáo là 87–100%, với 4 năm theo dõi. Wainwright tiến hành một nghiên cứu thí điểm so sánh giữa miếng da ghép tách độ dày đơn thuần với AlloDerm và miếng da ghép chia nhỏ độ dày, cạnh nhau, ở ba bệnh nhân và kết quả cho thấy rằng về mặt chức năng và thẩm mỹ của nhóm AlloDerm vượt trội hơn sau 3 tháng. Điều này được cho là do ghép da khác cá thể không có tế bào cho phép hình thành lớp bì trưởng thành và liên tục hơn. Để so sánh, tại các vị trí ghép da tách độ dày dạng lưới, chất nền collagen chưa trưởng thành được thấy ở các vùng lưới hở, làm sự hình thành sẹo trở nên tệ hơn.
Một cách tiếp cận hoàn toàn khác để che phủ vết thương bỏng là sử dụng chất thay thế da từ công nghệ sinh học hoàn toàn. Burke và Yannas muốn phát triển một chất thay thế da cho bệnh nhân bỏng có sự tương đồng với da hơn là sẹo khi lành hoàn toàn. Chất thay thế da từ công nghệ sinh học được thiết kế để có hai lớp, giống như da bình thường có hai lớp: lớp bì và lớp biểu bì. Lớp bì được tạo thành từ collagen bò liên kết chéo và chondroitin 6-sulfate (glycosaminoglycan) từ cá mập với sự kiểm soát các đặc tính như liên kết chéo và độ xốp để kiểm soát sự phát triển và thoái hóa của tế bào. “Biểu bì” tạm thời được làm bằng silicon để ngăn ngừa mất nước và cung cấp khả năng bảo vệ cơ học cho chất thay thế lớp bì bên dưới. Sản phẩm này có ưu điểm là che phủ nhanh vết thương bỏng đã cắt bỏ đồng thời cung cấp một lớp bì cho phép miếng da ghép tách độ dày để tái thu hoạch nhanh các vị trí lấy da.
Lần đầu tiên da nhân tạo hai lớp của Burke và Yannas (sau này gọi là Integra) được báo cáo vào năm 1981, khi nó được sử dụng để điều trị cho những bệnh nhân bị bỏng tổng diện tích bề mặt cơ thể (TBSA) từ 50–90%. Tompkins và cộng sự thực hiện một nghiên cứu hồi cứu trên những người trưởng thành bị bỏng nặng và cho thấy khả năng sống sót được cải thiện có liên quan đến sử dụng da nhân tạo, có thể là do khả năng che phủ vết thương được cắt bỏ sớm hơn khi các vị trí lấy da tự thân bị hạn chế.
Mặc dù ban đầu được thiết kế để trở thành một sản phẩm cứu mạng sống, nhưng hy vọng là các chất thay thế da cũng sẽ mang lại kết quả vượt trội về mặt chức năng và thẩm mỹ so với ghép da tách độ dày tiêu chuẩn đơn thuần. Nghiên cứu ban đầu được công bố cho thấy sự sắp xếp collagen trong da Integra đã lành giống với lớp bì bình thường hơn là sẹo. Bệnh nhân và bác sĩ cũng chủ quan cho rằng nó bình thường hơn so với ghép da tách độ dày, với 72% bệnh nhân thích da được tái tạo bằng lớp bì nhân tạo 1 năm sau khi tái tạo. Các nhà nghiên cứu lưu ý rằng việc sử dụng lớp bì nhân tạo làm giảm khả năng xuất hiện sẹo bất lợi như khi sử dụng với ghép da tự thân dạng lưới, da thu được không có đặc điểm “da cá sấu” với hoa văn dạng lưới.
Vào những năm 1980, các bác sĩ lâm sàng báo cáo rằng khó để thực hiện với Integra, với tỷ lệ lấy được báo cáo thấp tới 43%, thường là do tích tụ dịch bên dưới lớp silastic. Trong một nghiên cứu tiền cứu, đa trung tâm trên 106 bệnh nhân, sự che phủ ngay lập tức với tiêu chuẩn chăm sóc (ghép da tách độ dày hoặc ghép khác cá thể) dẫn đến tỷ lệ đạt được là 79%, trong khi việc bao phủ ngay lập tức bằng Integra chỉ dẫn đến tỷ lệ đạt được là 62%. Một đánh giá hồi cứu trên 89 bệnh nhân liên tiếp được điều trị bằng Integra cho sẹo phì đại cho thấy dịch tích tụ dưới lớp silastic ở 14% trường hợp và có tình trạng vi khuẩn xâm nhập hoặc nhiễm trùng ở 20% trường hợp. Cần phải thận trọng mỗi ngày và chăm sóc vết thương để ngăn ngừa nhiễm trùng phát triển. Nhiều nghiên cứu tập trung vào việc phát triển loại băng lý tưởng để tối ưu hóa thành công.
Một thiết bị mới ra đời vào những năm 1990 giúp giải quyết vấn đề này. Việc sử dụng băng cho phép áp dụng áp suất dưới khí quyển vào vết thương được gọi là liệu pháp vết thương áp suất âm (negative-pressure wound therapy, NPWT) hoặc áp suất âm tại chỗ (topical negative pressure, TNP). Nó đẩy nhanh quá trình phát triển vào bên trong của mô hạt, giảm phù nề và giảm sự xâm chiếm của vi khuẩn trong nhiều trường hợp khác nhau theo một cơ chế không chắc chắn. Schneider và cộng sự chứng minh đây là một cách thuận tiện và hiệu quả để cố định các mảnh ghép da vì nó phù hợp với vết thương, loại bỏ khoảng chết, loại bỏ dịch thừa và có thể được sử dụng như nẹp (Hình 10.1).
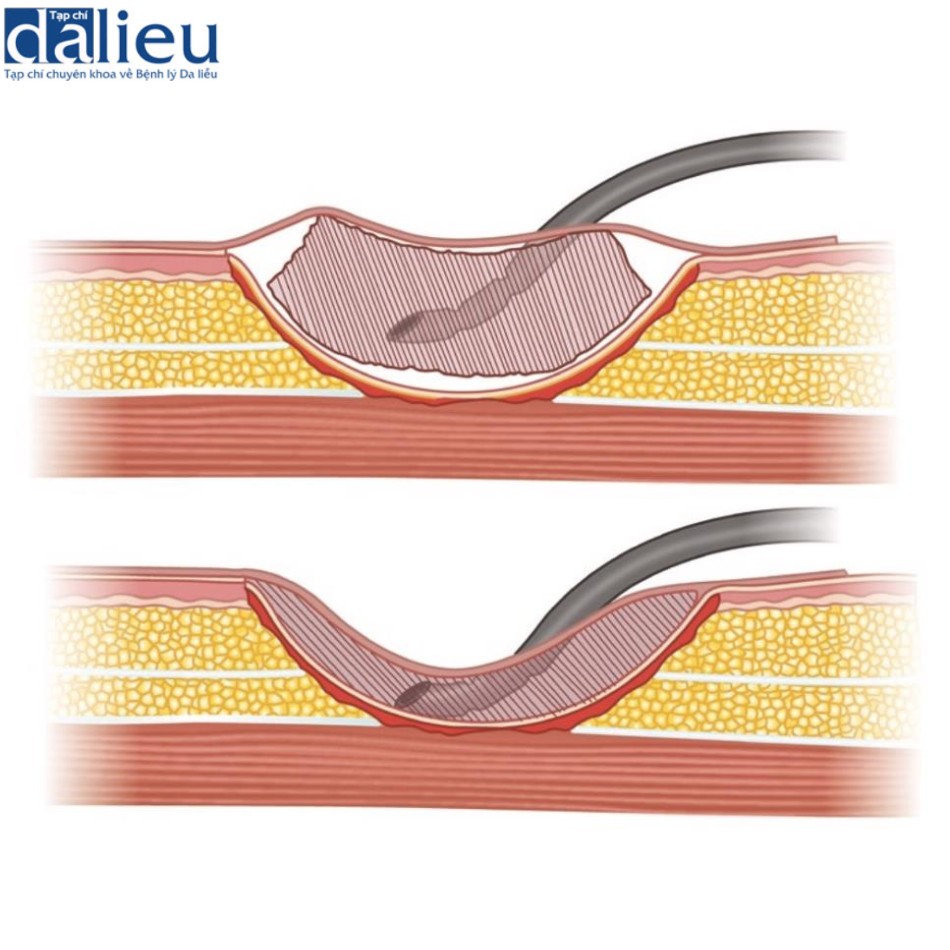
Thật hợp lý khi nghĩ rằng một thiết bị hoạt động tốt như vậy trên các mảnh da ghép cũng có thể hoạt động tốt với chất thay thế da nhân tạo. Những nỗ lực ban đầu đã cho thấy kết quả tuyệt vời trong các vết thương tái tạo phức tạp với tỷ lệ tiếp nhận gần 100%. Jeschke và cộng sự, trong một thử nghiệm tiền cứu ngẫu nhiên, chứng minh rằng các vết thương lớn có thể được che phủ bằng Integra, với tỷ lệ ghép là 98% khi sử dụng kết hợp với NPWT và keo fibrin. Việc sử dụng NPWT và keo fibrin cũng làm giảm khoảng thời gian chờ giữa đặt Integra và ghép da trên 50%. Molnar và cộng sự (2004) tìm thấy kết quả tương tự mà không cần keo fibrin. Những cải thiện này cũng dẫn đến việc giảm thời gian nằm viện của bệnh nhân được điều trị bằng Integra thay vì ghép da tách độ dày thông thường ở những vết bỏng lớn. Nó cũng cho phép dễ sử dụng hơn ở những bệnh nhân tái tạo khi điều trị ngoại trú. Một thử nghiệm đa trung tâm, ngẫu nhiên, có đối chứng trên 86 bệnh nhân cho thấy việc sử dụng NPWT không ảnh hưởng đáng kể đến việc nhận chất thay thế da (Matriderm) hoặc ghép da sau đó, nhưng nó đã cải thiện chất lượng sẹo. Hình 10.2 cho thấy một bé gái 15 tuổi bị bỏng toàn độ dày da ở hai bên chân. Vết bỏng được cắt bỏ tới lớp mỡ và phủ Integra. Bé gái trải qua NPWT và trì hoãn ghép da tách độ dày, kết quả chức năng tuyệt vời sau 6 tháng.
Sau thành công ban đầu trong việc che phủ vết thương bỏng cấp tính, các chất thay thế da nhanh chóng được áp dụng để giải quyết các tình trạng lâm sàng khác, bao gồm sẹo phì đại và sẹo lồi, vết thương do chấn thương, khuyết mô mềm sau cắt bỏ do ung thư và vết thương mãn tính.
10.2 Quá trình lành thương sử dụng chất thay thế da
Phần này tóm tắt đơn giản về các khái niệm có thể giúp bác sĩ hiểu rõ hơn về sự tái tạo của da sử dụng chất thay thế da. Chúng tôi hy vọng rằng hiểu biết này sẽ giúp bác sĩ lâm sàng xác định đúng ứng dụng của phương pháp này và giúp khắc phục một số vấn đề có thể phát sinh.
Sự tái tạo của da bình thường là một mục tiêu cao nhất. Da bình thường bao gồm hai lớp, lớp biểu bì và lớp bì, được ngăn cách bởi một màng đáy. Loại tế bào chính trong lớp biểu bì là tế bào sừng, và tế bào này rất quan trọng đối với chức năng hàng rào của da. Lớp biểu bì cũng chứa tế bào hắc tố, cung cấp sắc tố cho da. Lớp biểu bì và lớp bì được ngăn cách bởi một màng đáy mỏng, một kết nối đan xen bao gồm gờ rete biểu bì và nhú bì. Loại tế bào chính trong lớp bì là nguyên bào sợi, có chức năng duy trì và tái cấu trúc chất nền ngoại bào, chủ yếu bao gồm collagen và proteoglycan. Ở lớp bì bình thường, các sợi collagen được định hướng ngẫu nhiên. Lớp bì cũng chứa các cấu trúc phụ, bao gồm nang lông và tuyến mồ hôi. Các chất thay thế da không tái tạo da bình thường, nhưng chúng có thể cho phép vết thương lành lại với một số đặc tính của da bình thường: bảo vệ khỏi nhiễm trùng, mất nước do bốc hơi và độ mềm dẻo và độ đàn hồi thích hợp không hạn chế sự chuyển động hoặc tăng trưởng.
Quá trình lành thương bình thường diễn ra qua ba giai đoạn chồng lặp: viêm (ngày 2–5), tăng sinh (ngày 4–14) và tái cấu trúc (8 ngày đến 1 năm). Trong giai đoạn viêm, các yếu tố tăng trưởng và cytokine thu hút bạch cầu trung tính và bạch cầu đơn nhân đến vùng bị thương. Bạch cầu đơn nhân biệt hóa thành đại thực bào, loại bỏ các mảnh vụn, tiêu diệt vi khuẩn và tiết ra cytokine và các yếu tố tăng trưởng quan trọng đối với giai đoạn tăng sinh của quá trình lành thương. Trong giai đoạn tăng sinh, nguyên bào sợi và tế bào sừng di chuyển vào vết thương. Keratinocytes bắt đầu tái tạo biểu mô da, trong khi nguyên bào sợi bắt đầu tiết ra collagen và các protein khác, bao gồm proteoglycan và glycosaminoglycan, tạo ra một chất nền ngoại bào chưa trưởng thành. Một số nguyên bào sợi biệt hóa thành nguyên bào sợi cơ, thúc đẩy sự co lại của vết thương. Nguyên bào sợi cũng tiết ra các enzyme có chức năng điều chỉnh và tăng sự thay thế của chất nền ngoại bào trong giai đoạn tái cấu trúc. Collagen trở nên thẳng hàng trong sẹo trưởng thành.
Việc lành vết thương toàn bộ độ dày bằng cách liền sẹo thứ cấp dựa vào sự co lại của vết thương để đóng vết thương, dẫn đến da dày, xơ, không mềm dẻo. Các nghiên cứu mô học chứng minh biểu mô có bè ngoài bình thường và lớp bì thưa thớt, bất thường. Các vết thương sâu một phần độ dày, giữ lại một số lớp bì, biểu hiện sự co lại mạnh mẽ và có thể dẫn đến sẹo không mong muốn, bao gồm sẹo phì đại, co thắt và sẹo lồi. Lớp bì bất thường đặc trưng cho sẹo phì đại và sẹo lồi: sẹo phì đại chứa các vùng nốt với nguyên bào sợi cơ và collagen định hướng ngẫu nhiên, còn sẹo lồi có các sợi collagen dày xếp chặt vào nhau.
Sự hiện diện của lớp bì đầy đủ và “bình thường” có thể ngăn ngừa sự hình thành sẹo bất lợi, duy trì độ mềm dẻo và giảm co thắt. Ghép da cung cấp cho vết thương lớp bì và biểu bì bình thường, và ghép dày hơn (có nhiều lớp bì hơn) làm giảm co thắt vết thương. Một chất thay thế da được thiết kế như một khung để thúc đẩy sự hình thành lớp bì dày hơn và do đó ngăn ngừa sự hình thành sẹo bất thường, bất lợi. Các nghiên cứu vào những năm 1980 chứng minh rằng điều này thực sự có hiệu quả: đặt khung phù hợp vào nền vết thương khiến nguyên bào sợi của vật chủ lấp đầy khung và từ từ thay thế khung bằng ma trận chất nền tương tự như chất nền của lớp bì bình thường, thường được gọi là “lớp bì mới”. Các tế bào sống đồng loài, được tích hợp vào một số chất thay thế da, được thay thế bằng các tế bào của chính vật chủ sau vài tuần; chức năng chính của chúng có thể là tiết ra các yếu tố tăng trưởng. Một lớp biểu bì tích hợp với lớp bì mới hình thành sau khi đặt miếng ghép da biểu mô mỏng.
NPWT biểu hiện đẩy nhanh quá trình “nhận” chất thay thế da, nhưng cơ chế vẫn chưa được hiểu đầy đủ. Ở vết thương hở, NPWT ngay lập tức làm tăng lưu lượng máu, tăng tốc độ hình thành mô hạt và giảm tải lượng vi khuẩn. Các nghiên cứu sâu hơn chỉ ra rằng nó thúc đẩy quá trình lành thương bằng sự biến dạng vĩ mô, biến dạng vi mô, loại bỏ dịch và thay đổi các yếu tố truyền tín hiệu tế bào trong vết thương. Người ta đưa ra giả thuyết, nhưng chưa được chứng minh, rằng NPWT làm tăng sự phát triển và tăng sinh của các tế bào trong chất thay thế da bằng các cơ chế tương tự. Sau 3 ngày sử dụng NPWT, có sự tăng sinh mạch máu và bám dính tốt hơn của Integra (dữ liệu chưa công bố). Một nghiên cứu mô học về tái tạo bề mặt sẹo phì đại với Integra dường như cho thấy điều ngược lại: tân sinh mạch mạch không khác biệt đáng kể khi có hoặc không có NPWT. NPWT có thể chỉ đơn giản là cải thiện độ bám dính của chất thay thế da vào nền vết thương bằng cách loại bỏ khoảng chết. Bất kể cơ chế nào, NPWT trở thành một công cụ đáng tin cậy để sử dụng với chất thay thế da.
10.3 Ứng dụng lâm sàng của chất thay thế da
Ứng dụng ban đầu của chất thay thế da là ở những bệnh nhân bị bỏng nặng. Công nghệ này nhanh chóng được áp dụng để che phủ vết thương toàn độ dày trong các tình huống lâm sàng khác từ năm 2001. Việc sử dụng chất thay thế da, có và không có NPWT, trong quá trình tái tạo vết thương không liên quan đến vết thương bỏng được đánh giá rộng rãi. Phần này đóng vai trò là bản tóm tắt ngắn gọn về một số ứng dụng phổ biến nhất của chất thay thế da và NPWT trong việc ngăn ngừa và điều trị sẹo bất thường.
10.3.1 Chấn thương bỏng cấp tính
Cắt bỏ sớm và che phủ vết thương được chứng minh là làm giảm tỷ lệ tử vong và đẩy nhanh quá trình phục hồi sau chấn thương bỏng, và việc đóng vết thương trong vòng 2–3 tuần được chứng minh là làm giảm tỷ lệ hình thành sẹo phì đại do bỏng. Chiến lược phổ biến nhất để che phủ vết thương sớm là đặt ngay một miếng ghép da tách độ dạng lưới, khi có sẵn. Tuy nhiên, nếu bệnh nhân có ít vị trí lấy da hoặc không thể chịu đựng được việc lấy da ghép, chất thay thế da có thể được đặt để che phủ tạm thời, ngay lập tức các vết thương đã cắt bỏ. Năm 1981, Burke và cộng sự báo cáo việc sử dụng thành công Integra như một chất nền da tạm thời ở những bệnh nhân bị bỏng TBSA 50–90%, cho đến khi việc ghép da diễn ra vài tuần sau đó. Nhiều nghiên cứu tiếp theo chứng minh việc sử dụng thành công nhiều chất thay thế da khác nhau trong việc che phủ ban đầu các vết bỏng cấp tính, lớn. Một ví dụ về vết bỏng cấp tính được điều trị bằng Integra và NPWT được thể hiện trong Hình 10.2.
Cuono và cộng sự chỉ ra rằng lớp bì của tử thi người đã khử tế bào (AlloDerm) có thể được sử dụng để che phủ vết bỏng đã cắt bỏ trong khi các tế bào sừng tự thân được nuôi cấy và mở rộng. Các tế bào sừng tự thân sau đó được gieo trên lớp bì mới với sự ghép nối thành công. Nghiên cứu hồi cứu của những bệnh nhân bỏng nặng phát hiện ra rằng việc đặt AlloDerm với ghép da tách độ dày trên các khớp chính không gây hạn chế chuyển động ở 43% bệnh nhân.
Một trong những vùng khó điều trị nhất là bàn tay bị bỏng, do bàn tay có xu hướng hình thành các vết co thắt giới hạn chuyển động chức năng. Đã có thành công trong việc điều trị bỏng cấp tính ở bàn tay bằng Integra và ghép da tách độ dày trì hoãn. Nghiên cứu trên 11 ca bỏng cấp tính toàn bộ độ dày da ở bàn tay chứng minh hiệu quả của phương pháp này, chỉ có hai bàn tay có sẹo phì đại cần phẫu thuật thêm.
Di chứng của chấn thương bỏng ở mặt có thể rất tàn khốc. Sẹo phì đại có thể dẫn đến lật mi, miệng nhỏ, sẹo phì đại, ngoài ra còn gây mất thẩm mỹ và kỳ thị xã hội. Do đó, phòng ngừa sẹo phì đại là một lĩnh vực được quan tâm trong lâm sàng trong một thời gian khá dài. Nhiều bác sĩ báo cáo kết quả tốt khi sử dụng chất thay thế da để che phủ vết bỏng cấp tính ở mặt. Trong một nghiên cứu ở 16 bệnh nhân bị bỏng sâu ở mặt đã được cắt bỏ sớm vết bỏng (trong vòng 3 ngày sau khi bị thương), sau đó được che phủ ngay bằng chất nền lớp bì không có tế bào và lớp ghép biểu mô da phủ lên (độ dày khoảng 8/1000 inch). Sau ca phẫu thuật một giai đoạn này, các tác giả báo cáo nhận 97% vào ngày thứ 14 sau phẫu thuật và tỷ lệ biến chứng liên quan đến sẹo phì đại thấp (một bệnh nhân bị miệng nhỏ, hai bệnh nhân bị lộn mi). Một ca phẫu thuật một giai đoạn sử dụng Matriderm và ghép da mỏng ở bỏng mặt ở cả trẻ em và người lớn được sử dụng với kết quả khả quan.
NPWT trên bỏng mặt thường không được khuyến khích do khó duy trì độ kín và các vấn đề về đường thở. Tuy nhiên, nó có thể được đặt an toàn trên tai. Chênh lệch áp suất 1/6 atm không gây hại cho màng nhĩ. Nó cũng có thể được sử dụng an toàn trên mắt với khâu mí mắt tạm thời.
10.3.2 Di chứng của tổn thương bỏng: Sẹo phì đại và co thắt
Sẹo phì đại, thường gặp sau tổn thương bỏng sâu một phần và toàn bộ độ dày da, có biểu hiện ngứa, biến dạng, đỏ và không đàn hồi, thường dẫn đến biến dạng và hình thành co thắt. Sẹo phì đại hình thành thông qua sự tương tác phức tạp của các cytokine gây xơ hóa, nguyên bào sợi và tế bào sừng bất thường, và chất nền ngoại bào (ECM) bất thường. So với sẹo trưởng thành, ECM của sẹo phì đại chứa nhiều proteoglycan, glycoprotein và collagen loại III (tìm thấy trong sẹo chưa trưởng thành) hơn và collagen dạng nốt vô tổ chức. Các phương pháp điều trị không phẫu thuật, chẳng hạn như phủ gel silicon, liệu pháp áp lực (đè), tiêm corticosteroid, liệu pháp lạnh và liệu pháp laser, được chứng minh là có hiệu quả ở hơn 50% bệnh nhân. Sẹo phì đại không đáp ứng với các phương pháp điều trị bảo tồn có thể được can thiệp phẫu thuật bằng cách cắt bỏ hoặc giải phóng co thắt sau đó là che phủ vết thương. Mở rộng mô, vạt tại chỗ (Z-plasty), vạt vùng, vạt tự do, ghép da hoặc chất thay thế da có thể che phủ vết thương.
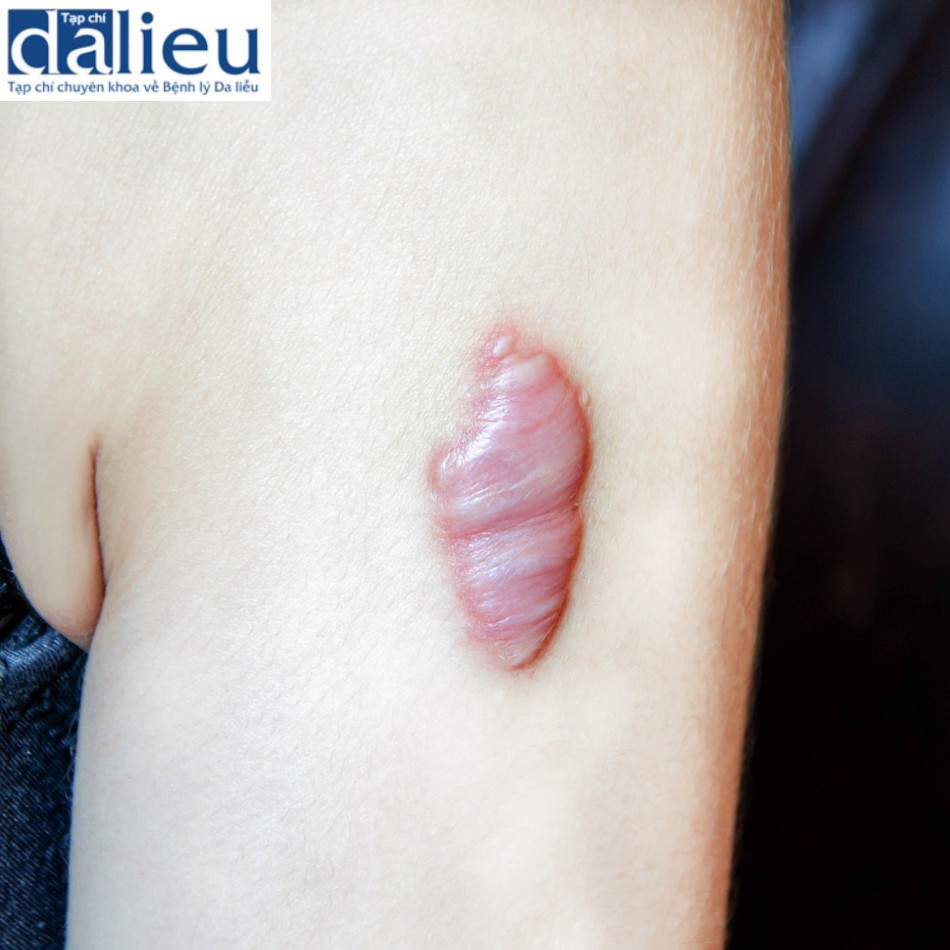
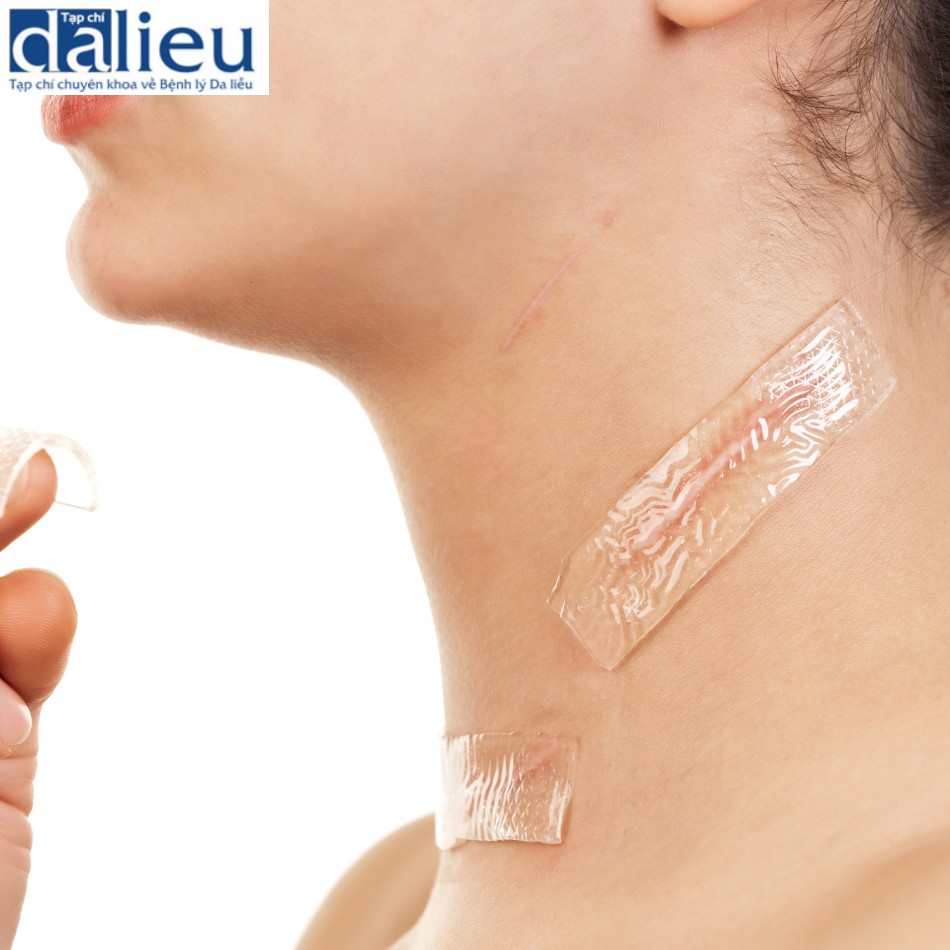
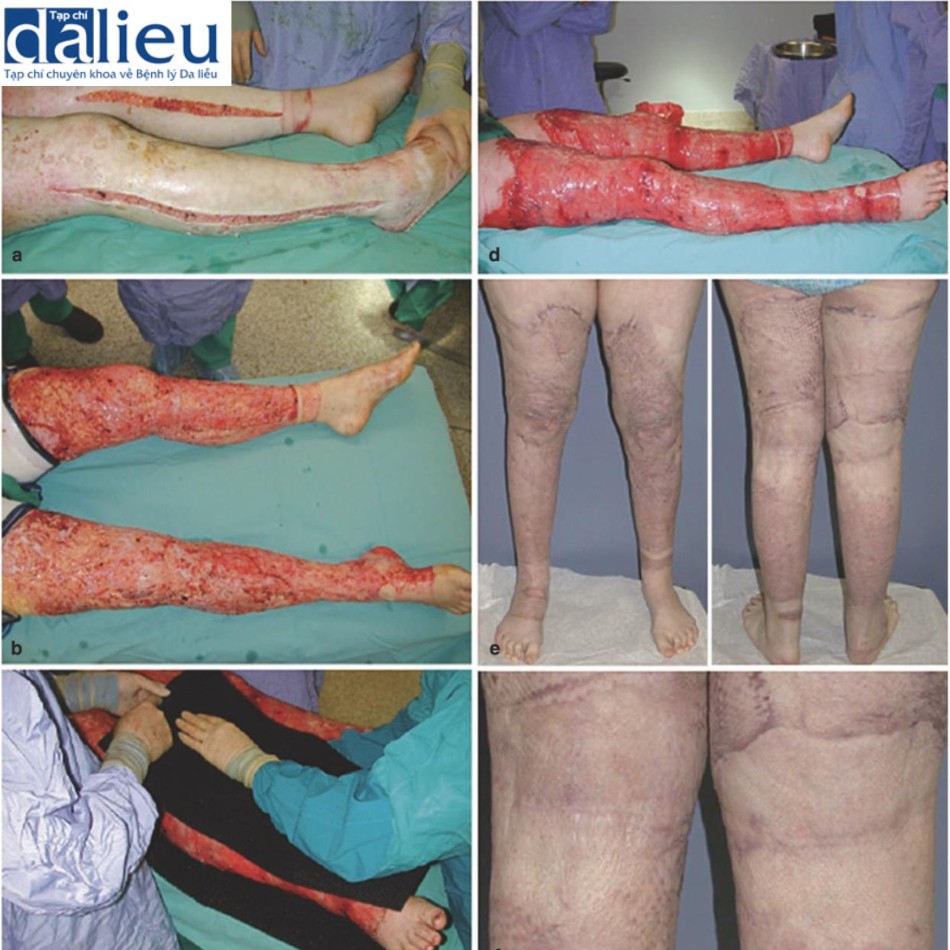
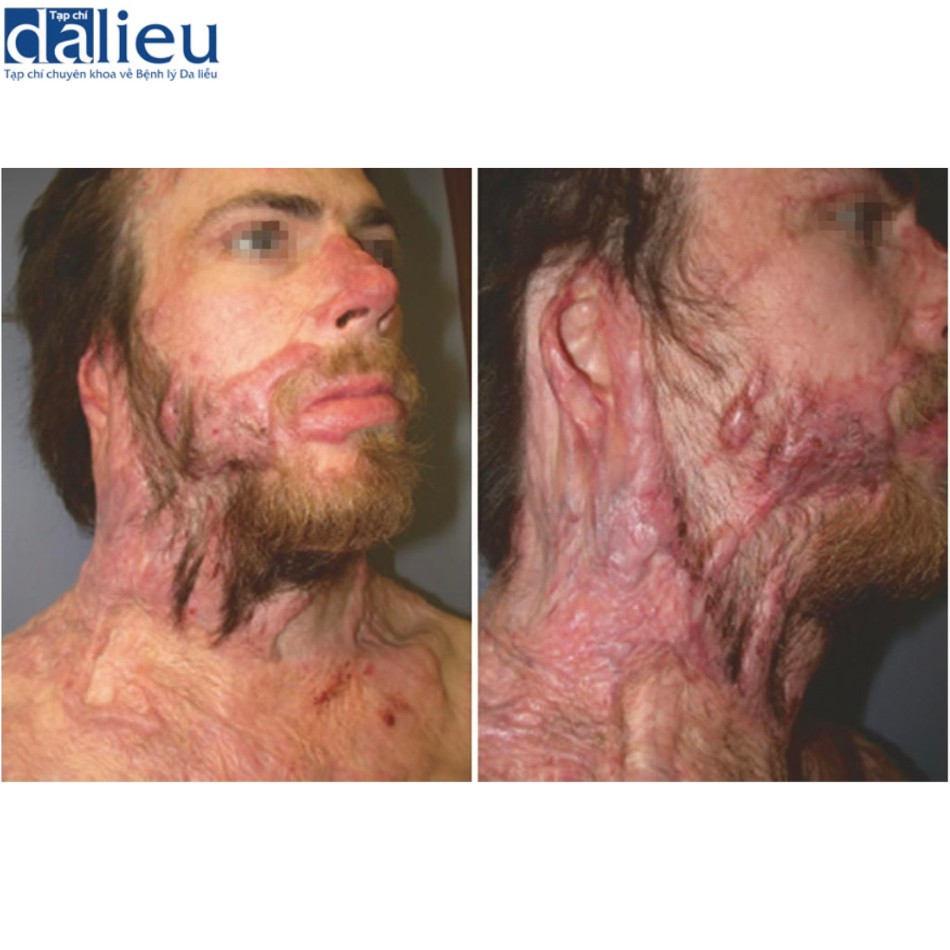
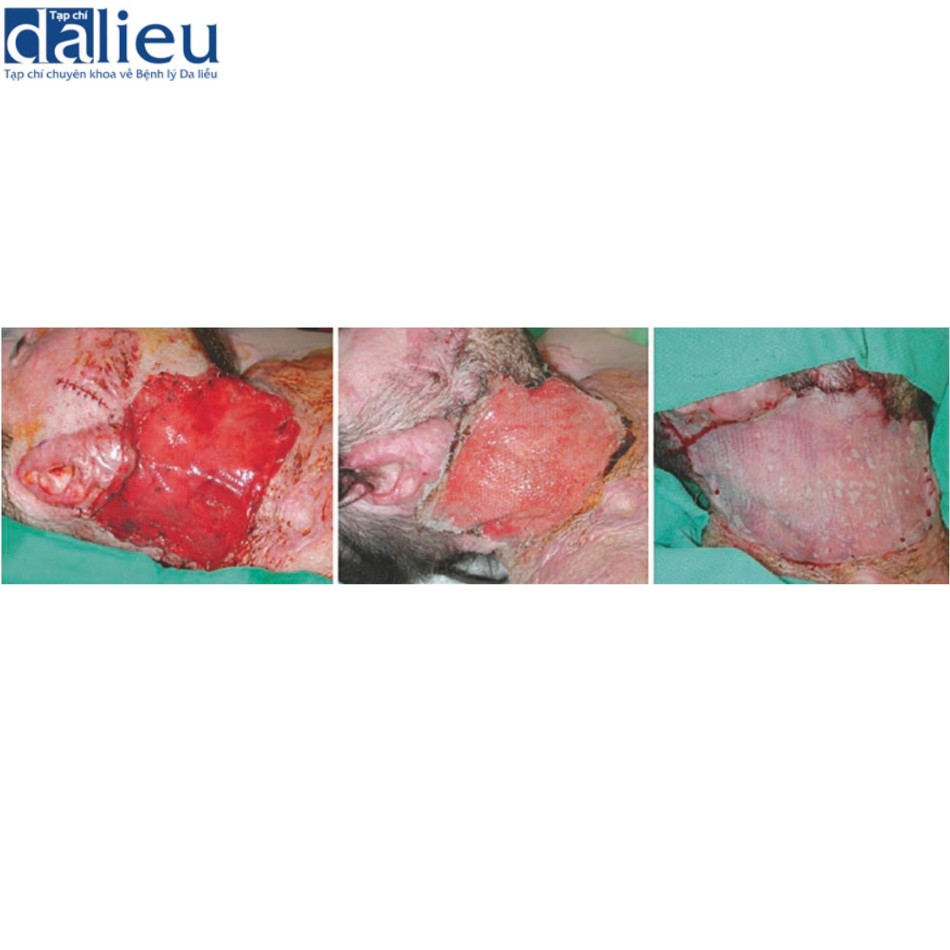
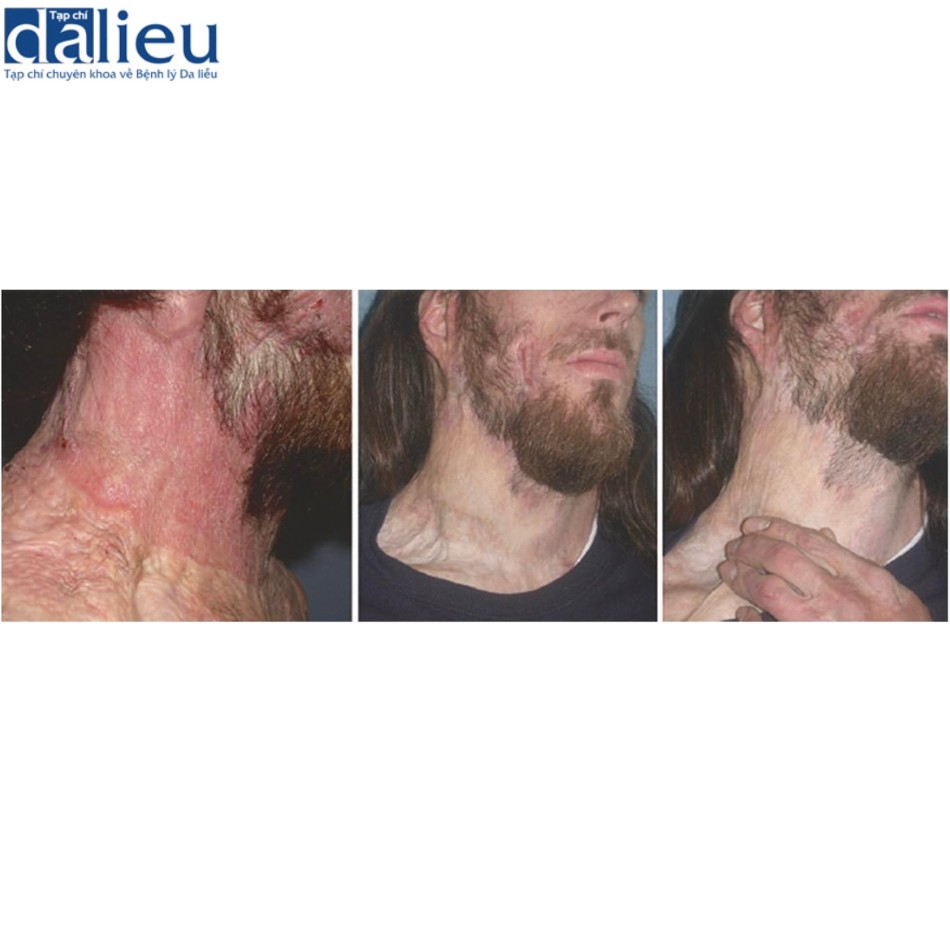
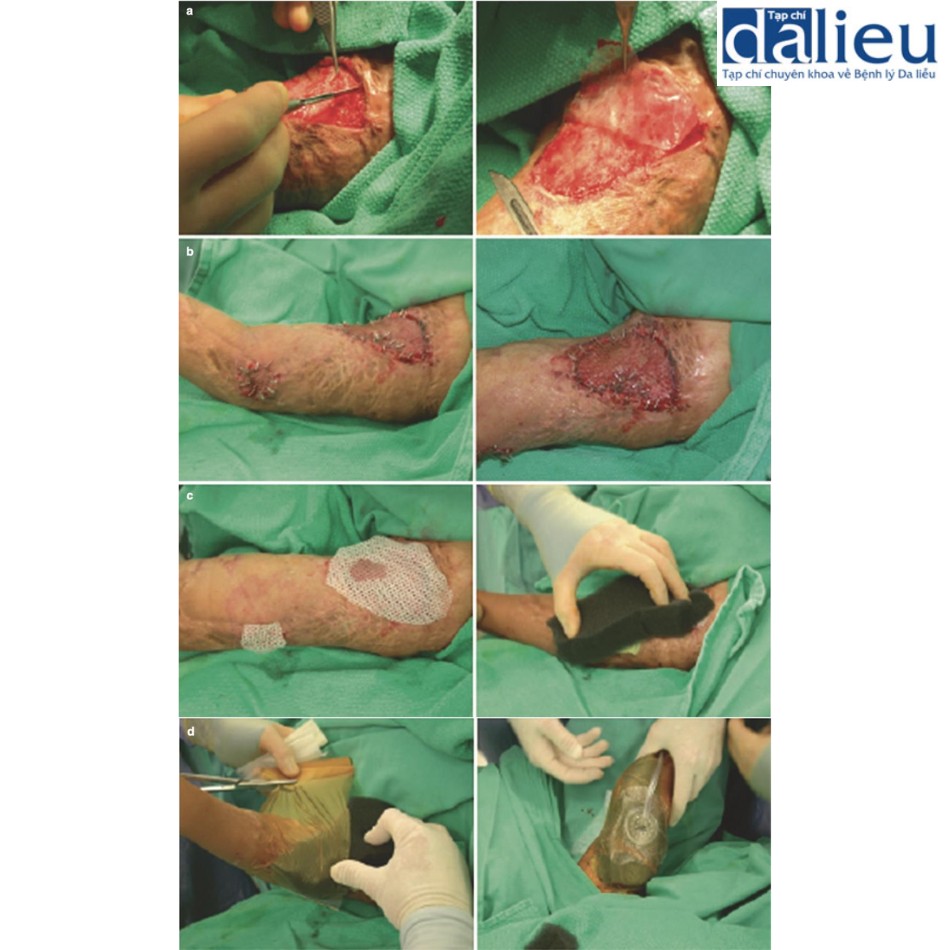
Có một số báo cáo về việc điều trị thành công sẹo phì đại bằng cách tái tạo bề mặt với chất thay thế da. Một trong những báo cáo đầu tiên về thành công với phương pháp này là sử dụng Matriderm và miếng ghép da (trong quy trình hai giai đoạn), cho thấy phương pháp này cải thiện đáng kể độ mềm dẻo, độ đàn hồi và sự co lại của gần như tất cả 44 vết sẹo. Moiemen và cộng sự chứng minh rằng Integra có thể được sử dụng để cải thiện chất lượng sẹo phì đại trong một nghiên cứu trường hợp 35 vết sẹo và báo cáo tỷ lệ thành công sau đó trên 95% khi sử dụng kết hợp với NPWT. Một nghiên cứu ban đầu khác về giải phóng co thắt được che phủ bởi Integra báo cáo tỷ lệ tái phát là 25% trong thời gian theo dõi trung bình là 11,4 tháng. Điều này thật tuyệt vời khi so sánh với các nghiên cứu khác tại thời điểm đó báo cáo tỷ lệ tái phát 38–80% khi sử dụng miếng ghép da toàn bộ độ dày và tách độ dày. Sẹo phì đại được tái tạo bề mặt với Integra biểu hiện vẫn giữ được độ mềm dẻo và độ đàn hồi trong hơn 2 năm theo dõi. Hình 10.3 cho thấy một người đàn ông 23 tuổi bị sẹo phì đại ở cổ 1 năm sau khi bị thương. Sẹo được cắt bỏ và phủ bằng Integra. Một miếng ghép da dày 0,010 inch được đặt 2 tuần sau đó (Hình 10.4). Không có sẹo phì đại tái phát trong 2 năm theo dõi (Hình 10.5).
Một trong những vùng khó điều trị nhất đối với sẹo bỏng phì đại là ở bàn tay. Sự giải phóng co thắt thường dẫn đến các vùng hở cần được che phủ bằng da có độ đàn hồi tốt. Trong khi ghép da toàn độ dày vẫn là tiêu chuẩn điều trị, các chất thay thế da cũng được sử dụng để cải thiện phạm vi chuyển động của bàn tay. Quy trình hai giai đoạn gồm ứng dụng ban đầu Integra, tiếp theo là ghép da tách độ dày, là chủ đề của một số loạt ca hồi cứu, với tỷ lệ thành công cao tới 100%. Trong một nghiên cứu, hơn 75% bệnh nhân duy trì được phạm vi chuyển động được cải thiện của họ trong vòng 6 tháng đến 6 năm. Điều thú vị là một số kết quả tốt nhất được mô tả trong một loạt ca gồm chín bệnh nhân trải qua quá trình tái cấu trúc hai giai đoạn bằng AlloDerm (được dán bằng keo fibrin và cố định bằng NPWT) và ghép da tách độ dày. Sau hơn 10 tháng theo dõi, các bệnh nhân vẫn duy trì được 83% cải thiện sau phẫu thuật về phạm vi chuyển động và độ sâu của khoảng lưới. Một loạt ca bệnh nhân được điều trị bằng tái cấu trúc một giai đoạn bằng Matriderm và ghép da tách độ dày báo cáo 100% nhận miếng ghép và kết quả chức năng tốt sau 12 tháng theo dõi.
Điều thú vị là các vết co thắt vú do bỏng được điều trị với các chất thay thế da. Sau khi giải phóng các vết co thắt này, có một khiếm khuyết da lớn khó có thể che phủ bằng ghép da toàn độ dày. Thay vào đó, Integra được sử dụng để che phủ vết thương. Da lành lại cho phép vú tiếp tục phát triển và chỉ có 1 trong 13 trường hợp được báo cáo là co thắt tái phát.
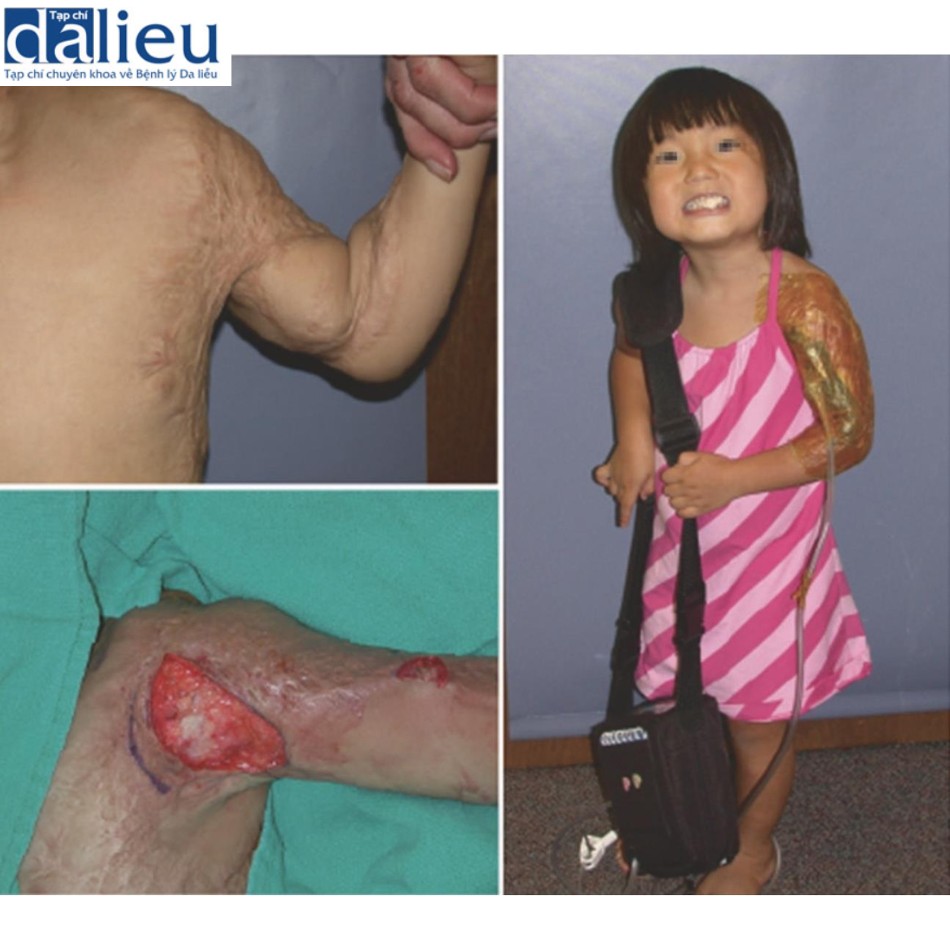
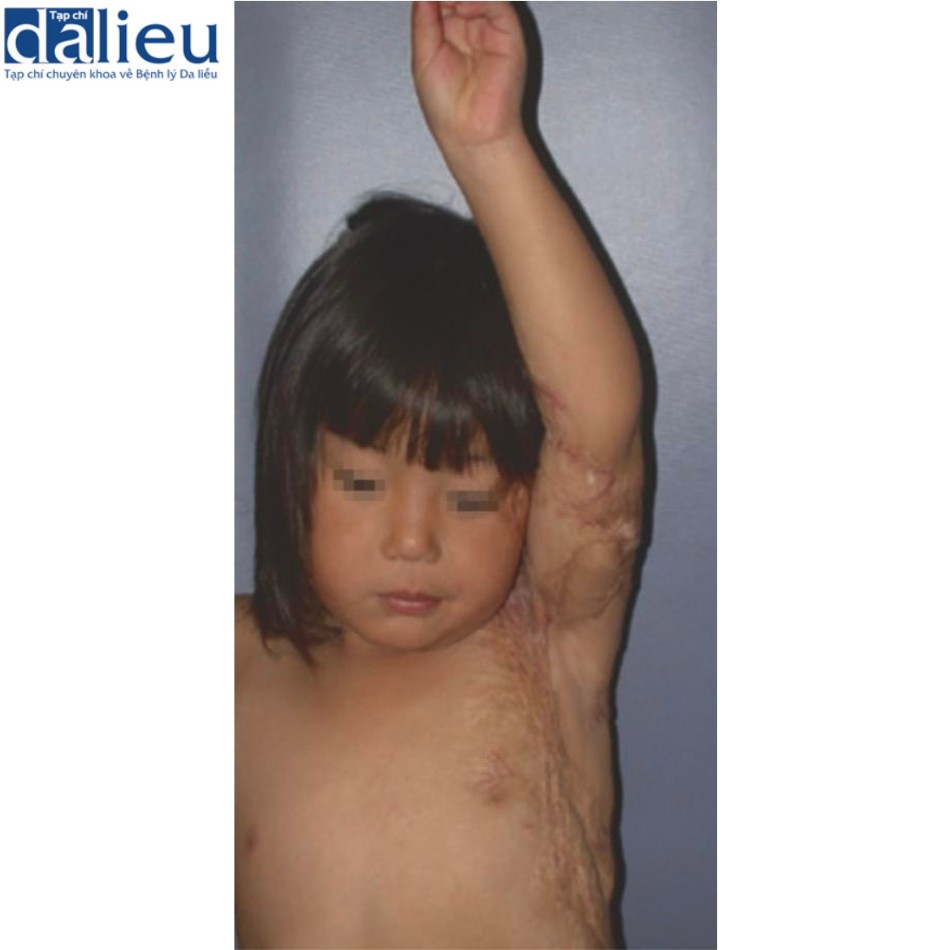
Sẹo bỏng phì đại ở trẻ em được cải thiện khi tái tạo bề mặt bằng chất thay thế da, có hoặc không có NPWT. Hình 10.6 cho thấy một bé gái châu Á 4 tuổi bị bỏng ở cánh tay trái, nách và ngực khi mới 9 tháng tuổi. Bé bị sẹo bỏng co thắt ở nách và khuỷu tay trái, hạn chế phạm vi chuyển động. Bé trải qua phẫu thuật giải phóng vết sẹo co thắt ở nách. Integra và NPWT được áp dụng cho nách trước để không gây nguy hiểm cho mô vú (Hình 10.7). Bảy ngày sau, một miếng ghép da dày 0,006 inch được đặt lên trên Integra. Cô ấy nhận 100% miếng ghép da và có thể cử động toàn bộ (Hình 10.8). Không có tình trạng co thắt tái phát trong 14 năm theo dõi.
10.3.3 Vết thương chấn thương: Mất mô mềm với lộ xương và gân
Các chất thay thế da và NPWT trở thành công cụ quan trọng trong điều trị vết thương chấn thương với lộ xương và gân. Chấn thương mô mềm và chấn thương chỉnh hình có thể khó đóng lại. Nhiều trường hợp cần phải đặt vạt để bảo vệ gân và xương bị lộ khỏi bị nhiễm trùng. NPWT đơn trị liệu được ủng hộ là một cách tốt để đẩy nhanh quá trình tạo mô hạt trên xương, gân và phần cứng bị lộ, từ đó làm giảm kích thước vết thương và tạo ra vết thương phù hợp để đặt mảnh ghép da hoặc vạt. Một nghiên cứu hồi cứu gồm 75 bệnh nhân với vết thương ở chi dưới được điều trị ban đầu bằng NPWT sau khi cắt lọc cho thấy kích thước vết thương giảm và hình thành mô hạt ở 95% bệnh nhân. Tất cả các vết thương đều phù hợp để ghép da tách độ dày hoặc đóng vạt. Phương pháp này cũng được chứng minh là có hiệu quả để điều trị tổn thương kiểu tháo găng ở tay và chân. NPWT là một phương pháp hiệu quả để chuẩn bị nền vết thương có lộ xương trong các vết thương chấn thương, cụ thể là gãy xương chày hở, bao gồm cả những chấn thương ở bệnh nhi. NPWT và cắt lọc liên tục có thể đóng vai trò là cầu nối để đóng vết thương hoàn toàn và thực sự có thể rút ngắn thời gian liền xương.
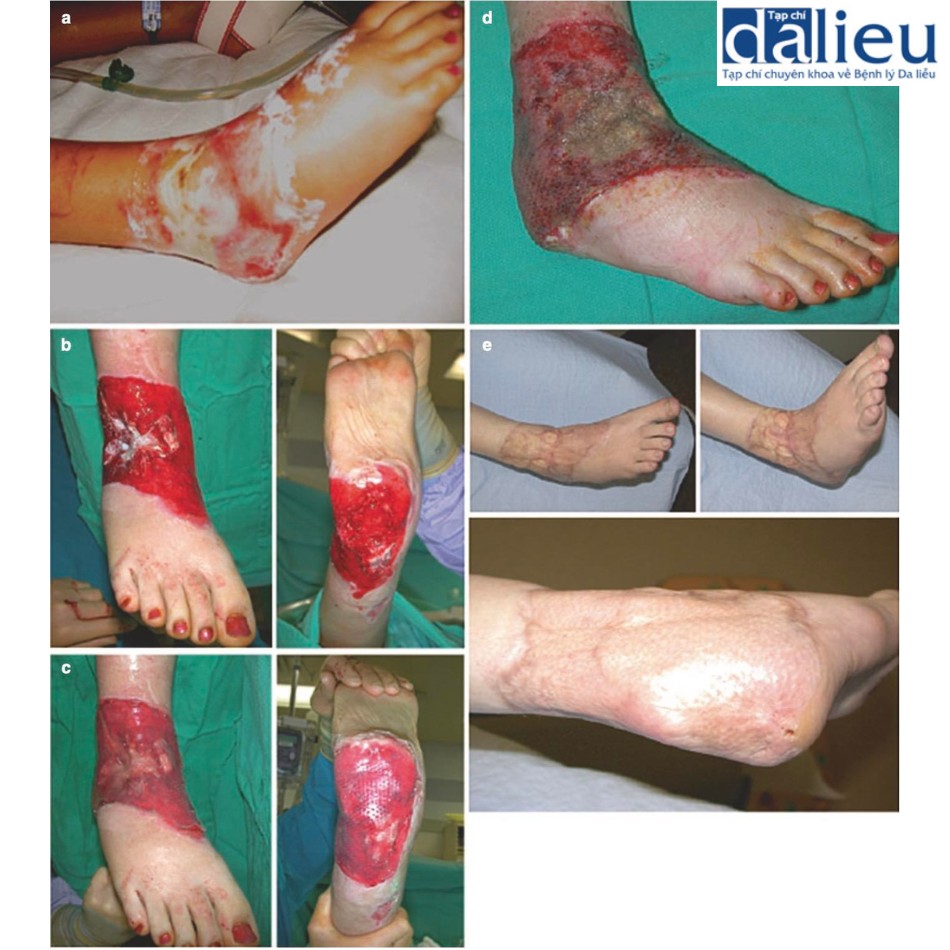
Sự kết hợp giữa chất thay thế da, NPWT và ghép da tách độ dày trì hoãn được chứng minh là có hiệu quả trong việc chữa lành vết thương chấn thương có lộ xương và gân trong một số nghiên cứu. Hình 10.9 là một ví dụ về vết thương bỏng sâu ở mắt cá chân có dây chằng, gân, xương và khớp bị lộ được điều trị thành công bằng NPWT và chất thay thế da.
Phương pháp này cũng được chứng minh là hữu ích trong việc điều trị các vết thương phức tạp liên quan đến chiến đấu. Một đánh giá hồi cứu gần đây trên 251 vết thương chiến đấu được điều trị tại Trung tâm Y tế Quân đội Quốc gia Walter Reedas cho thấy 80% vết thương đã lành sau lần cố gắng đóng vết thương ban đầu với Integra, NPWT và ghép da trì hoãn.
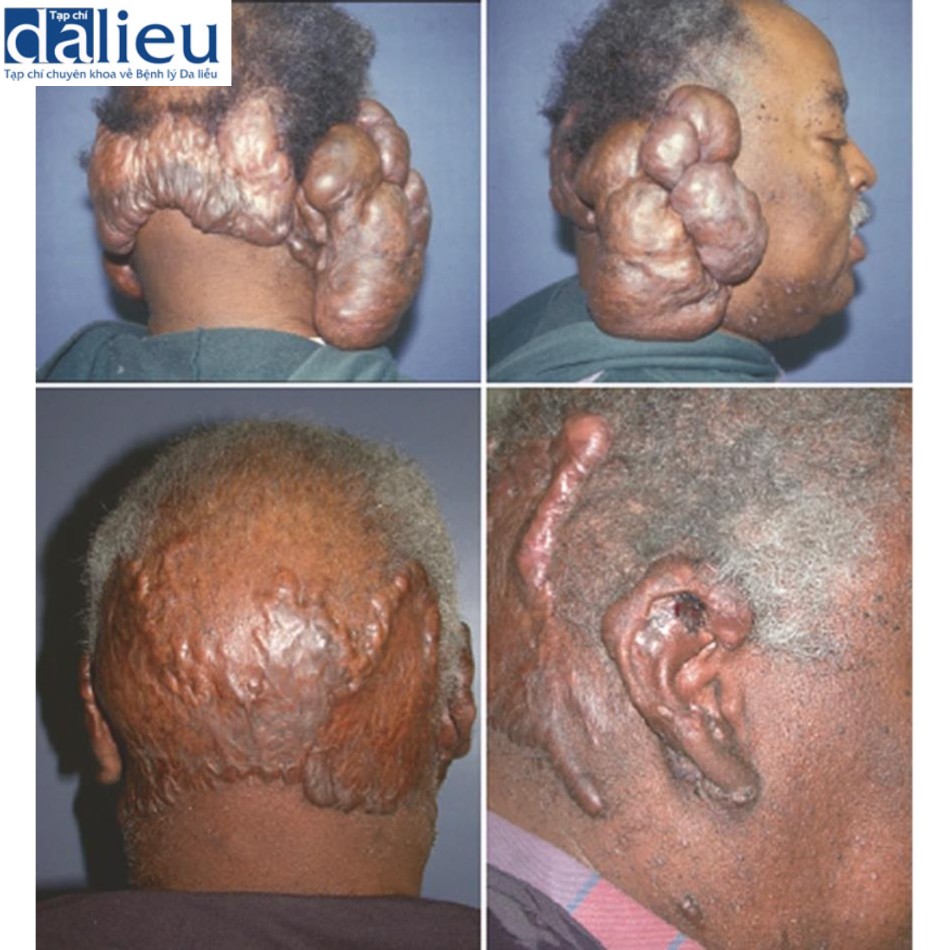
10.3.4 Sẹo lồi
Sẹo lồi xuất hiện khi có đáp ứng lành thương bất thường đối với vết thương ở da. Cơ chế bệnh sinh của sẹo lồi được nhắc lại trong cuốn sách này và các sách khác. Kết quả cuối cùng là một tổn thương lành tính tiếp tục phát triển vượt ra ngoài rìa của vết thương ban đầu. Các nghiên cứu mô học cho thấy lớp biểu bì biểu hiện bình thường và lớp bì dày và bất thường rõ rệt, đặc trưng bởi các bó collagen rộng và các dải xơ, tăng lượng proteoglycan, thâm nhiễm viêm và nguyên bào sợi. Sẹo lồi có thể gây đau, ngứa, giảm phạm vi cử động, nhiễm trùng và bị xã hội xa lánh. Các phương pháp điều trị phổ biến bao gồm tiêm steroid, tiêm fluorouracil (5-FU), xạ trị và cắt bỏ, nhưng tỷ lệ tái phát cao (45– 100%).
Một số báo cáo ca bệnh về điều trị thành công sẹo lồi, không đáp ứng với các phương pháp điều trị khác, bằng cách cắt bỏ và đặt chất thay thế da được công bố. Việc sử dụng Integra, tiếp theo là ghép da tách độ dày hoặc ghép biểu mô, được báo cáo thường xuyên nhất, không có tái phát trong hầu hết các trường hợp trong vòng 6–24 tháng theo dõi. Một ví dụ được thể hiện trong Hình 10.10. Trong một số trường hợp, tái phát được báo cáo ở rìa vết thương, sau đó được điều trị bằng cách cắt bỏ và tiêm 5-FU. Patel và cộng sự sử dụng AlloDerm để điều trị thành công 8 vết sẹo lồi, không có tái phát trong vòng 48 tháng theo dõi. Có suy đoán, nhưng không có bằng chứng chắc chắn, rằng chất thay thế da cung cấp một cái khung giúp thúc đẩy tái tạo lớp bì bình thường. Cần có các nghiên cứu tiền cứu lớn hơn so sánh phương pháp này với tiêu chuẩn chăm sóc trước khi nó được chấp nhận rộng rãi hơn.
10.3.5 Các vết thương phẫu thuật khác
Phương pháp này cũng có thể áp dụng cho nhiều vết thương phẫu thuật khác nhau, bao gồm cả những vết thương để lộ xương hoặc gân. Không có gì ngạc nhiên khi một số kết quả tốt nhất khi sử dụng chất thay thế da đạt được ở những vết thương phẫu thuật sạch, bao gồm cả những vết thương có lộ xương và gân. Một ví dụ phổ biến là tái cấu trúc một khiếm khuyết sau khi phẫu thuật cắt bỏ ung thư da. Ngay cả những vết thương ở da đầu, với xương sọ bị lộ, cũng được điều trị thành công bằng phẫu thuật hai giai đoạn.
Chất thay thế da cũng được sử dụng để cải thiện quá trình lành thương các khiếm khuyết của vị trí lấy vạt tự do, đặc biệt là khiếm khuyết vạt tự do ở cẳng tay quay. Trong một nghiên cứu hồi cứu, Rowe và cộng sự so sánh kết quả chức năng của quá trình tái cấu trúc với một ghép da đơn trị liệu hoặc ghép hỗn hợp gồm chất thay thế da và mảnh ghép da mỏng và thấy rằng kết quả sử dụng ghép hỗn hợp vượt trội hơn nhiều. Một nghiên cứu hồi cứu ở 29 bệnh nhân bị khiếm khuyết ở vùng lấy vạt tự do cẳng tay quay, những người trải qua phẫu thuật tái cấu trúc hai giai đoạn bằng Integra và ghép da tách độ dày trì hoãn, báo cáo không có biến chứng nào và kết quả tốt. Một nghiên cứu thí điểm trên 10 bệnh nhân bị khiếm khuyết ở vị trí lấy vạt tự do cho thấy quá trình lành thương tốt khi sử dụng phẫu thuật hai giai đoạn và chất thay thế da bằng polyurethane phân hủy được.
10.4 Kỹ thuật phẫu thuật: Tái cấu trúc da hai giai đoạn với chất thay thế da và mảnh ghép da tách độ dày
Tính đơn giản, khả năng thích ứng và độ tin cậy của phương pháp này khiến nó trở nên hấp dẫn và dễ tiếp cận đối với nhiều bác sĩ phẫu thuật. Có nhiều biến thể của phương pháp này được mô tả trong tài liệu, nhưng chúng tôi sử dụng phương pháp cụ thể này tại cơ sở của mình từ đầu những năm 2000 với kết quả đáng tin cậy. Phương pháp này tương tự như phương pháp do Integra Life Sciences cung cấp.
10.4.1 Chuẩn bị vết thương
Thành công của phương pháp này, đặc biệt là trong việc tái cấu trúc vết thương bị dơ, phụ thuộc rất nhiều vào nền vết thương sạch và khỏe mạnh. Vết thương bỏng nên được cắt bỏ đến mô khỏe mạnh, có thể sống được. Mất máu được hạn chế bằng cách sử dụng garô, dung dịch tumescent, vật liệu ngâm epinephrine hoặc cắt bỏ cân, đặc biệt ở những vết bỏng lớn. Giai đoạn đầu của phẫu thuật này được thực hiện ngay sau khi cắt bỏ vết bỏng hoặc các thủ thuật “làm sạch” khác, bao gồm giải phóng sẹo phì đại, cắt bỏ sẹo lồi hoặc ung thư hoặc lấy vạt.
Vết thương bị dơ thường được hưởng lợi từ việc cắt lọc nhiều lần (mỗi 24–72 giờ) trước giai đoạn đầu của phẫu thuật này. NPWT giữa các lần cắt lọc có thể giúp giảm sự xâm chiếm của vi khuẩn và thúc đẩy sự phát triển của mô hạt. Trong một nghiên cứu tại Bệnh viện Walter Reed, họ phát hiện ra rằng ở những vết thương chiến đấu được điều trị bằng Integra và ghép da tách độ dày trì hoãn hoặc vạt da, trung bình có ba lần cắt lọc để chuẩn bị vết thương cho giai đoạn đầu của phẫu thuật. Nhiễm trùng sớm có thể dẫn đến việc tiếp nhận chất thay thế da kém và kéo dài thời gian lành thương, làm tăng nguy cơ sẹo không mong muốn.
10.4.2 Lựa chọn chất thay thế da
Hiện nay, có rất nhiều chất thay thế da được bán trên thị trường (Bảng 10.1). Nhiều bài đánh giá gần đây mô tả nhiều loại chất thay thế da. Rất ít hướng dẫn để lựa chọn chất thay thế da tốt nhất, có lẽ là do chưa có nghiên cứu so sánh ngẫu nhiên có đối chứng nào lớn. Quy trình sản xuất bất kỳ chất thay thế da cụ thể nào thường là độc quyền và các bác sĩ lâm sàng phải dựa vào thông tin do nhà sản xuất cung cấp. Mặt khác, một số chất thay thế da, bao gồm Integra và AlloDerm, được nghiên cứu rộng rãi trong các tài liệu, từ cả quan điểm khoa học cơ bản và ứng dụng lâm sàng. Integra được sử dụng kết hợp với NPWT trong nhiều nghiên cứu, trong khi các chất thay thế da khác thì không. Ngoài ra, tính khả dụng của các chất thay thế da khác nhau bị hạn chế ở nhiều tổ chức (và quốc gia) và chi phí của sản phẩm có thể khác nhau giữa các cơ sở. Một cân nhắc khác là kích thước của vết thương, vì hầu hết các chất thay thế da được bán với số lượng hạn chế về kích thước. Thời hạn sử dụng và điều kiện bảo quản cũng có thể là những yếu tố hạn chế. Những yếu tố này có thể khiến việc lựa chọn chất thay thế da trở nên rất đơn giản.
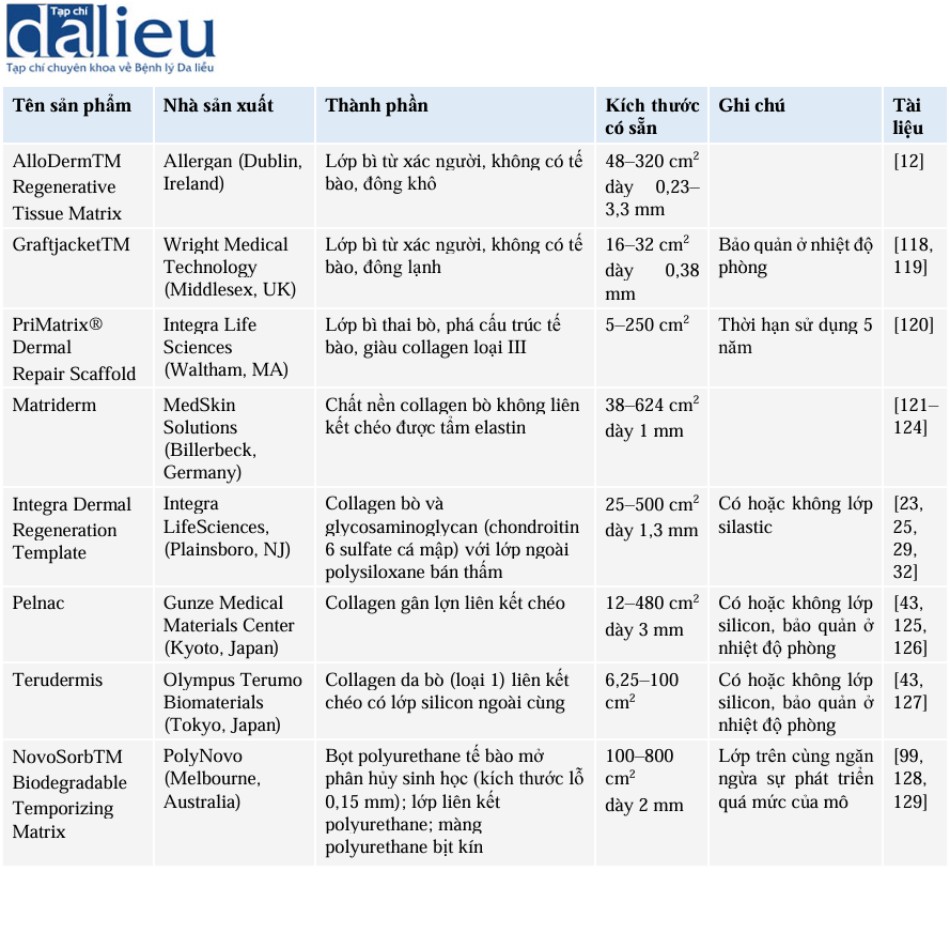
Các chất thay thế da thường được phân loại dựa trên thành phần của chúng. Nhiều chất thay thế da có nguồn gốc từ lớp bì của tử thi người, được khử tế bào và bảo quản bằng nhiều kỹ thuật khác nhau. Hầu hết các nghiên cứu được thực hiện với AlloDerm, nhưng về mặt lý thuyết, các sản phẩm lớp bì của tử thi người được khử tế bào khác cũng có chức năng tương tự. Các chất thay thế da khác, như Matriderm, Integra và Terudermis, được tạo ra từ collagen có nguồn gốc từ động vật và các protein khác, và được liên kết chéo để tạo thành các tấm vật liệu dạng gel. Một số chất thay thế da có nguồn gốc từ các động vật khác, như collagen gân lợn (Pelnac) hoặc collagen từ bào thai bò (PriMatrix). Cuối cùng, có một số chất thay thế da hoàn toàn tổng hợp: NovoSorb được làm từ bọt polyurethane phân hủy sinh học.
Ngoài ra còn có các chất thay thế da gồm nhiều lớp, mặc dù phần lớn các chất thay thế da chỉ có một lớp. Integra và Pelnac có một lớp silicon mỏng đóng vai trò là hàng rào bảo vệ lớp biểu bì, cho đến khi lớp này được loại bỏ ở giai đoạn thứ hai của phẫu thuật (Integra cũng có dạng một lớp đơn). NovoSorb gồm ba lớp: bọt polyurethane phân hủy sinh học, lớp liên kết và màng polyurethane bịt kín. Khi thực hiện phẫu thuật hai giai đoạn, sẽ dễ dàng hơn khi sử dụng chất thay thế da với lớp trên cùng có thể tháo rời, không dính.
10.4.3 Giai đoạn đầu: Sử dụng chất thay thế da và băng NPWT
Một số đánh giá về vị trí đặt Integra được công bố. Tóm lại, chất thay thế da có thể được tạo lưới hoặc đục lỗ trước khi sử dụng để giúp nó phù hợp với các chỗ không đều trên viền vết thương. Nó được cắt theo kích thước chính xác của vết thương và cố định bằng ghim bấm, chỉ khâu, keo fibrin hoặc kết hợp các phương pháp này. Ở những bệnh nhân dễ bị sẹo lồi, nó có thể được khâu vào lớp bì xung quanh để ngăn ngừa hình thành sẹo lồi mới.
Liệu pháp vết thương áp suất âm trở nên phức tạp hơn nhiều trong những năm gần đây. Khi mới ra đời, liệu pháp này gồm bọt polyurethane xốp, màng dính bán thấm, ống nối bọt với chân không và bơm chân không. Hiện nay có nhiều loại bọt, màng và thiết bị chân không. Mục đích của lớp bọt là phân bổ đều áp suất âm trên vết thương. Có nhiều loại thiết bị dạng cố định, di động hoặc dùng một lần và các thiết bị có khả năng tạo áp suất âm liên tục hoặc ngắt quãng. Khi được sử dụng kết hợp với chất thay thế da, mục đích của NPWT là loại bỏ khoảng chết hoặc dịch tiết giữa nền vết thương và chất thay thế da, giảm tải lượng vi khuẩn và có khả năng đẩy nhanh quá trình tạo mạch và sự phát triển vào trong chất thay thế da. Do đó, áp suất âm liên tục được khuyến cáo để duy trì sự tiếp xúc giữa chất thay thế da và nền vết thương.
Vị trí đặt băng suất lực âm được mô tả trong tài liệu và thông tin do nhà sản xuất cung cấp. Tóm lại, miếng bọt được cắt theo kích thước của vết thương và đặt lên lớp chất thay thế da. Nếu sử dụng Integra, không cần phải đặt một lớp không dính giữa lớp chất thay thế da và bọt. Sử dụng lớp chất thay thế da một lớp với NPWT không phổ biến, nhưng không phải là không thể, nếu có một lớp không dính giữa lớp chất thay thế da và bọt. Bọt được cố định với một màng dính. Trên các vùng rộng hoặc khó, như bàn tay hoặc bẹn, có thể cần sử dụng nhiều miếng bọt và màng dính lớn hơn, chẳng hạn như Ioban (3M, St. Paul, MN). Chất dính bổ sung, chẳng hạn như Mastisol (Eloquest Healthcare, Ferndale, MI), cũng có thể giúp cố định băng ở các vùng quanh vết thương ẩm. Sau khi băng được dán kín, dùng kéo để cắt một lỗ 1–2 cm trên màng dính trên bọt; ống chân không được đặt trên lỗ này. Bật thiết bị NPWT để kiểm tra độ kín và dán các vết rò bằng một miếng màng dính khác. Băng NPWT có thể được giữ nguyên trong 7–10 ngày trên Integra.
Thường không thực tế khi đặt băng NPWT trên các vùng rất nhỏ, không đều, chẳng hạn như tai. Trong những trường hợp này, có thể tạo một miếng đệm để tạo áp suất đều, không đổi lên vết thương. Các vùng nhỏ khác có thể được cố định bằng thiết bị NPWT dùng một lần có tên là Pico (Smith and Nephew, London, Vương quốc Anh). NPWT nên tiếp tục cho đến khi phẫu thuật giai đoạn thứ hai.
10.4.4 Giai đoạn thứ hai: Ghép da trì hoãn
Có nhiều khoảng thời gian khuyến nghị giữa các giai đoạn phẫu thuật một và hai. Hầu hết các bác sĩ lâm sàng kiểm tra vết thương định kỳ để đánh giá sự “nhận” Integra, sẽ chuyển sang màu cá hồi và trở nên đục hơn trong vòng 2–4 tuần. NPWT đẩy nhanh quá trình này để diễn ra trong vòng 7–10 ngày.
Trong phẫu thuật giai đoạn hai, lớp silastic được loại bỏ và mảnh ghép da tách độ dày được đặt lên trên lớp da mới. Độ dày khuyến nghị của mảnh ghép da là từ 0,003 đến 0,016 inch. Mảnh ghép da mỏng được khuyến cáo khi tái thu hoạch ở các vị trí lấy da. Chúng tôi sử dụng độ dày mảnh ghép da ở giữa phạm vi khoảng 0,010–0,012 inch, để dễ xử lý trong và sau phẫu thuật, và thấy kết quả đáng tin cậy. Mảnh ghép da được tạo lưới 1:1 hoặc đục lỗ tối thiểu. Sau đó, băng NPWT được đặt lên mảnh ghép da, như mô tả trước đây. Việc sử dụng các kỹ thuật ghép da khác, bao gồm kỹ thuật ghép vi mô Meek được sửa đổi hoặc các tấm biểu mô được nuôi cấy, cũng được mô tả. Sau 5 ngày, chúng tôi đánh giá sự “nhận” mảnh ghép da và dừng NPWT. Băng gạc petrolatum bịt kín được đặt lên mảnh ghép da cho đến khi nó lành hoàn toàn.
10.4.5 Các biến chứng thường gặp nhất với các giải pháp được khuyến nghị
10.4.5.1 Tụ dịch
Đôi khi, dịch tích tụ bên dưới lớp silastic của Integra. Việc đục lỗ hoặc tạo lưới Integra và áp sát trước khi dán có thể ngăn ngừa vấn đề này. Khi tụ dịch được xác định, cần phải loại bỏ nó. Có thể loại bỏ một phần lớp silastic để tiếp tục dẫn lưu trước khi NPWT được khởi động lại. Chất thay thế da có thể được tận dụng.
10.4.5.2 Tụ máu
Giống như tụ dịch, tụ máu có thể được ngăn ngừa bằng cách cầm máu kỹ trước khi dùng chất thay thế da. Một khối máu tụ cũng nên được giải toả. Có thể cần phải loại bỏ một phần chất thay thế da để đạt được sự cầm máu. Đây là một biến chứng hiếm gặp.
10.4.5.3 Nhiễm trùng
Cách tốt nhất để ngăn ngừa nhiễm trùng là đảm bảo vết thương sạch và sống được (hoặc vết bỏng được cắt bỏ hoàn toàn). Việc cắt bỏ liên tục và theo dõi chặt chẽ các vết thương chấn thương hầu như luôn luôn cần thiết để đảm bảo rằng nền vết thương chỉ chứa các mô còn sống. NPWT cũng có thể làm giảm nguy cơ nhiễm trùng ở vết thương, mặc dù nó chưa được chứng minh cụ thể là làm giảm nhiễm trùng ở Integra. Lớp silastic trên Integra bị nhiễm trùng có thể được loại bỏ và băng dung dịch mafenide acetate (Sulfamylon) có thể giúp điều trị nhiễm trùng. Đáng lưu ý, không có gì lạ khi có dịch tiết không có mủ từ vết thương được che phủ bởi Integra. Các bác sĩ lâm sàng thiếu kinh nghiệm sử dụng sản phẩm thường chẩn đoán quá mức nhiễm trùng với Integra. Các vùng không dính của chất nền thường bị nhầm lẫn với nhiễm trùng.
10.5 Hướng đi trong tương lai
Một phẫu thuật một giai đoạn hiệu quả, chi phí phù hợp, với tỷ lệ khiếm khuyết tại vị trí lấy da thấp hơn, tiếp tục là mục tiêu hấp dẫn trong lĩnh vực tái cấu trúc da. Có một số báo cáo về sự lành hoàn toàn sau khi đặt một mảnh ghép da tách độ dày lên một chất thay thế da trong một ca phẫu thuật một giai đoạn. Sự phát triển vào trong của các mạch máu từ nền vết thương, qua Matriderm và vào trong mảnh ghép da, trong suốt 15 ngày, được quan sát thấy. Chúng tôi sử dụng sự kết hợp của Integra (không có lớp silastic) và một mảnh ghép da tách độ dày trong quá trình thực hành, trên các nền vết thương đặc biệt sạch và khỏe mạnh. Quá trình lành hoàn toàn xảy ra trong khoảng 10–14 ngày (dữ liệu chưa công bố). Ghép biểu mô tự thân được nuôi cấy kết hợp với chất thay thế da được mô tả. Phương pháp này có tỷ lệ khiếm khuyết tại vị trí lấy da là tối thiểu, nhưng thường mất 2–3 tuần để nuôi cấy đủ tế bào sừng tự thân để che phủ vết thương. Phương pháp này cũng tốn nhiều thời gian và đòi hỏi kỹ năng kỹ thuật và thiết bị, điều mà nhiều bác sĩ lâm sàng không thể thực hiện được. Một cách tiếp cận khác là lấy một mảnh ghép da 2 cm × 2 cm, tách các tế bào da bằng cơ học và enzym, và tái huyền phù chúng trong dung dịch có thể phun lên vết thương (ReCell, Avita Medical, South Perth, Úc). “Da dạng phun” này, chứa nguyên bào sợi tự thân, tế bào sừng và tế bào hắc tố, kết hợp với Integra, được sử dụng để chữa lành vết thương toàn độ dày da ở mô hình lợn. Cần có thêm các nghiên cứu để so sánh kết quả lâu dài của các phẫu thuật một giai đoạn này với phẫu thuật hai giai đoạn được mô tả trong chương này.
Tài liệu tham khảo
- Whittaker AH. Treatment of burns by excision and immediate skin grafting. Am J Surg. 1953;85:411– 7.
- Burke JF, Bondoc CC, Quinby WC. Primary burn excision and immediate grafting: a method shortening illness. J Trauma. 1974;14:389–95.
- Young F. Immediate skin grafting in the treatment of burns: a preliminary report. Ann Surg. 1942;116:445–51.
- Gray DT, Pine RW, Harnar TJ, Marvin JA, Engrav LH, Heimbach DM. Early surgical excision versus conventional therapy in patients with 20 to 40 percent burns. A comparative study. Am J Surg. 1982;144:76–80.
- Ong YS, Samuel M, Song C. Meta-analysis of early excision of burns. Burns. 2006;32:145–50.
- Tompkins RG, Remensnyder JP, Burke JF, Tompkins DM, Hilton JF, Schoenfeld DA, Behringer GE, Bondoc CC, Briggs SE, Quinby WC. Significant reductions in mortality for children with burn injuries through the use of prompt eschar excision. Ann Surg. 1988;208:577– 85.
- Tompkins RG, Hilton JF, Burke JF, Schoenfeld DA, Hegarty MT, Bondoc CC, Quinby WC, Behringer GE, Ackroyd FW. Increased survival after massive thermal injuries in adults: preliminary report using artificial skin. Crit Care Med. 1989;17:734–40.
- Singh M, Nuutila K, Collins KC, Huang A. Evolution of skin grafting for treatment of burns: reverdin pinch grafting to Tanner mesh grafting and beyond. Burns. 2017;43:1149–54.
- Teich Alasia S, Castagnoli C, Calcagni M, Stella M. The influence of progress in the treatment of severe burns on the quality of life. Acta Chir Plast. 1996;38:119–21.
- Rheinwald JG, Green H. Serial cultivation of strains of human epi- dermal keratinocytes: the formation of keratinizing colonies from single cells. Cell. 1975;6:331–43.
- Cuono C, Langdon R, McGuire J. Use of cultured epidermal auto-grafts and dermal allografts as skin replacement after burn injury. Lancet. 1986;1:1123–4.
- Wainwright DJ. Use of an acellular allograft dermal matrix (AlloDerm) in the management of full-thickness burns. Burns. 1995;21:243–8.
- Cuono CB, Langdon R, Birchall N, Barttelbort S, McGuire J. Composite autologous-allogeneic skin replacement: development and clinical application. Plast Reconstr Surg. 1987;80:626–37.
- Hickerson WL, Compton C, Fletchall S, Smith LR. Cultured epidermal autografts and allodermis combination for permanent burn wound coverage. Burns. 1994;20(Suppl 1):S52–5. discussion S55– 6.
- Herzog SR, Meyer A, Woodley D, Peterson HD. Wound coverage with cultured autologous keratinocytes: use after burn wound excision, including biopsy followup. J Trauma. 1988;28:195–8.
- Rue LW, Cioffi WG, McManus WF, Pruitt BA. Wound closure and outcome in extensively burned patients treated with cultured autologous keratinocytes. J Trauma. 1993;34:662–7. discussion 667–8.
- Woodley DT, Peterson HD, Herzog SR, Stricklin GP, Burgeson RE, Briggaman RA, Cronce DJ, O’Keefe EJ. Burn wounds resurfaced by cultured epidermal autografts show abnormal reconstitution of anchoring fibrils. JAMA. 1988;259:2566–71.
- Boyce ST, Hansbrough JF. Biologic attachment, growth, and differentiation of cultured human epidermal keratinocytes on a graftable collagen and chondroitin-6-sulfate substrate. Surgery. 1988;103:421–31.
- Yannas IV, Burke JF. Design of an artificial skin. I. Basic design principles. J Biomed Mater Res. 1980;14:65–81.
- Yannas IV, Burke JF, Gordon PL, Huang C, Rubenstein RH. Design of an artificial skin. II. Control of chemical composition. J Biomed Mater Res. 1980;14:107–32.
- Dagalakis N, Flink J, Stasikelis P, Burke JF, Yannas IV. Design of an artificial skin. Part III. Control of pore structure. J Biomed Mater Res. 1980;14:511–28.
- Burke JF, Yannas IV, Quinby WC, Bondoc CC, Jung WK. Successful use of a physiologically acceptable artificial skin in the treatment of extensive burn injury. Ann Surg. 1981;194:413– 28.
- Heimbach D, Luterman A, Burke J, Cram A, Herndon D, Hunt J, Jordan M, McManus W, Solem L, Warden G. Artificial dermis for major burns. A multi-center randomized clinical trial. Ann Surg. 1988;208:313–20.
- Dantzer E, Braye FM. Reconstructive surgery using an arti- ficial dermis (Integra): results with 39 grafts. Br J Plast Surg. 2001;54:659–64.
- Frame JD, Still J, Lakhel-LeCoadou A, Carstens MH, Lorenz C, Orlet H, Spence R, Berger AC, Dantzer E, Burd A. Use of dermal regeneration template in contracture release procedures: a multi- center evaluation. Plast Reconstr Surg. 2004;113:1330–8.
- Grant I, Green C, Martin R. Strategies to improve the take of commercially available collagen/glycosaminoglycan wound repair material investigated in an animal model. Burns. 2001;27:699–707.
- Morykwas MJ, Argenta LC, Shelton-Brown EI, McGuirt W. Vacuum-assisted closure: a new method for wound control and treatment: animal studies and basic foundation. Ann Plast Surg. 1997;38:553–62.
- Schneider AM, Morykwas MJ, Argenta LC. A new and reliable method of securing skin grafts to the difficult recipient bed. Plast Reconstr Surg. 1998;102:1195–8.
- Molnar JA, Defranzo AJ, Hadaegh A, Morykwas MJ, Shen P, Argenta LC. Acceleration of integra incorporation in complex tissue defects with subatmospheric pressure. Plast Reconstr Surg. 2004;113:1339–46.
- Scherer LA, Shiver S, Chang M, Meredith JW, Owings JT. The vacuum assisted closure device: a method of securing skin grafts and improving graft survival. Arch Surg. 2002;137:930–3. discus- sion 933–4.
- Moiemen NS, Yarrow J, Kamel D, Kearns D, Mendonca D. Topical negative pressure therapy: does it accelerate neovascularisation within the dermal regeneration template, Integra? A prospective histological in vivo study. Burns. 2010;36:764–8.
- Jeschke MG, Rose C, Angele P, Füchtmeier B, Nerlich MN, Bolder U. Development of new reconstructive techniques: use of Integra in combination with fibrin glue and negativepressure therapy for reconstruction of acute and chronic wounds. Plast Reconstr Surg. 2004;113:525–30.
- Ryan CM, Schoenfeld DA, Malloy M, Schulz JT, Sheridan RL, Tompkins RG. Use of Integra artificial skin is associated with decreased length of stay for severely injured adult burn survivors. J Burn Care Rehabil. 2002;23:311–7.
- Park CA, Defranzo AJ, Marks MW, Molnar JA. Outpatient recon- struction using integra∗ and subatmospheric pressure. Ann Plast Surg. 2009;62:164–9.
- Bloemen MCT, van der Wal MBA, Verhaegen PDHM, Nieuwenhuis MK, van Baar ME, van Zuijlen PPM, Middelkoop E. Clinical effectiveness of dermal substitution in burns by topical negative pressure: a multicenter randomized controlled trial. Wound Repair Regen. 2012;20:797–805.
- Ehrlich HP, Desmoulière A, Diegelmann RF, Cohen IK, Compton CC, Garner WL, Kapanci Y, Gabbiani G. Morphological and immunochemical differences between keloid and hypertrophic scar. Am J Pathol. 1994;145:105–13.
- Soller EC, Tzeranis DS, Miu K, So PTC, Yannas IV. Common features of optimal collagen scaffolds that disrupt wound contraction and enhance regeneration both in peripheral nerves and in skin. Biomaterials. 2012;33:4783–91.
- Stern R, McPherson M, Longaker MT. Histologic study of artificial skin used in the treatment of fullthickness thermal injury. J Burn Care Rehabil. 1990;11:7–13.
- Moiemen NS, Staiano JJ, Ojeh NO, Thway Y, Frame JD. Reconstructive surgery with a dermal regeneration template: clinical and histologic study. Plast Reconstr Surg. 2001;108: 93–103.
- Hu S, Kirsner RS, Falanga V, Phillips T, Eaglstein WH. Evaluation of Apligraf persistence and basement membrane restoration in donor site wounds: a pilot study. Wound Repair Regen. 2006;14:427–33.
- Lazic T, Falanga V. Bioengineered skin constructs and their use in wound healing. Plast Reconstr Surg. 2011;127(Suppl 1):75S–90S.
- Moiemen N, Yarrow J, Hodgson E, Constantinides J, Chipp E, Oakley H, Shale E, Freeth M. Long-term clinical and histological analysis of integra dermal regeneration template. Plast Reconstr Surg. 2011;127:1149–54.
- Eo S, Kim Y, Cho S. Vacuum-assisted closure improves the incorporation of artificial dermis in soft tissue defects: Terudermis(®) and Pelnac(®). Int Wound J. 2011;8:261–7.
- Labler L, Rancan M, Mica L, Härter L, MihicProbst D, Keel M. Vacuum-assisted closure therapy increases local interleukin-8 and vascular endothelial growth factor levels in traumatic wounds. J Trauma. 2009;66:749–57.
- Anghel EL, Kim PJ. Negative-pressure wound therapy. Plast Reconstr Surg. 2016;138:129S–37S.
- Huang C, Leavitt T, Bayer LR, Orgill DP. Effect of negative pressure wound therapy on wound healing. Curr Probl Surg. 2014;51:301–31.
- Lalezari S, Lee CJ, Borovikova AA, Banyard DA, Paydar KZ, Wirth GA, Widgerow AD. Deconstructing negative pressure wound therapy. Int Wound J. 2016;14:649–57.
- Yannas IV, Orgill DP, Burke JF. Template for skin regeneration. Plast Reconstr Surg. 2011;127:60S–70S.
- Moiemen NS, Vlachou E, Staiano JJ, Thawy Y, Frame JD. Reconstructive surgery with Integra dermal regeneration template: histologic study, clinical evaluation, and current practice. Plast Reconstr Surg. 2006;117:160S–74S.
- Engrav LH, Heimbach DM, Reus JL, Harnar TJ, Marvin JA. Early excision and grafting vs. nonoperative treatment of burns of indeterminant depth: a randomized prospective study. J Trauma. 1983;23:1001–4.
- Deitch EA, Wheelahan TM, Rose MP, Clothier J, Cotter J. Hypertrophic burn scars: analysis of variables. J Trauma. 1983;23:895–8.
- Bloemen MCT, van der Veer WM, Ulrich MMW, van Zuijlen PPM, Niessen FB, Middelkoop E. Prevention and curative management of hypertrophic scar formation. Burns. 2009;35:463– 75.
- Burke JF. Early excision of the burn wound. J Burn Care Rehabil. 1981;2:266.
- Lorenz C, Petracic A, Hohl HP, Wessel L, Waag KL. Early wound closure and early reconstruction. Experience with a dermal substitute in a child with 60 per cent surface area burn. Burns. 1997;23:505– 8.
- Yim H, ChoYS, Seo CH, Lee BC, Ko JH, Kim D, Hur J, Chun W, Kim JH. The use of AlloDerm on major burn patients: AlloDerm prevents post-burn joint contracture. Burns. 2010;36:322–8.
- Fang T, Lineaweaver WC, Sailes FC, Kisner C, Zhang F. Clinical application of cultured epithelial autografts on acellular dermal matrices in the treatment of extended burn injuries. Ann Plast Surg. 2014;73:509–15.
- Cuadra A, Correa G, Roa R, Piñeros JL, Norambuena H, Searle S, Heras RL, Calderón W. Functional results of burned hands treated with Integra®. J Plast Reconstr Aesthet Surg. 2012;65:228–34.
- Dantzer E, Queruel P, Salinier L, Palmier B, Quinot JF. Dermal regeneration template for deep hand burns: clinical utility for both early grafting and reconstructive surgery. Br J Plast Surg. 2003;56:764–74.
- Friedstat JS, Klein MB. Acute management of facial burns. Clin Plast Surg. 2009;36:653–60.
- Tang B, Zhu B, Liang Y-Y, Bi L-K, Chen B, Hu Z-C, Zhang K, Zhu J-Y. Early escharectomy and concurrent composite skin grafting over human acellular dermal matrix scaffold for covering deep facial burns. Plast Reconstr Surg. 2011;127:1533– 8.
- Atherton DD, Tang R, Jones I, Jawad M. Early excision and application of matriderm with simultaneous autologous skin grafting in facial burns. Plast Reconstr Surg. 2010;125:60e–1e.
- Demircan M, Cicek T, Yetis MI. Preliminary results in single-step wound closure procedure of full-thickness facial burns in children by using the collagen-elastin matrix and review of pediatric facial burns. Burns. 2015;41:1268–74.
- Molnar JA, DeFranzo AJ, Marks MW. Singlestage approach to skin grafting the exposed skull. Plast Reconstr Surg. 2000;105:174–7.
- van der Wal MBA, Vloemans JFPM, Tuinebreijer WE, van de Ven P, van Unen E, van Zuijlen PPM, Middelkoop E. Outcome after burns: an observational study on burn scar maturation and predictors for severe scarring. Wound Repair Regen. 2012;20:676–87.
- Kwan P, Desmoulière A, Tredget EE. Molecular and cellular basis of hypertrophic scarring. Total Burn Care. 2012:495–505.e5.
- Ladak A, Tredget EE. Pathophysiology and management of the burn scar. Clin Plast Surg. 2009;36:661–74.
- Wainwright DJ. Burn reconstruction: the problems, the techniques, and the applications. Clin Plast Surg. 2009;36:687–700.
- van Zuijlen PP, van Trier AJ, Vloemans JF, Groenevelt F, Kreis RW, Middelkoop E. Graft survival and effectiveness of dermal substitution in burns and reconstructive surgery in a one-stage grafting model. Plast Reconstr Surg. 2000;106:615–23.
- Dantzer E. Burn contractures: surgical management with integra— long term results. J Burn Care Rehabil. 2003;24:S100.
- Clayman MA, Clayman SM, Mozingo DW. The use of collagen-glycosaminoglycan copolymer (Integra) for the repair of hypertrophic scars and keloids. J Burn Care Res. 2006;27:404–9.
- Yeong E-K, Yu Y-C, Chan Z-H, Roan T-L. Is artificial dermis an effective tool in the treatment of tendon-exposed wounds? J Burn Care Res. 2013;34:161–7.
- Askari M, Cohen MJ, Grossman PH, Kulber DA. The use of acellular dermal matrix in release of burn contracture scars in the hand. Plast Reconstr Surg. 2011;127:1593–9.
- Kamolz L-P, Frey M, Meissl G, Nathschlaeger G, Haslik W. Use of collagen-elastin matrix (matriderm) for dermal reparation: 12 months experiences in the treatment of severe hand burn injuries. Burns. 2007;33:S19.
- Gronovich Y, Maisel Lotan A, Retchkiman M. Post-burn breast reconstruction using an artificial dermis-a long-term follow-up. Burns Trauma. 2016;4:12.
- Palao R, Gómez P, Huguet P. Burned breast reconstructive surgery with Integra dermal regeneration template. Br J Plast Surg. 2003;56:252–9.
- Fujimori Y, Ueda K, Fumimoto H, Kubo K, Kuroyanagi Y. Skin regeneration for children with burn scar contracture using autologous cultured dermal substitutes and superthin auto-skin grafts: preliminary clinical study. Ann Plast Surg. 2006;57:408–14.
- Stiefel D, Schiestl C, Meuli M. Integra Artificial Skin® for burn scar revision in adolescents and children. Burns. 2010;36:114–20.
- Argenta LC, Morykwas MJ, Marks MW, Defranzo AJ, Molnar JA, David LR. Vacuumassisted closure: state of clinic art. Plast Reconstr Surg. 2006;117:127S–42S.
- Orgill DP, Bayer LR. Update on negativepressure wound therapy. Plast Reconstr Surg. 2011;127(Suppl 1):105S–15S.
- DeFranzo AJ, Argenta LC, Marks MW, Molnar JA, David LR, Webb LX, Ward WG, Teasdall RG. The use of vacuum-assisted closure therapy for the treatment of lower-extremity wounds with exposed bone. Plast Reconstr Surg. 2001;108:1184–91.
- DeFranzo AJ, Marks MW, Argenta LC, Genecov DG. Vacuum- assisted closure for the treatment of degloving injuries. Plast Reconstr Surg. 1999;104:2145–8.
- Barnett TM, Shilt JS. Use of vacuum-assisted closure and a dermal regeneration template as an alternative to flap reconstruction in pediatric grade IIIB open lower-extremity injuries. Am J Orthop. 2009;38:301–5.
- Mooney JF, Argenta LC, Marks MW, Morykwas MJ, DeFranzo AJ. Treatment of soft tissue defects in pediatric patients using the V.A.C. system. Clin Orthop Relat Res. 2000:26–31.
- Schlatterer D, Hirshorn K. Negative pressure wound therapy with reticulated open cell foamadjunctive treatment in the management of traumatic wounds of the leg: a review of the literature. J Orthop Trauma. 2008;22:S152–60.
- Janis JE, Steinberg JS. Discussion. Template for skin regeneration. Plast Reconstr Surg. 2011;127(Suppl 1):71S–4S.
- Iorio ML, Shuck J, Attinger CE. Wound healing in the upper and lower extremities. Plast Reconstr Surg. 2012;130:232S–41S.
- Rehim SA, Singhal M, Chung KC. Dermal skin substitutes for upper limb reconstruction: current status, indications, and contra-indications. Hand Clin. 2014;30:239–52–vii.
- Helgeson MD, Potter BK, Evans KN, Shawen SB. Bioartificial dermal substitute: a preliminary report on its use for the management of complex combat-related soft tissue wounds. J Orthop Trauma. 2007;21:394–9.
- Seavey JG, Masters ZA, Balazs GC, Tintle SM, Sabino J, Fleming ME, Valerio IL. Use of a bioartificial dermal regeneration template for skin restoration in combat casualty injuries. Regen Med. 2016;11:81–90.
- Butler PD, Longaker MT, Yang GP. Current progress in keloid research and treatment. J Am Coll Surg. 2008;206:731–41.
- Ogawa R. The most current algorithms for the treatment and prevention of hypertrophic scars and keloids. Plast Reconstr Surg. 2010;125:557–68.
- Monstrey S, Middelkoop E, Vranckx JJ, Bassetto F, Ziegler UE, Meaume S, Téot L. Updated scar management practical guidelines: non-invasive and invasive measures. Br J Plast Surg. 2014;67:1017–25.
- Davison SP, Sobanko JF, Clemens MW. Use of a collagen- glycosaminoglycan copolymer (Integra) in combination with adjuvant treatments for reconstruction of severe chest keloids. J Drugs Dermatol. 2010;9:542–8.
- Bidic SM, Dauwe PB, Heller J, Brown S, Rohrich RJ. Reconstructing large keloids with neodermis: a systematic review. Plast Reconstr Surg. 2012;129:380e–2e.
- Nguyen KT, Shikowitz L, Kasabian AK, Bastidas N. A novel approach to keloid reconstruction with bilaminar dermal substitute and epidermal skin grafting. Plast Reconstr Surg. 2016;138:235–9.
- Patel NP, Lawrence Cervino A. Keloid treatment: is there a role for acellular human dermis (Alloderm)? J Plast Reconstr Aesthet Surg. 2010;63:1344–8.
- Cunningham T, Marks M. Vacuum-assisted closure device and skin substitutes for complex Mohs defects. Dermatol Surg. 2014;40(Suppl 9):S120–6.
- Schiavon M, Francescon M, Drigo D, Salloum G, Baraziol R, Tesei J, Fraccalanza E, Barbone F. The use of integra dermal regeneration template versus flaps for reconstruction of full- thickness scalp defects involving the calvaria: a cost–benefit analysis. Aesthetic Plast Surg. 2016;40:901–7.
- Greenwood JE. The evolution of acute burn care—retiring the split skin graft. Ann R Coll Surg Engl. 2017;99:432–8.
- Rowe NM, Morris L, Delacure MD. Acellular dermal composite allografts for reconstruction of the radial forearm donor site. Ann Plast Surg. 2006;57:305–11.
- Murray RC, Gordin EA, Saigal K, Leventhal D, Krein H, Heffelfinger RN. Reconstruction of the radial forearm free flap donor site using integra artificial dermis. Microsurgery. 2011;31:104–8.
- Wagstaff MJD, Schmitt BJ, Coghlan P, Finkemeyer JP, Caplash Y, Greenwood JE. A biodegradable polyurethane dermal matrix in reconstruction of free flap donor sites: a pilot study. Eplasty. 2015;15:e13.
- Integra’s Physician Training Website. (Integra Life Sciences, 2017), http://www.ilstraining.com/. Accessed 14 October 2017.
- Mosier MJ, Gibran NS. Surgical excision of the burn wound. Clin Plast Surg. 2009;36:617–25.
- Bezuhly M, Fish JS. Acute burn care. Plast Reconstr Surg. 2012;130:349e–58e.
- Janis J, Harrison B. Wound healing: part II. Clinical applications. Plast Reconstr Surg. 2014;133:383e–92e.
- Dickinson LE, Gerecht S. Engineered biopolymeric scaffolds for chronic wound healing. Front Physiol. 2016;7:623–12.
- van der Veen VC, van der Wal MBA, van Leeuwen MCE, Ulrich MMW, Middelkoop E. Biological background of dermal substitutes. Burns. 2010;36:305–21.
- Chua AWC, Khoo YC, Tan BK, Tan K-C, Foo CL, Chong SJ. Skin tissue engineering advances in severe burns: review and therapeutic applications. Burns Trauma. 2016;4:3.
- van Zuijlen P, Gardien K, Jaspers M, Bos EJ, Baas DC, van Trier A, Middelkoop E. Tissue engineering in burn scar reconstruction. Burns Trauma. 2015;3:18.
- Watt AJ, Friedrich JB, Huang JI. Advances in treating skin defects of the hand: skin substitutes and negative-pressure wound therapy. Hand Clin. 2012;28:519–28.
- McEwan W, Brown TLH, Mills SM, Muller MJ. Suction dressings to secure a dermal substitute. Burns. 2004;30:259–61.
- Janis JE, Kwon RK, Lalonde DH. A practical guide to wound healing. Plast Reconstr Surg. 2010;125:230e–44e.
- Malmsjö M, Ingemansson R, Martin R, Huddleston E. Negative- pressure wound therapy using gauze or open-cell polyurethane foam: similar early effects on pressure transduction and tissue contraction in an experimental porcine wound model. Wound Repair Regen. 2009;17:200–5.
- Malmsjö M, Huddleston E, Martin R. Biological effects of a disposable, canisterless negative pressure wound therapy system. Eplasty. 2014;14:e15.
- Wiedner M, Tinhofer IE, Kamolz L-P, Seyedian Moghaddam A, Justich I, Liegl-Atzwanger B, Bubalo V, Weninger WJ, Lumenta DB. Simultaneous dermal matrix and autologous splitthickness skin graft transplantation in a porcine wound model: a three-dimensional histological analysis of revascularization. Wound Repair Regen. 2015;22:749–54.
- Wood FM, Stoner ML, Fowler BV, Fear MW. The use of a non-cultured autologous cell suspension and Integra dermal regeneration template to repair full-thickness skin wounds in a porcine model: a one-step process. Burns. 2007;33:693–700.
- Reyzelman A, Crews RT, Moore JC, et al. Clinical effective- ness of an acellular dermal regenerative tissue matrix compared to standard wound management in healing diabetic foot ulcers: a prospective, randomised, multicentre study. Int Wound J. 2009;6:196–208.
- Brigido SA, Boc SF, Lopez RC. Effective management of major lower extremity wounds using an acellular regenerative tissue matrix: a pilot study. Orthopedics. 2004;27:s145–9.
- Neill J, James K, Lineaweaver W. Utilizing biologic assimilation of bovine fetal collagen in staged skin grafting. Ann Plast Surg. 2012;68:451–6.
- Haslik W, Kamolz L-P, Nathschläger G, Andel H, Meissl G, Frey M. First experiences with the collagen-elastin matrix Matriderm® as a dermal substitute in severe burn injuries of the hand. Burns. 2007;33:364–8.
- Ryssel H, Gazyakan E, Germann G, Öhlbauer M. The use of MatriDerm® in early excision and simultaneous autologous skin grafting in burns—a pilot study. Burns. 2008;34:93–7.
- Haslik W, Kamolz L-P, Manna F, Hladik M, Rath T, Frey M. Management of full-thickness skin defects in the hand and wrist region: first long-term experiences with the dermal matrix Matriderm. J Plast Reconstr Aesthet Surg. 2010;63:360–4.
- Min JH, Yun IS, Lew DH, Roh TS, Lee WJ. The use of matriderm and autologous skin graft in the treatment of full thickness skin defects. Arch Plast Surg. 2014;41:330–6.
- Suzuki S, Kawai K, Ashoori F, Morimoto N, Nishimura Y, Ikada Y. Long-term follow-up study of artificial dermis composed of outer silicone layer and inner collagen sponge. Br J Plast Surg. 2000;53:659–66.
- Widjaja W, Maitz P. The use of dermal regeneration template (Pelnac®) in acute fullthickness wound closure: a case series. Eur J Plast Surg. 2015;39:125–32.
- Lee J-W, Jang Y-C, Oh SJ. Use of the artificial dermis for free radial forearm flap donor site. Ann Plast Surg. 2005;55:500–2.
- Greenwood JE, Dearman BL. Comparison of a sealed, polymer foam biodegradable temporizing matrix against Integra® dermal regeneration template in a porcine wound model. J Burn Care Res. 2012;33:163–73.
- Wagstaff MJD, Driver S, Coghlan P, Greenwood JE. A randomized, controlled trial of negative pressure wound therapy of pressure ulcers via a novel polyurethane foam. Wound Repair Regen. 2014;22:205–11.