Bài viết Cơ chế hoạt động của Retinoids bôi tại chỗ trong da liễu tại chỗ của tác giả Siimeyre Seda Ertekin và Mehmet Salih Gurel được dịch bởi Bs. Trương Tấn Minh Vũ từ bài viết gốc: Retinoids in Determalogy
1. Giới thiệu
Thuật ngữ “retinoids”bao gồm các hợp chất có nguồn gốc từ vitamin A cũng như các hợp chất có sự tưong đồng về cấu trúc và /hoặc chức năng với vitamin A và có thể tương tác với các thụ thể retinoid. Retinoids có rất nhiều tác dụng đối với sự biệt hoá và tăng sinh tế bào, hình thành phôi và hệ thống miễn dịch. Retinoid bôi đầu tiên, all-trans- retinoic acid (ATRA), đã được Cục Quản lý Thực phẩm và Dược phẩm (FDA) phê duyệt vào năm 1971 để điều trị mụn trứng cá. Với việc phát hiện và xác định đặc điểm của các thụ thể retinoid, kiến thức về cơ chế hoạt động của retinoid đã được nâng cao đáng kể. Kể từ đó, retinoid đã tiếp tục được phát triển và ngày càng có nhiều retinoid tổng hợp được tạo ra. Hiện nay, retinoids tại chỗ được sử dụng cho nhiều loại bệnh da liễu, từ mụn trứng cá, lão hoá ánh sáng, vẩy nến và sarcoma Kaposi đến lyphoma tế bào T ở da (1-3).
2. Phân loại Retinoids
Ba thế hệ retinoid tổng họp đã được phát triển đễ điều trị tại chỗ và toàn thân một số bệnh ngoài da (Bảng 3.1).
- Retinoids thế hệ đầu tiên là retinoids không có vòng thơm tự nhiên. Chúng bao gồm vitamin A (all-trans retinol), tretinoin (ATRA), isotretinoin (13-cis retinoic acid) và alitretinoin (9-cis retinoic acid). Nhóm này vẫn giữ câu trúc chu kỳ của vitamin A với polyene được biên đổi hóa học ở chuỗi bên và đâu cuôi.
- Retinoids 1 vòng thom thế hệ thứ hai được hình thành bằng cách thay thế vòng cuối cùng trong chuỗi của vitamin A bằng các hệ thống vòng khác nhau. Nhóm này bao gồm acitretin và etretinate.
- Retinoids nhiều vòng thơm thế hệ thứ ba được tổng hợp bằng nối vòng chuỗi bên polyene, và chúng được gọi là arotinoids. Chúng bao gồm adapalene, tazarotene và bexarotene (3,4).
Gần đây, một loại retinoid bôi ngoài da đầu tiên của thế hệ thứ tư, trifarotene, đã được mô tả và đang được nghiên cứu về tính an toàn và hiệu quả lâm sàng đối với mụn trứng cá và bệnh vảy cá phiên mỏng (5,6).
3. Cơ chế hoạt động
3.1 Vận chuyển nội bào đến nhân
Khi retinoids được thoa lên da, các phân tử đi qua màng tế bào của tế bào sừng thông qua quá trình nội bào qua trung gian không thụ thể (7). Các con đường hoạt động của cơ chế phân tử nội bào đã được nghiên cứu kỹ ở ATRA nhưng có thể không có giá trị đối với tất cả các hợp chất retinoid tại chỗ. Khi ở trong tế bào chất, ATRA được vận chuyển đến nhân bởi các protein liên kết axit retinoic của tế bào (CRABPs). CRABP chiếm ưu thê trong da là CRABPII, và nó được coi là đóng một vai trò quan trọng trong sinh khả dụng của retinoid, vì nó được điều chỉnh bởi ATRA (8).
3.2 Các thụ thể Retinoid nhân và sự phân bố của chúng trên da người
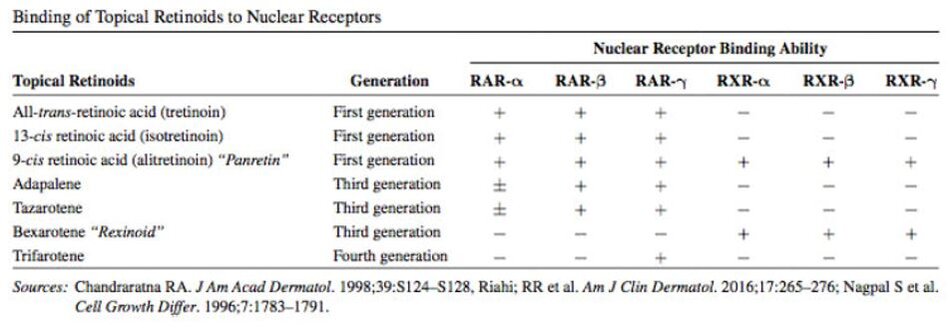
Các tác dụng sinh lý và dược lý của retinoid chủ yếu qua trung gian của hai họ riêng biệt của các thụ thể retinoid nhân: thụ thể retinoic acid (RAR) và thụ thể retinoid X (RXR) (Bảng 3.1). Các họ thụ thể này được gọi là các yếu tố phiên mã phụ thuộc phối tử và chúng thuộc vê một siêu họ các thụ thể hormone nhân bao gôm steroid, hormone tuyến giáp, vitamin D và các thụ thể kích hoạt peroxisome (PPAR). Cả hai họ RAR và RXR đều thể hiện ba dạng isotype thụ thể (a,p, ỳ) và một số dạng isoform cho mỗi isotype. RAR và RXR có ái lực liên kết phối tử khác nhau; ATRA chỉ liên kết với RAR, trong khi 9-cis RA liên kêt với cả RAR vậRXR. Mỗi thụ thề retinoid nhân thể hiện câu trúc mô-đun bao gồm sáu vùng. Trong số đó, ba vùng có tầm quan trọng: vùng A / B duy trì chức năng kích hoạt phiên mã độc lập với phối tử, vùng c chứa miền nhận biết và liên kết DNA, và vùng E tưong ứng với miền liên kết phối tử (9). Biểu bì của con người biểu hiện tât cả các dạng đông phân RAR và RXR, nhưng RAR-y và RXR-ađại diện cho phần lớn các thụ thề retinoid ở da (10-12). Mức RXR được tìm thấy lớn hon 5 lần so với RAR trong da (12).
Các thụ thể retinoid liên kêt với retinoid ở dạng dimer. Các RAR chỉ hoạt động khi chúng tạo thành các dị bội với RXR (RAR / RXR), trong khi các RXR cũng có thể hoạt động như các mô-đun (RXR / RXR). RXR cũng có thể hình thành dị thể với nhiều loại thụ thể nhân khác như vitamin D, pp AR và hormone tuyên giáp, và thực tê này cung cấp cơ chếchokhảnăng của retinoids để kích hoạt các con đường tế bào khác nhau (10- 12).
3.3 Retinoic Acid- Phiên mã gen qua trung gian
Cho rằng các thụ thể retinoid là yếu tố phiên mã, chúng sẽ thực hiện các tác động sinh học trên da thông qua việc điều chỉnh sự hoạt hóa hoặc ức chế biểu hiện gen. Trong trường hợp không có phối tử, các thụ thể retinoid được liên kết ở dạng dimer với các trình tự DNA cụ thể được gọi là các yếu tố đáp ứng axit retinoic (RARE). Các RARE khác nhau đã được xác định trong các trình khởi động của một số gen đích retinoid. Các thụ thể retinoid không liên kết và liên kết với DNA ngăn chặn quá trình phiên mã thông qua việc thu nhận các phân tử đồng kìm hãm như đồng kìm hãm thụ thể nhân (N-CoR) và làm bât hoạt trung gian cho retinoid và thụ thể tuyên giáp (SMRT).
Liên kêt của axit retinoic với thụ thể của nó dẫn đên sự phân lỵ của các chât đông kìm hãm và tiêp theo là sự liên kết của các chất đồng hoạt hóa. Các chất đồng hoạt hóa này gây ra nhũng thay đỗi cấu trúc trong các thụ thể và phân hủy chất nhiễm sắc cô đặc bằng hoạt động của histone acetylase. Sự thay đỗi cấu trúc này tạo điều kiện thuận lợi cho việc định vị bộ máy phiên mã ở phần khởi động của DNA và dẫn đến quá trình phiên mã. Các thụ thể retinoid điều hòa quá trình phiên mã của một số lượng lớn các gen chủ yếu đóng vai trò trong sự biệt hóa (13,14).
Ngoài việc điều hòa trực tiếp phiên mã phụ thuộc RARE này, retinoids có thể gián tiếp điều hòa một số gen bằng cách đối kháng với tác động của chất hoạt hóa yếu tố phiên mã protein-1 (API). API kiểm soát một loạt các quá trình tế bào, bao gồm tăng trưởng, tăng sinh và chết tự nhiên của tế bào. Sự ức che API gián tiếp dường như là một cơ chế chính của tác dụng chống tăng sinh dược lý, chống ung thư và chống viêm của retinoid (15). Ngoài các tác động trên gen của nó, một số chức năng của retinoid được chứng minh là thông qua các tác động không thuộc gen (ví dụ, quá trình phosphoryl hóa), nhưng sự liên quan về mặt sinh học của chúng vẫn đang được nghiên cứu (16).
3.3 Chuyển hóa nội bào của Retinoid tự nhiên
Retinoids bôi bên ngoài được chuyển hóa trong lớp biểu bì của người. Retinol all- trans dư thừa trong tế bào sừng được este hóa thành retinyl este, được xúc tác bởi lecithin: retinol acyltransferase (LRAT) hoặc được oxỵ hóa tuần tự thành ATRA, với all-trans retinaldehỵde là chât chuyển hóa trung gian. ATRA dư thùa trong tê bào được dị hóa bởi hệ thống enzym cytochrome-P450, như CYP26, thành các chất chuyển hóa của nó là axit 4-hyroxỵ-all-trans-retinoic và axit 4-oxo-retinoic.
Quá trình này có thể được tạo ra bởi chính axit retinoic và có thể cho thấy sự thay đổi quan trọng giữa các cá thể. Nó có thể là lý do cho sự khác biệt giữa cấc cá nhân trong phản ứng với retinoids bôi tại chỗ (17). Ngoài ra, sự dị hóa ATRA do CYP26 gây ra bởi ATRA Ịà cơ chế chính của việc đê kháng với retinoids. Để vượt qua sự đê kháng này, một chiên lược mới đã được phát triển, nhằm mục đích tăng mức ATRA nội sinh trong tế bào bằng cách ức chế CYP26. Nhũng chất ức chế này được gọi là chất ngăn chặn chuyển hóa axit retinoic (RAMBAs) (18). Trong số này, liarozole, một dẫn xuất imidazole, là chất được nghiên cứu nhiều nhất và đã được chấp thuận sử dụng để điều trị bệnh vảy cá bẩm sinh (19).
4. Retinoid tổng hợp bôi tại chỗ
4.1 Tretinoin (AIl-trans-Retinoic Acid)
All-trans-Retinoic Acid là một loại retinoid thế hệ đầu tiên thường có tự nhiên trong da. Dạng tổng hợp ATRA tại chỗ (tretinoin) đã được FDA chấp thuận để điều trị mụn trúng cá và lão hoá ánh sáng (1). Nó cũng đã được sử dụng ngoài chỉ định cho một sô bệnh da liễu như rối loạn sắc tố, chữa lành thương, bệnh Darier, verrucae plana và dày sùng ánh sáng (20). Nó liên kết với tất cả các định dạng RAR, nhưng không liên kết với RXR. Nó bình thường hóa sự biệt hóa biểu mô nang và quá ưình sừng hóa. Nó làm tăng hoạt động phân bào của biểu mô nang và tốc độ luân chuyển của các tế bào sùng hoá mỏng, ít kết dính. Việc bong ưóc các tế bào sừng hoá đó khỏi nang là cơ chế chính của hoạt động phân giải mụn trứng cá của nó. Ngoài ra, nó đã được chứng minh là gây ra biểu hiện của yếu tố tăng trưởng giống EGF liên kết với heparin (HB-EGF), dẫn đến tăng sản biểu bi ở biểu bì bị teo do tổn thưong ánh sáng (21,22).
4.3 Isotretinoin
Axit retinoic 13-cis (isotretinoin) là một chất đồng phân lập thể của tretinoin và xuất hiện tự nhiên từ quá trình chuyển hóa tretinoin trong lóp biểu bì (23). Các dẫn xuât tổng hợp của nó hoạt động theo cách tương đương với tretinoin và làm thay đỗi biểu mô của nang và hỗ trợ bong tróc da; tuy nhiên, isotretinoin dường như có tác dụng chống viêm hon một chút so với chất đồng phân lập thể của nó. Sự ức chế sự di chuyên qua da của bạch cầu đa nhân trung tính do leukotriene-B4 biểu hiện rõ rệt hon khi dùng isotretinoin bôi tại chỗ so với tretinoin (24). Điều này có thể giải thích mức độ kích úng hoặc viêm tương đối thấp khi dùng isotretinoin tại chỗ, giúp bệnh nhân dễ sử dụng hon.
4.4 Adapalene
Adapalene là một retinoid tổng hợp ỗn định về mặt hóa học, ồn định quang học và rất ưa béo, có ái lực chọn lọc với các thụ thể retinoid RAR-p và RAR-y. Mặc dù nó không liên kết với CRABP, nó đã được chứng minh là gây ra sự biểu hiện của CRABP- II. Chỉ định được FDA chấp thuận của nó là mụn trứng cá. Do đặc tính ưa chất béo, nó được đon vị nang lông hấp thụ một cách có chọn lọc và điều đó có thể góp phần vào hiệu quả của nó trong tác dụng chống mụn trứng cá. Nó bình thường hóa sự biệt hóa và sùng hóa của các tế bào biểu mô nang, do đó dẫn đến hiệu ứng phân giải mụn ưúng cá.
Ngoài ra, trái ngược với các retinoid cỗ điển khác, adapalene là một dẫn xuất axit naphthoic có cấu trúc giống NSAID và tăng tác dụngchống viêm. Nó làm giảm sản xuất leukotriene và prostaglandin thông qua việc ức chế hoạt động của lipoxygenase và chuyển hóa axit arachidonic (25).
Adapalene có thể điều chỉnh hệ thống miễn dịch biểu bì bằng cách tăng biểu hiện CD1 d và giảm biểu hiện IL-10 của tê bào sừng. Việc giảm biểu hiện của thụ thể số-2 (TLR-2) bởi tế bào sừng có thể giúp giải thích hoạt động chống viêm của adapalene được quan sát trong thực hành lâm sàng (26). Những cơ che này có thể giải thích lý do giảm nguy cơ kích ứng với adapalene. Sự hấp thu toàn thân của adapalene là không đáng kể. Chỉ một lượng nhỏ được tìm thấy trong huyết tương của bệnh nhân mụn trứng cá sau khi bôi adapalene tại chỗ trong thời gian dài.
4.5 Tazarotene
Tazarotene là một tiền chất trải qua quá trình thủy phân esterase trong mô da để tạo thành chất chuyển hóa có hoạt tính, axit tazarotenic. Nó có ái lực với RAR-y / p cao hon RAR-a, nhưng nó không liên kết với RXR (3). Các chỉ định được FDẠ chấp thuận để sử dụng tại chỗ là bệnh vẩy nên và mụn ưứng cá. Nó điêu chỉnh cơ chê bệnh sinh của bệnh vẩy nến bằng cách điều chỉnh sự biểu hiện gen của các gen cảm ứng retinoid, bao gồm những gen điều chỉnh sự tăng sinh, biệt hóa và viêm của tế bào. Tazarotene dường như điều hòa sự biểu hiện của enzyme transglutaminase tế bào sừng, tăng sinh keratins K6 và KI6, IL-6, antileukoproteinase có nguồn gốc từ da (SKALP), involucrin, và protein liên quan đến yếu tố ức chế di cư (27); tuy nhiên, nó có thể tạo ra filaggrin, chất không được biểu hiện ở da bị vảy nến.
Bagen cảm úng tazarotene (TIG-1, TĨG-2, TIG-3) được mô tả. Mặc dù vai trò chính xác của chúng ưong cơ chế sinh bệnh vảy nến không rõ ràng, nhưng biểu hiện của chúng ở vùng da vảy nến rất thấp so với vùng da bình thường lân cận. T1G-2 / TĨG-3 cũng không được biểu hiện trong ung thư biểu mô tế bào vảy ở da và ung thư biểu mô tế bào đáy (28,29). Sự biểu hiện của các gen đó bởi tazarotene dẫn đến giảm sự tăng sinh tế bào sừng ở da bị vảy nến. Sự hấp thu toàn thân của tiền chất rất thấp do chuyển hóa qua da nhanh chóng (3).
4.6 Bexarotene
Bexarotene liên kết có chọn lọc với các thụ thể RXR, và do đó nó là một “rexinoid”. Chỉ định được FDA chấp thuận để sử dụng tại chỗ là u lympho tế bào T ở da (CTCL). Bexarotene ức chê chu kỳ tê bào và gây ra quá trình chêt tê bào của tê bào T ác tính băng cách kích hoạt các thụ thể RXR. Nó gây ra quá trình chết tế bào bằng cách giảm protein chống apoptotic (Survivin) và kích hoạt caspase-3 (30).
Các RXR cũng có thể tạo thành dị thể với các thụ thể nhân không retinoid bao gồm vitamin D, hormone tuyến giáp và PPAR. Nó có thể cho thấy một số tác dụng chống viêm và chống khối u thông qua việc tạo ra con đường PPAR-y. Nồng độ thuốc trong huyết tương sau khi bôi thường thấp nhưng phụ thuộc vào diện tích bề mặt cơ thể được điều trị.
Alitretionin (Axit Retinoic 9-cis)
Alitretionin là một retinoid tự nhiên được tìm thấy thường xuyên trong da. Nó liên kết hiệu quả với tất cả RAR và RXR, do đó, nó được gọi là “chất chủ vận toàn phần”. Một dạng tổng hợp của alitretinoin bôi tại chỗ đã được FDA chấp thuận để điều trị bệnh Kaposi sarcoma liên quan đến AIDS (KS). Tác dụng gây ra quá trình chết tế bào của alitretinoin liên quan đến RXRs, trong khi RARs làm trung gian cho hoạt động chống tăng sinh. Alitretionin đã được chứng minh là làm giảm sự biểu hiện của IL-6 và thay đổi sự biểu hiện của các gen sinh ung thư được mã hóa của virus có trong các tổn thương của KS (31,32).
4.7 Trifarotene
Trifarotene là một loại retinoid bôi ngoài da thế hệ thứ tư mới nhất với hoạt tính RAR-selective mạnh mẽ và có chọn lọc giúp phân biệt nó với retinoid bôi ngoài da thế hệ thứ nhất và thứ ba (5). Nó được phát triển đễ sử dụng tại chỗ trong điều trị mụn trứng cá và bệnh vảy cá phiến mỏng. Trong các mẫu ở chuột, trifarotene cho thấy các đặc tính phân giải mụn, chổng viêm và chống sắc tố tốt hơn so với các retinoid bôi tại chỗ khác
(5) . Nó ổn định về mặt dược động học trong tế bào sừng, nhưng nó bị phân hủy nhanh chóng trong các microsome gan; do đó nó được cho là có tính an toàn (5). Hai nghiên cứu giai đoạn III được tiến hành gần đây về trifarotene bôi tại chỗ đã chứng minh rằng nó là một phương pháp điều trị an toàn và hiệu quả cho cả mụn trứng cá ở mặt và ở than (6) .
5. Kết luận
Retinoids tại chỗ đóng một vai trò quan trọng trong việc kiểm soát các tình trạng da khác nhau. RARs và RXRs là nhũng yếu tố then chốt trong cơ chế hoạt động của tất cả các retinoid bôi tại chỗ. Với sự hiện diện của retinoid, các RAR và RXR có thể liên kết các trình tựđiều hòa DNA cụ thể và do đó có thể thay đỗi sự biểu hiện của nhiều protein điều hòa. Bằng cách thay đổi sự biểu hiện của keratins, các yếu tố tăng trưởng và transglutaminase, retinoids tại chỗ có nhiều tác động lên sự biệt hoá và tăng sinh của biểu mô và hệ thống miễn dịch của da. Do sự khác biệt về cấu trúc của chúng, mỗi retinoid trên thị trường phải được chấp nhận như một loại thuốc riêng lẻ vì chúng cho thấy khả năng gắn kết thụ thể khác nhau, hiệu quả lâm sàng, dược lực học và tác dụng phụ (33,34) (Bang 3.2).
6. Tài liệu tham khảo
1. stuttgen G. Historical perspectives of tretinoin. J Am Acad Dermatol. 1986;15:735-740.
2. Giguere V, Ong ES, Segui p et al. Identi cation of a receptor for the morphogen retinoic acid. Nature.
1987;330:624-629.
3. Chandraratna RA. Rational design of receptor-selective reti- noids. J Am Acad Dermatol.
1998;39:S124-128.
4. Rigopoulos D, Ioannides D, Kalogeromitros D et al. Comparison of topical retinoids in the treatment
of acne, ơin Dermatol. 2004;22:408-411.
5. Aubert J, Piwnica D, Bertino B et al. Non clinical and human pharmacology of the potent and
selective topical retinoic acid receptor-gamma agonist trifarotene. Br J Dermatol. 2018;179:442- 456.
6. Tan J, Thiboutot D, Popp G et al. Randomized phase 3 evalua- tion of trifarotene 50 muG/G cream
treatment of moderate facial and truncal acne. J Am Acad Dermatol. 2019;80(6): 1691-1699.
7. Vieira AV, Schneider WJ, Vieira PM. Retinoids: Transport, metabolism, and mechanisms of action. J Endocrinol. 1995;146:201-207.
8. Reichrath J, Lehmann B, Carlberg c et al. Vitamins as hor- mones. Horm Metab Res. 2007;39:71-84.
9. Bastien J, Rochette-Egly c. Nuclear retinoid receptors and the transcription of retinoid-target genes. Gene. 2004;328:1-16.
10. Reichrath J, Mittmann M, Kamradt J et al. Expression of retinoid-X receptors (-alpha, -beta, – gamma) and retinoic acid receptors (-alpha, -beta, -gamma) in normal human skin: An immunohistological evaluation. Histochem J. 1997;29:127-133.
11. Fisher GJ, Voorhees JJ. Molecular mechanisms of retinoid actions in skin. FASEB J. 1996;10:1002-1013.
12. Fisher GJ, Tai war HS, Xiao JH et al. Immunological iden- ti cation and functional quantitation of retinoic acid and retin oidx receptor proteins in human skin. JBiol Chem. 1994;269:20629-20635.
13. Chen JD, Evans RM. A transcriptional co-repressor that interacts with nuclear hormone receptors. Nature. 1995;377:454 -457.
14. Glass CK, Rosenfeld MG. The coregulator exchange in transcriptional functions of nuclear receptors. Genes Dev. 2000;14:121-141.
15. Lefebvre p. Molecular basis for designing selective modula- tors of retinoic acid receptor transcriptional activities. Curr Drug Targets Immune Endocr Metab Disord. 2001;1:153-164.
16. Blomhoff R, Blomhoff HK. Overview of retinoid metabolism and function. J Neurobiol. 2006;66:606-630.
17. Smith G, Wolf CR, Deeni YY et al. Cutaneous expression of cytochrome P450 CYP2S1: Individuality in regulation by therapeutic agents for psoriasis and other skin diseases. Lancet. 2003;361:1336-1343.
18. Njar VC, Gediya L, Purushottamachar p et al. Retinoic acid metabolism blocking agents (RAMBAs) for treatment of cancer and dermatological diseases. Bioorg Med Chem. 2006;14:4323-4340.
19. Vahlquist A, Blockhuys s, steijlen p et al. Oral liarozole in the treatment of patients with moderate/severe lamellar ich- thyosis: Results of a randomized, double-blind, multina- tional, placebo-controlled phase II/in trial. Br J Dermatol. 2014;170:173-181.
20. Riahi RR, Bush AE, Cohen PR Topical retinoids: Therapeutic mechanisms in the treatment of photodamaged skin. Am J Clin Dermatol. 2016;17:265-276.
21. Stoll sw, Elder JT. Retinoid regulation of heparin-binding EGF-like growth factor gene expression in human keratino- cytes and skin. Exp Dermatol. 1998;7:391-397.
22. Darien ski R, Surber c, Fluhr JW. Topical retinoids in the management of photo dam aged skin: From theory to evidence- based practical approach. Br J Dermatol. 2010;163:1157-1165.
23. Lehman PA, Mai any AM. Evidence for percutaneous absorp- tion of isotretinoin from the photo-isomerization of topical tretinoin. J Invest Dermatol. 1989;93:595-599.
24. Wozel G, Chang A, Zultak M et al. The effect of topical reti- noids on the leukotriene-B4-induced migration of polymer- phonuclear leukocytes into human skin. Arch Dermatol Res. 1991;283:158-161.
25. Jones DA. The potential immunomodulatory effects of topical retinoids. Dermatol Online J. 2005;ll:3.
26. Tenaud I, Khammari A, Dreno B. In vitro modulation of TLR-2, CDld and IL-10 by adapalene on normal human skin and acne in ammatory lesions. Exp Dermatol. 2007;16:500-506.
27. Duvic M, Asano AT, Hager c et al. The pathogenesis of pso- riasis and the mechanism of action of tazarotene. J Am Acad Dermatol. 1998;39:S129-133.
28. Peris K, Fargnoli MC, Chimen ti s. Preliminary observations on the use of topical tazarotene to treat basal-cell carcinoma. N Engl J Med. 1999;341:1767-1768.
29. Zheng Y, Luo s, Wang G et al. Downregulation of tazaro- tene induced gene-2 (TIG2) in skin squamous cell carcinoma. Eur J Dermatol. 2008;18:638-641.
30. Zhang c, Hazarika p, Ni X et al. Induction of apoptosis by bexarotene in cutaneous T-cell lymphoma cells: Relevance to mechanism of therapeutic action. Clin Cancer Res. 2002;8:1234- 1240.
31. Duvic M, Friedman-Kien AE, Looney DJ et al. Topical treat- ment of cutaneous lesions of acquired immunode ciency syndrome-related Kaposi sarcoma using alitretinoin gel: Results of phase 1 and 2 trials. Arch Dermatol. 2000;136:1461-1469.
32. Bodsworth NJ, Bloch M, Bower M et al. Phase in vehicle- controlled, multi-centered study of topical alitretinoin gel 0.1% in cutaneous AIDS-related Kaposi’s sarcoma. Am J ơin Dermatol. 2001;2:77-87.
33. Cunliffe WJ. A new topical retinoid—why a new topical acne therapy? Br J Dermatol. 199 8;139 (Suppl 52): 1-2.
34. Khalil s, Bardawil T, Stephan c et al. Retinoids: A journey from the molecular structures and mechanisms of action to clinical uses in dermatology and adverse effects. J Dermatolog Treat. 2017;28:684-696.
35. Nagpal s, Thacher SM, Patel s et al. Negative regulation of two hyperproliferative keratinocyte differentiation markers by a retinoic acid receptor-sped c retinoid: Insight into the mechanism of retinoid action in psoriasis. Cell Growth Differ. 1996;7:1783-1791.



